基于LEAF GUI软件提取植物叶脉信息的方法
2021-04-27于可心刘梦菂
于可心,刘梦菂
(南京林业大学生物与环境学院,江苏 南京210037)
叶片是植物光合作用的主要器官,其中叶脉承担着运输水分、养分和光合产物的重要任务。对叶脉的脉络模式、拓扑结构与其功能间相互关系的研究具有重要生态学意义,但由于叶脉提取难度的限制,当前的理论成果尚不成熟,相关研究难以突破。
传统的叶脉提取方法是利用Sobel算子提取叶脉边缘信息,其主要原理是检测图像中灰度值发生跳变的像素区域。对于叶片而言,叶边缘和脉络是重要的特征信息,一些脉络属于边界像素,但部分脉络的像素灰度变化平缓;同时脉络的像素宽度较窄,通常只有几个像素。因此,运用传统的边缘检测方法经常无法得到令人满意的结果。李灿灿等提出一种基于改进的Sobel算子和色调信息相结合的叶脉提取方法。但该方法不适用于没有图像分析经验的研究人员,且不能大量处理叶脉材料。有学者提出,使用色调和强度信息的快速叶脉提取方法,该方法将叶片图像分为叶脉与叶肉颜色有明显差别和无明显差别两类,有显著差异的叶片图像可以在HIS(Hue Saturation Intensity)颜色空间下使用色调信息进行提取,无显著差异的叶片图像则需要同时使用色调和强度信息,该方法能提高叶脉提取的速度。但该方法不能明显区分颜色是否有显著差异,需要人工辅助。
基于已有的叶脉提取方法技术要求高,算法复杂,处理叶片数量有限等难题,本文以木兰科含笑(Michelia figo
)为例,介绍一种大批量处理植物叶片、提取植物叶脉的方法。1 材料与方法
1.1 材料
2019年9月13日,在江苏省南京市南京林业大学校园内(118°48′52″E,32°03′09″N)选择生长健康的含笑,采集完全展开且没有病虫害的含笑叶片,采到的叶片用塑封袋(28 cm×20 cm)保存,防止蒸腾作用造成的叶片卷曲皱缩。采完后立即回到实验室,擦拭干净并确认叶片完整,对叶片进行编号。
1.2 设备与用具
固体NaOH、番红溶液、标签牌、细眼网袋(15 cm×10 cm,25 cm×15 cm)、塑料盆、SUPOR ST24P1不锈钢锅(苏泊尔)、SUPOR-SDHCB9E8-210电磁炉(苏泊尔)、EPSON-V550扫描仪(爱普生)。
1.3 操作步骤
1.3.1 化学方法处理叶片
(1)标签编号。将采回的叶片擦拭干净,确认叶片完整后进行编号。标签牌系于叶柄处并写上叶片的标号;标签与叶片排列整齐后装入细眼网袋,打结系紧。
(2)配制溶液。用固体NaOH配制浓度为5%~10%的NaOH溶液,并倒入不锈钢锅。
(3)叶片煮沸。将装入叶片的袋子放入NaOH溶液中加热煮沸至叶肉腐烂,时长约30 min。加热过程中要定时检查叶肉的腐烂程度,避免加热过长使叶脉和叶肉无法分离。加热的过程中不要加盖,防止沸腾时NaOH溶液溢出。
(4)去除叶肉。煮好的叶片置于清水中多次清洗,顺着叶脉方向洗去叶肉。清洗过程中动作要轻柔,避免用力过度破坏叶脉的完整性。
(5)叶脉染色。将清洗干净的叶脉平整地浸泡在番红溶液中,使叶脉能够均匀着色;同时,叶片间保持有序摆放,避免标签缠绕。2 h后将叶脉放入清水,多次清洗去掉浮色后取出。
(6)叶脉干燥。将染色完毕的叶脉展平在报纸上自然晾干,叶脉近干时夹在书本中或用重物压住,防止自然风干时叶脉卷曲翘起。
(7)扫描叶脉。叶脉完全干透后用扫描仪扫描(如图1),后续用LEAF GUI(Leaf Extraction and Analysis Framework Graphical User Interface)软件处理。

图1 化学方法处理后的含笑叶片
1.3.2 LEAF GUI软件使用方法
LEAF GUI是一项基于MATLAB编程环境开发的、分析植物叶脉宏观结构的软件(见图2)。它能通过一系列阈值、清除和分割算法,提取叶脉及周围网眼尺寸和位置的描述性统计数据,包括叶脉的长度、面积、各级脉络的连接度和网眼的面积、形状等一系列叶脉信息。该软件相比于其他的图像分析软件,能让使用者在短时间内获得数以千计的与叶脉相关的统计数据。LEAF GUI作为一项交互式的图像分析软件,其最大的优点是可以使没有图像分析技能专长的人员通过几个按钮的操作直接提取图像中的叶脉信息,量化整个叶脉网络的几何结构,克服了由于叶脉的大小和复杂性产生的困难。主窗口共有设置比例和裁剪(Set Scale and Crop)、过滤(Filtering)、阈值(Thresholding)、图像存储(Image Storage)、清除二进制图像(Clean Binary Image)、图像分割(Image Segmentation)和统计汇总(Summary Statistic)7个面板。
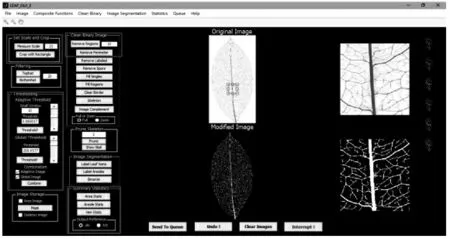
图2 LEAF GUI软件操作界面主窗口及使用按钮
本文将对所要用到的面板进行简要的介绍和操作说明:
(1)导入图像。使用文件(File)->打开图像(Open Image)或Ctrl+O导入已扫描的图像。主窗口同时出现四个图像,分别为原始图像(Original Image)、原始图像放大(Original Zoom)、修改后图像(Modified Image)、修改图像放大(Modified Zoom)。
(2)设置比例。比例尺已知时,可直接在设置比例与裁剪面板测量比例(Measure Scale)按钮右侧方框中输入比例尺;比例尺未知时,需要手动测量。导入一段已知刻度的比例尺图像后,在方框中输入比例尺的实际长度(以mm为单位),单击测量比例按钮。先点击比例尺的一端,然后拖动光标,使其与比例尺的另一端对齐,双击比例尺,相应的比例会自动出现在方框中。
(3)调整阈值。通过调整阈值将导入的RGB图像或灰度图像转化为二进制图像。阈值面板下有自适应阈值(Adaptive Threshold)和全局阈值(Global Threshold)两个板块。其中自适应阈值倾向于更好地捕获较小的叶脉,而全局阈值更倾向于捕获较大的叶脉。首先,调整自适应阈值的大小,通过右侧的窗口观察叶脉的清晰度,得到清晰完整的叶脉图片;其次,点击清除区域(Remove Regions)去掉图像中多余的噪点(具体像素值根据实际情况调整);最后,勾选合并板块(Combination)中的自适应图像方框保存。全局阈值的操作同上,最后点击组合(Combine)按钮,主窗口修改后图像会出现新的组合图像。
(4)导出数据。统计数据面板共有面积数据(Area Stats)、网眼数据(Areole Stats)和叶脉数据(Vein Stats)三个统计数据功能。先选择面板下方的.xls单选按钮,单击网眼数据(Areole Stats)按钮,弹出一个对话框,询问图像是否被背景包围,点击“是”后自动保存为一个名称为叶片编号+Areole Stats的Excel表格。导出叶脉相关的数据时,单击叶脉数据(Vein Stats)按钮后,自动保存为一个名称为叶片编号+Vein Stats的Excel表格。导出叶面积相关数据前,先将全局阈值处的阈值调至最高255,单击阈值按钮后,修改后图像会变成叶片部分全白背景全黑。此时图像和背景中都含有噪声,将移除区域右侧方框中的像素值改为10 000 bpi,单击移除区域按钮去除背景中的噪声。当叶脉的有些空隙没有被填充时,使用下拉菜单中清除二进制(Clean Binary)->填充孔隙(Fill Holes)功能将叶片补充完整,单击面积数据按钮后自动保存为一个名称为叶片编号+Area Stats的Excel表格。
2 输出结果
2.1 网孔数据
导出的网孔统计数据(如图3)包括:
(1)网孔编号(Areole Number):某一网孔唯一的数字编号,从1到n共有n个。
(2)网孔面积(Areole Area,mm):该网孔的像素点所围成的区域面积。
(3)凸包面积(Convex Area,mm):网孔像素点构成的凸包区域的面积。
(4)离心率(Eccentricity):椭圆焦点与主轴之间距离的比值。
(5)可靠性(Solidity):网孔真实面积与凸包面积的比值。
(6)周长(Perimeter,mm):该网孔的周长。
(7)当量直径(Equivalent Diameter,mm):与该网孔具有相同归一化第二中心矩的圆的直径。
(8)长轴(Major Axis,mm):与该网孔具有相同归一化第二中心矩的椭圆的长轴长度。
(9)短轴(Minor Axis,mm):与该网孔具有相同归一化第二中心矩的椭圆的短轴长度。
(10)形心(Centroid):该网孔形心的坐标,Centroid 1表示横坐标,Centroid 2表示纵坐标。
(11)平均距离(Mean Distance,mm):每个网孔像素与最近叶脉像素之间的平均欧氏距离。
(12)方差距离(Variance Distance,mm):平均距离的方差。
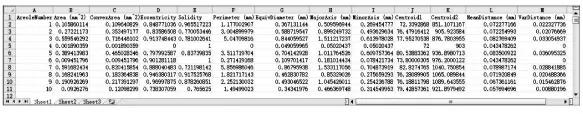
图3 网孔统计数据
2.2 叶脉数据
导出的叶脉数据包括叶脉的每个单独脉段的测量数据(如图4)和汇总统计数据(Summary Stats)(如图5)两个表格。
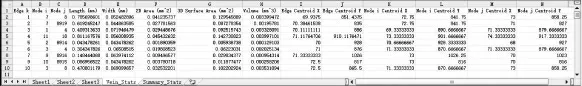
图4 叶脉单独脉段测量数据

图5 脉汇总数据
单独脉段测量数据包括:
(1)叶脉编号(Edge):该段叶脉唯一的数字编号,从1到n共有n个。
(2)节点编号(Node):该段叶脉连接的两个节点的编号。
(3)长度(Length,mm):叶脉的长度,计算该脉段沿脉络方向的像素点的数量,通过像素与实际长度的比例换算得出。
(4)宽度(Width,mm):该段叶脉的平均宽度,每个叶脉像素到两边网眼的半径距离加倍后乘以比例,得到该点处的直径,所有直径的平均值即为该叶脉的宽度。
(5)二维面积(2D Area,mm):该脉段长度与平均宽度之积。
(6)三维表面积(3D surface area,mm):通过该脉段的长度、平均宽度和圆柱体表面积公式得到。
(7)体积(Volume,mm):通过该脉段的长度、平均宽度和圆柱体体积公式得到。
(8)形心(Centroid):该脉段中心点和两个节点的坐标。
叶脉的汇总数据包括:
(1)叶脉数量(Number of Edges):该叶片所有的叶脉的小段数。
(2)节点数量(Number of Nodes):该叶片所有叶脉节点的数量。
(3)叶脉总长度(Total Network Length,mm):所有小段叶脉的长度累加。
(4)叶脉总面积(Total Network Area,mm):所有小段叶脉的面积累加。
(5)平均叶脉长度(Mean Edge Length,mm):各小段叶脉的平均长度。
(6)平均宽度(Mean Width,mm):各小段叶脉的平均宽度。
(7)平均二维面积(Mean 2D Area,mm):各小段叶脉的平均二维面积。
(8)平均三维表面积(Mean 3D Surface Area,mm):各小段叶脉的平均三维表面积。
(9)平均体积(Mean Volume,mm):各小段叶脉的平均体积。
2.3 面积、周长数据
导出的网孔统计数据(如图6)包括:
(1)面积(Area,mm):该叶片的总面积。
(2)周长(Perimeter,mm):该叶片的周长。
(3)比例(Scale,pixels per mm):输入或手动测量的实际距离与像素值的比值。

图6 面积、周长数据
3 讨论
相对于传统的叶脉提取方法,LEAF GUI软件对于大批量处理叶片具有更准确、更易操作的特点,有助于解决部分已经提出却未能证实的叶脉结构相关的理论。陈静等在研究车桑子(Dodonaea viscosa
)叶脉密度与叶氮含量关系时,用显微镜选择拍摄每个叶片的两端及中间部位3个视野的图像,采取Motic Images Plus 2.0软件获得各个照片中叶脉的总长度。由于不同大小和不同位置的叶脉特征存在一定差异性,用该方法计算的叶脉密度与用LEAF GUI软件处理得到的完整叶片密度相比,误差较大,数据分析缺乏代表性,使得研究结论停留在定性说明而非定量分析。LEAF GUI软件对图片清晰度有较高的要求,图像与背景之间的对比度越高,越有利于叶脉的提取。该软件也并非完全精确测量,进一步提升图像处理的质量还有待于科研人员更新改进算法。(致谢:本文在写作过程中得到导师时培建副教授的指导,特此表示感谢!)
