化瘀消癥复方对PI3K/Akt/mTOR信号通路及输卵管妊娠滋养细胞的作用机制研究
2021-04-26袁烁陈敏红邓高丕
袁烁 陈敏红 邓高丕
中医认为输卵管妊娠的发病机理与少腹素有瘀滞、冲任不畅、胞络受阻、孕卵移行受到阻滞、不能顺利进入胞宫有关,故中医对输卵管妊娠的治疗是以化瘀消癥杀胚为大法。宫外孕I号方(丹参、赤芍、桃仁)作为治疗异位妊娠的方剂,从1956年开始应用于临床[1]。研究团队在宫外孕I号方的基础上,加上了从现代药理研究角度对滋养细胞具有抑制作用的紫草[2]、天花粉[3]组成化瘀消癥复方。在前期开展了一系列复方治疗输卵管妊娠的机制探索,结果发现化瘀消癥复方可通过诱导FAS/FASL、Bcl-2/Bax凋亡通路[4-5],促进相关蛋白的表达增加,而影响滋养细胞的凋亡程序;或通过对雌孕激素发挥拮抗作用[6],对溶解输卵管蜕膜、引起绒毛及蜕膜组织的性质改变产生干扰;或通过干预细胞周期进程,上调增殖抑制率[7];或呈浓度、时间依赖性地影响FAK信号通路表达,抑制滋养细胞迁移力[8],进而起到抑制滋养细胞活性,阻滞输卵管妊娠进展的目的。本实验基于前期研究基础,着眼于PI3K/Akt/mTOR 信号通路,旨在探索化瘀消癥复方对输卵管妊娠滋养细胞凋亡、侵袭影响的调控机制。
1 材料与方法
1.1 试剂与仪器
化瘀消癥复方由紫草、天花粉、赤芍、丹参、桃仁各15 g组成,药物购自广州中医药大学第一附属医院药学部;甲氨蝶呤(广东岭南制药有限公司;批号:472004);LY294002(RE-Vectec;批号:WXBC0225V);雷帕霉素(rapamycin,Rapa)(RB-sigma;批号:92M4616V);胎牛血清(Biological Industries;批号:1435272);DMEM/F12培养基(Gibico;批号:8114362);0.25%胰蛋白酶(Gibico;批号:1616025);HBSS(1×)(Gibico;批号:C-0130);Hanks(10×)(Sigma;批号:RNBC1413);一抗p-AKT(R&D;批号:AF887);一抗p-雷帕霉素靶蛋白(mammalian taget of rapamycin,mTOR)(Cell Signaling;批号:2983S);Annexin V-FITC细胞凋亡试剂盒(上海贝博生物公司;批号:BB130031);Transwell板(Corning;批号:3422);Matrigel胶(Corning;批号:354277)。
主要仪器:CO2培养箱:英国 NEW BRUNSWICK SCIENTIFIC 公司;低/高速离心机:科大创新股份有限公司中佳分公司;细胞自动计数仪:美国 CELLOMETER 公司;全自动化学发光免疫分析仪:美国 Beckman 公司;脱色摇床:海门市其林贝尔公司;倒置荧光显微镜:日本 Nikon EclipseTi-s;流式细胞仪:美国 Beckman 公司。
1.2 细胞培养
手术中取输卵管妊娠部位典型的绒毛组织,剪碎后进行体外培养,差异贴壁法分离纯化,传代至第四代,进行细胞鉴定,细胞抗波形蛋白(Vimentin)阴性,抗角蛋白(Cytokeratin 18,CK18)阳性者为符合实验要求的滋养细胞[9]。当细胞长满25 cm2培养瓶底90%时传代,用PBS清洗2次,加入1 mL 0.25%胰酶的消化液进行消化,37℃孵育3~5分钟,镜下观察90%以上细胞悬浮,吸出细胞悬浮液置于15 mL离心管中800 r/min离心5分钟,弃上清。用含10%胎牛血清的DMEM/F12重悬,按1∶2比例接种于25 cm2培养瓶中继续培养。
1.3 化瘀消癥复方及各组培养液制备
紫草、天花粉、赤芍、丹参、桃仁各15 g,取2 剂共150 g,加入8倍药物体积纯水,2次煮沸,过滤,将所得滤液于旋转蒸发仪上减压浓缩。将复方水煎剂溶于无血清的 DMEM/F12,过 0.22 μm 滤膜。配成低剂量组2.5 mg/mL、中剂量组5 mg/mL、中药高剂量组10 mg/mL的无血清DMEM 培养液。将甲氨蝶呤溶于无血清的DMEM/F12,过0.22 μm滤膜,配制成浓度为1 mg/mL的无血清DMEM培养液。将LY294002[胞磷脂酰肌醇3-激酶(phosphatidy linositol 3-kinase,PI3K)抑制剂]溶于无血清的 DMEM/F12,过0.22 μm滤膜,配制成浓度100 μmol/mL的无血清 DMEM 培养液。 将LY294002(PI3K抑制剂)溶于无血清的 DMEM/F12,过0.22 μm 滤膜,配制成浓度100 μmol/mL的无血清DMEM培养液。将Rapa(mTOR抑制剂)溶于无血清的DMEM/F12,过0.22 μm滤膜,配制成浓度300 μmol/mL的无血清 DMEM 培养液。以上培养液配置后置于-20℃保存。
1.4 分组与药物干预方法
将滋养细胞分为空白组、中药低、中、高剂量组、LY294002组和Rapa组。空白组:继续予DMEM培养液培养;中药低、中、高剂量组:分别以2.5 mg/mL、 5 mg/mL、10 mg/mL的无血清 DMEM 培养液培养;西药组:以甲氨蝶呤浓度为 1 mg/mL的无血清DMEM培养液培养;LY294002组:以LY294002(PI3K抑制剂)浓度为100 μmol/mL的无血清 DMEM 培养液培养;Rapa组:以Rapa(mTOR抑制剂)浓度为300 μmol/mL的无血清 DMEM 培养液。
1.5 流式细胞术检测药物对细胞凋亡率的影响
6孔板细胞种植密度为 1×105细胞/孔,待细胞长满80%时, 加入空白组、中药低、中、高剂量组、西药组、LY294002组、Rapa组的培养液各2.5 mL,培养 72小时。用 PBS 洗涤 2 次,加入适量胰蛋白酶消化,收集细胞悬液,1000 r/min 4℃低温离心 5分钟,弃上清;加入预冷的 PBS 洗涤 2 次后每管加入 400 μL Binding Buffer 重悬后,加入 5 μL锚定蛋白 V-异硫氰酸荧光素(AnnexinV-FITC),4℃避光孵育 15分钟后加10 μL 碘化丙啶(PI) 4℃避光孵育15分钟,混匀上流式细胞仪测定细胞凋亡率。
1.6 Transwell 体外细胞侵袭实验
Matrigel基质胶准备,冰上操作铺胶,将生长为对数期的输卵管妊娠滋养细胞用胰酶消化,PBS稀释成 5×105细胞/mL 的浓度,待用;于Transwell 板中的每个下室添加 DMEM/F12 培养液(含 10%胎牛血清),加入空白组、中药低、中、高剂量组、西药组、LY294002组、Rapa组的培养液各2 mL,混合均匀,上室内进行接种,培养72小时后进行固定、台盼蓝染色、细胞计数。
1.7 蛋白免疫印迹法检测药物与通路抑制剂对通路蛋白的影响
6孔板细胞种植密度为 1×105细胞/孔,加入空白组、中药低、中、高剂量组、西药组、LY294002组、Rapa组的培养液各2.5 mL,每组设6个复孔,培养72小时细胞,采用蛋白免疫印迹法检测每组细胞 p-Akt,p-mTOR蛋白的表达:上样,SDS-PAGE 凝胶电泳,转膜 (湿转) 、封闭,加入一抗(1∶1000),洗涤,加入二抗反应,洗涤,配制ECL化学发光底物与膜共孵育1分钟, 放入化学发光成像分析仪内, 自动曝光, 洗片,灰度值分析,计算相对蛋白含量。
1.8 统计学处理
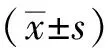
2 结果
2.1 各组细胞凋亡率比较
与空白组对比,各组细胞凋亡率均上升,差异具有统计学意义(P<0.05)。中药高剂量组较空白组、中药低剂量组、中剂量组的细胞凋亡率上升,差异具有统计学意义(P<0.05),且呈浓度依赖性。中药高剂量组较西药组的细胞凋亡率上升,差异具有统计学意义(P<0.05)。与LY294002组、Rapa组对比,中药高剂量组的细胞凋亡率差异无统计学意义(P>0.05)。详见图1、表1。
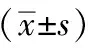
表1 各组细胞凋亡率比较
2.2 各组细胞侵袭能力比较
与空白组对比,各组的过膜细胞数均减少,差异具有统计学意义(P<0.05)。中药高剂量组较中药低剂量、中剂量组过膜细胞数减少,差异具有统计学意义(P<0.05),且呈浓度依赖性。与西药组、Rapa组对比,中药高剂量组的过膜细胞数差异无统计学意义(P>0.05)。与LY294002组对比,中药高剂量组的过膜细胞数增加,差异具有统计学意义(P<0.05)。详见图2、表2。

注:A:空白组; B:中药低剂量组;C:中药中剂量组;D:中药高剂量组;E:西药组;F:LY294002组;G:Rapa组。

注:A:空白组; B:中药低剂量组;C:中药中剂量组;D:中药高剂量组;E:西药组;F:LY294002组;G:Rapa组。

表2 各组细胞侵袭力比较
2.3 各组细胞PI3K/Akt/mTOR信号通路相关蛋白表达比较
与空白组对比,各组的p-Akt、p-mTOR蛋白表达均下降,差异具有统计学意义(P<0.05);中药高剂量组较中药低、中剂量组,p-Akt、p-mTOR蛋白表达下降,差异具有统计学意义(P<0.05),且呈浓度依赖性。与LY294002组对比,中药高剂量组、西药组细胞中 p-Akt 蛋白水平差异无统计学意义(P>0.05);与Rapa组对比,中药高剂量组、西药组p-mTOR蛋白水平差异无统计学意义(P>0.05);详见图3、表3。

注:A:空白组; B:中药低剂量组;C:中药中剂量组;D:中药高剂量组;E:西药组;F:LY294002组;G:Rapa组。
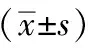
表3 各组磷酸化 Akt、mTOR蛋白比较
3 讨论
妊娠时,由凋亡引起的程序化细胞死亡,对母胎界面的种植与蜕膜化意义重大,适度的细胞凋亡促进了胚胎种植所需的血管形成,这种与凋亡相关的微妙变化,被认为对胚胎的正常发育起到正向的促进作用[10]。适度的调控是关键,若滋养细胞中关于凋亡与增殖的平衡遭到破坏,导致过度凋亡的发生,影响胚胎在着床部位的种植,可能是诱发流产增加的原因[11]。对输卵管妊娠治疗结局的期待,恰恰是与宫内正常妊娠相反的。
输卵管妊娠时,受精卵在非子宫体腔着床,绒毛滋养细胞发挥侵袭种植局部——输卵管管壁的能力,种植场所同样有细胞凋亡与增殖的发生。由于输卵管的环境异于宫腔环境,凋亡调节的平衡状态受到影响,比如抗凋亡蛋白的大量存在,导致不加控制的滋养细胞的存活、增殖[12],加之输卵管的管壁菲薄,对滋养细胞渐进性的侵袭耐受性差,最终出现输卵管管壁破裂,腹腔内出血的结局。研究团队前期已对化瘀消癥复方的作用机制做出初步探索[4-9],而PI3K/Akt/mT0R信号通路与细胞凋亡的相关性是本实验的重点。
PI3K/Akt/mTOR信号通路是一条可调控众多信号因子,与细胞增殖、分化、血管生成、胚胎发育和肿瘤侵袭的精细调节相关的通路,其介导绒毛滋养层细胞生长与侵袭借助的是生长因子的效能[13]。在这条信号通路中,Akt是最关键的因子[14],尤其表现在对细胞凋亡的抑制与对细胞增殖的促进方面。当PI3K受到上游信号刺激后,激活下游的Akt,引起Akt磷酸化,激活下游的mTOR[15],进而影响各种细胞行为。目前的研究发现该信号通路在滋养细胞种植过程中有举足轻重的作用:PI3K /Akt信号通路作为介导滋养细胞增殖、侵袭与凋亡发生的靶通路而广泛地应用于与妊娠相关的疾病研究[16]。研究表明,增强滋养细胞中PI3K/Akt信号通路的表达,可以提高Bcl-2的相对表达水平;降低Bax和Bim的表达水平,由此推断PI3K/Akt信号通路与细胞凋亡的发生呈负相关[17]。促进PI3K/AKT/mTOR通路的激活,正向促进了滋养细胞的入侵以及对氧化应激的抑制;抑制其表达可逆转上述影响[18]。在滋养细胞中,诱导基质金属蛋白酶蛋白水解活性,影响基质金属蛋白酶9和基质金属蛋白酶抑制剂1的比值变化,可能通过AKT通路[19]和mTOR信号通路[20],刺激细胞粘附和增殖,并增加侵袭性。mTOR作为自噬相关的关键调节因子,若其蛋白及磷酸化的表达被靶向抑制,可诱导细胞自噬发生和受损细胞迁移,因而影响胎盘功能障碍的发生[21]。以上研究结果表明,PI3K/Akt/mTOR信号通路及其相关蛋白的表达活性,与滋养细胞增殖、侵袭呈正相关,与滋养细胞凋亡呈负相关。该通路活性的增强,对正常宫内妊娠种植,是正向促进作用;而输卵管妊娠则反之。
化瘀消癥复方由天花粉、紫草、赤芍、桃仁、丹参组成,临床与基础研究均表明其乃治疗输卵管妊娠的有效方剂[8,22]。本实验发现化瘀消癥复方促进输卵管妊娠滋养细胞凋亡率的增加,并抑制输卵管妊娠滋养细胞的侵袭,均与药物浓度呈量-效关系;化瘀消癥复方抑制p-Akt与p-mTOR的表达,与通路抑制剂的作用结果相似。检测磷酸化的蛋白即检测处于活性状态的蛋白,与分子功能更直接相关,可直接反映PI3K/Akt/mTOR信号通路活性程度。以上结果与文献中报道的PI3K/Akt/mTOR信号通路调控滋养细胞凋亡、侵袭的趋势相一致[23-24]。
由本实验的结果推论,化瘀消癥复方治疗输卵管妊娠的可能机制是:干预上游的PI3K,使Akt磷酸化水平的表达下调,阻断下游多种抗凋亡效应分子的活化,调控 mTOR蛋白磷酸化水平的低表达,导致细胞蛋白质翻译得不到有效启动,减弱了维持细胞生长与存活的信号,从而实现对微环境中细胞凋亡状态的平衡。输卵管局部细胞凋亡的增加,使滋养细胞侵袭活性受到抑制,改善对输卵管的无限制侵袭,从而起到“杀胚”的作用。
