抗菌治疗中噬菌体与抗菌药物联合使用的研究进展及前景
2021-04-26周铁丽徐雯雅
周铁丽 徐雯雅
近年来,随着抗菌药物的广泛使用甚至滥用,细菌的耐药性不断增强,呈现出高度耐药、多重耐药的趋势[1-3]。随着多重耐药菌的不断出现及流行播散,严重细菌感染性疾病的防控变得愈加困难。噬菌体具有特异性强、不良反应小、增殖快且种类丰富等优点,近年来作为天然抗菌剂受到人们广泛关注。尽管噬菌体具有治疗多重耐药菌感染的潜力,但治疗仍存在一些“障碍”。例如,噬菌体的高特异性导致其裂解谱窄;噬菌体与细菌相互作用时,细菌可通过改变受体、超感染免疫、R-M限制修饰系统、CRISPR系统以及流产感染系统(Abi)对抗噬菌体的侵袭[4-6];某些噬菌体可能携带毒力基因或耐药基因,使得细菌从无毒性变为有毒性或无抗性变为有抗性等。目前研究表明,无论在治疗成果方面还是在遏制细菌耐受性演变方面,噬菌体与抗菌药物联合使用的效果均优于两者单独使用的效果。这种联合治疗策略可能是对抗现在细菌耐药时代的一种合乎逻辑的方法[4]。本文对噬菌体-抗菌药物协同作用的机制、临床应用现状及展望作一述评,为噬菌体-抗菌药物的进一步研发和应用提供参考。
1 噬菌体的生物学特性及杀菌机制
1.1 噬菌体的生物学特性 噬菌体是一种能特异性侵袭细菌、真菌、螺旋体和支原体等的病毒,只含有一种核酸,DNA或RNA,广泛存在于水源、土壤等各种环境甚至人和动物体内,与人类健康息息相关[5]。其种类繁多,在自然界中的数量可以达到1031,为细菌数量的10倍[6]。作为病毒的一种,噬菌体具有病毒的一些特性:个体微小,不具有完整细胞结构,只含有单一核酸,可视为一种“捕食”细菌的生物。噬菌体对理化因素的抵抗力比一般细菌的繁殖体强,一般经75℃30 min以上才失去活性,对紫外线敏感[7]。
1.2 噬菌体的杀菌机制 大多数用于治疗的噬菌体其DNA位于棱柱状头部,由蛋白质衣壳、刺和附着在细菌上的尾纤维包裹组成,还有一个中空管(尾鞘),DNA通过这个中空管流入宿主体内(图1)。不同噬菌体的结构可能有所不同。这些无生命的有机体依靠它们的细菌宿主生存,病毒复制的两个主要生命周期包括裂解(或毒性)和溶源(或温和)周期。毒性噬菌体的工作原理是裂解细菌细胞,而温和噬菌体则在细胞内休眠,不会立即杀死细胞[8]。毒性噬菌体的感染是通过将噬菌体的尾部纤维吸附到细菌细胞表面的特定受体上,开始感染毒力强的噬菌体。研究表明细菌表面存在许多受体,临床相关噬菌体针对的常见受体包括蛋白质、碳水化合物和其他主要位于细菌细胞壁组件上的细胞表面结构(如孔蛋白、外排泵、脂多糖和肽聚糖)[9]。噬菌体通过酶促过程推动一条管从其鞘中出来,在细菌表面形成一个洞,从而将遗传物质从其衣壳头部、鞘注入细菌细胞质。在理想的条件下,遗传物质能够接管宿主细菌的运作,进行复制,从而在细胞内建立新的噬菌体。这些病毒继续复制,直到细菌细胞被裂解杀死,然后噬菌体后代逃离细胞,重新启动其他细菌的感染循环[10]。
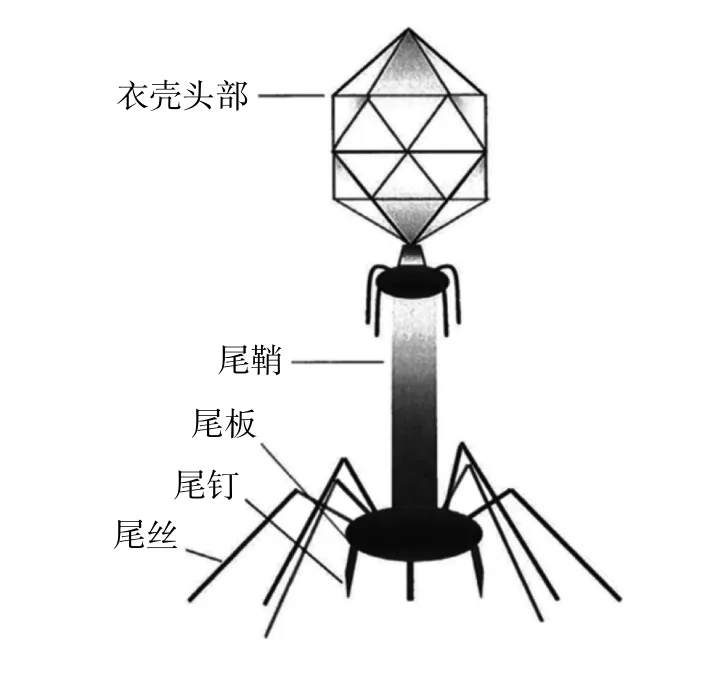
图1 肌病毒科噬菌体的结构
2 噬菌体-抗菌药物联合使用
噬菌体与抗菌药物两者作用机制差异较大,联合使用不仅可以产生更好的抑菌效果,而且可以有效抑制各自抗性菌的产生,达到较好的杀菌抑菌效果,为临床治疗多重耐药的超级细菌,提供了一种可行的治疗思路,具有极大的开发潜力。现已有部分关于噬菌体联合抗菌药物在体内或体外联合使用对抗病原菌的研究(表1),笔者将联合使用在不同细菌中的效果进行总结。

表1 噬菌体-抗菌药物联合使用对抗病原菌的成功案例
2.1 铜绿假单胞菌 迄今为止,大多数噬菌体-抗菌药物研究都集中在铜绿假单胞菌上,显然是因为它作为机会性病原体具有重要的临床影响,通常可导致囊性纤维化、烧伤感染、医院获得性肺炎、尿路感染等[18-19]。TkHilaishvili等[20]在2019年报道了1例多重耐药铜绿假单胞菌假体关节感染和骨髓炎的患者,通过结合使用假体摘除、抗菌药物间隔治疗、全身抗菌药物的使用以及留置引流管将噬菌体输送到关节间隙成功治疗感染,结果表明噬菌体-粘菌素的组合在体外对抑制铜绿假单胞菌生物膜形成具有协同作用。Torres-Barceló等[21]将噬菌体联合不同种类、不同浓度的抗菌药物对铜绿假单胞菌进行了体外敏感性实验,结果显示庆大霉素及甲氧苄啶与特异性噬菌体联合治疗具有显著的协同效应。Oechslin等[22]应用心内膜炎小鼠模型评估噬菌体联合环丙沙星对铜绿假单胞菌的杀菌作用,同样发现了明显的协同效应。Chan等[23]在应用特异性噬菌体OMKO1联合抗菌药物治疗1例多重耐药铜绿假单胞菌引起主动脉植入物感染患者的过程中发现,对噬菌体敏感的铜绿假单胞菌菌株对头孢他啶与环丙沙星耐药性高,而产生噬菌体抗性的菌株对头孢他啶与环丙沙星恢复敏感,MIC值明显降低。
2.2 大肠埃希菌 大肠埃希菌是一种在一定条件下可以引起人和多种动物发生胃肠道、尿道、血液等多种感染的条件致病菌[24]。Huff等[25]用恩诺沙星(一种用于治疗家畜的氟喹诺酮类抗菌药物)与SPR02和DAF6噬菌体的混合物同时处理肉鸡,拯救了所有实验感染禽致病性大肠埃希菌的肉鸡。这一结果与单独使用噬菌体或恩诺沙星有明显差异,后者的病死率分别为15%和3%。
2.3 肺炎克雷伯菌 肺炎克雷伯菌是肠杆菌科克雷伯菌属中非常重要的菌种之一,广泛分布于自然界的水和土壤中,是人类鼻咽部和肠道常居菌,也是常见的条件致病菌,可引起人类肺炎、脑膜炎、泌尿系统感染、脓毒症等各种感染性疾病,也是医院感染的重要病原菌之一[26-27]。研究表明,与单独用药作用12 h的肺炎克雷伯菌成熟生物膜相比,噬菌体KPO1K2和环丙沙星的联合使用抗生物膜作用无明显差异,但联合使用也没有产生负面干扰,当改用阿莫西林作为噬菌体的抗菌药物补充剂时,抗生物膜效果显著增强,表明β-内酰胺类是该噬菌体类型的首选联合药物[12]。
2.4 金黄色葡萄球菌 金黄色葡萄球菌是一种重要的院内感染病原菌,可导致血流感染、肺炎、心内膜炎等危及生命安全的重症感染[28]。Aslam等[29]报道了1例金黄色葡萄球菌引起的植入性左心室辅助装置感染并发胸骨骨髓炎患者,在经过反复清创及长期抗菌药物治疗效果欠佳后,改为头孢唑林、四环素联合3种特异性噬菌体的静脉治疗,感染完全治愈且未复发。
3 噬菌体-抗菌药物协同作用的可能机制
3.1 噬菌体-抗菌药物的协同作用 噬菌体-抗菌药物联合使用的关键是两者产生协同作用。噬菌体-抗菌药物协同作用的定义是某些亚抑菌浓度的抗菌药物可显著刺激宿主细菌内烈性噬菌体的产生,两者联用可发挥更好的抗菌活性现象[30-31]。Comeau等[4]研究发现在亚抑制浓度的β-内酰胺和氟喹诺酮类药物存在的情况下,较低的药物暴露并没有完全阻止大肠埃希菌细胞分裂,而是迫使细胞分裂不良,细胞壁变弱。这种改变的状态导致了细胞丝化(细胞延长但没有分裂),这被认为是通过一个简单的概念发挥作用的:与细胞丝化相关扭曲的生理状态可以导致噬菌体生物合成能力的增加(即可用于促进噬菌体组装和成熟的前体增加),这一概念与β-内酰胺类改变细胞壁的事实相结合,可能进一步导致噬菌体裂解能力的增强效应。
3.2 噬菌体-抗菌药物对生物膜的清除作用 生物膜是指微生物为适应周围环境,黏附于有生命或无生命的介质表面,并被其自身分泌的胞外基质包裹而形成的一种紧密、稳定、高度异质的聚合三维网状结构[32]。细菌分泌的大量胞外聚合物使生物膜形成相对坚固严实的结构。研究表明,几乎所有的细菌都可以形成生物膜[33]。噬菌体可产酶(如解聚酶、内溶酶),促进生物膜细胞外基质的分解,这种作用亦可使生物膜中细菌更多地暴露在抗菌药物的作用下,达到更好的杀菌效果[34]。此外,当噬菌体产生的酶消灭了生物膜外部的细菌时,由于增加了氧气和营养物质的暴露,生物膜内部细菌的新陈代谢会变得更加活跃,因此可能对噬菌体和抗菌药物的作用更加敏感[35-36]。
3.3 噬菌体-抗菌药物的“跷跷板效应” 噬菌体对细菌菌株施加选择压力导致噬菌体抗性菌株的产生,噬菌体抗性菌株可能会发生适合度代价改变或重新获得对抗菌药物的敏感性,即“进化权衡”-“跷跷板效应”[37]。“进化权衡”在生物学中常见,即细菌在一个性状上表现出适应能力提高的变化,而同时在另一个性状上表现出性能下降。Ho等[38]研究中也发现了这种“进化权衡”的现象,epaR基因的一个突变导致噬菌体对粪肠球菌的吸附减少;然而,这种基因改变导致了细菌对达托霉素的敏感性增加。有趣的是,这种“跷跷板效应”也在金黄色葡萄球菌对β-内酰胺和糖肽/脂肽药物之间的敏感性中发现[17]。
4 噬菌体-抗菌药物联合使用潜在的缺陷
尽管噬菌体-抗菌药物联合使用在抗菌疗效、降解生物被膜及防止耐受菌产生方面具有很大的潜力[39-40],但其仍存在一些缺陷。首先,两者联合使用时细菌受到两种不同的选择压力,产生抗菌药物及噬菌体双耐受株的问题应当重视;其次,噬菌体优先靶向于抗菌药物敏感菌株,这样可通过“竞争性释放”(在缺乏竞争者而导致竞争减弱时,物种会扩展其实际生态位)促进抗菌药物耐受菌亚群的产生。根据这种假说,先由抗菌药物处理过的细菌拥有敏感的亚群,这些敏感的亚群优先成为噬菌体的靶向目标,从而间接促进抗菌药物耐受菌株的产生;最后,噬菌体和抗菌药物可能通过群体感应或“竞争性释放”独立调节细菌的毒力,给治疗带来更糟糕的结果[41]。虽然目前还没有大量实验证实这些现象是联合使用的重要障碍,但在临床运用时必须根据实际情况,“因地制宜、因时制宜、因人而异”,选择合适的联合使用方案,使治疗效果达到最佳。
5 展望
目前,细菌对抗菌药物产生的广泛耐药性及新型抗菌药物研发滞缓迫使研究人员寻求新的策略来对抗耐药菌株的出现。对噬菌体的研究结果表明,它们可以成为消除对人类和动物构成威胁病原体的另一种方法。目前,关于介导噬菌体与抗菌药物之间协同作用的确切机制仍然不清晰。因此,到目前为止,仍然很难预测特定病原体的最佳噬菌体-抗菌药物作用组合。然而,目前获得的良好实验结果仍鼓励继续进行噬菌体-抗菌药物协同作用的研究,这很可能阻止现在面临的耐药时代,并在未来作为一种强有力对抗多重耐药细菌的手段。虽然噬菌体的临床广泛应用尚需时日,但在科技飞速发展的今天,相信很快就会找到解决问题的钥匙,开启噬菌体临床应用的大门。
(本文由浙江省医学会推荐)
