磁性分子筛负载TiO2复合光催化剂的制备及性能
2021-04-25任轶轩范海洋宋凯雲李晓峰
任轶轩,范海洋,宋凯雲,史 凯,赵 旭,李晓峰
(1. 太原理工大学 化学化工学院,山西 太原 030024;2. 太原市排水管理处,山西 太原 030006)
有机废水的大量排放严重威胁着人类健康。光催化氧化法作为一种新型高效的降解有机污染物的方法在废水处理领域发展迅速[1]。其中纳米TiO2因其催化活性高、化学性质稳定、无毒性和成本低等优点,倍受研究者的青睐[2-4]。然而纳米TiO2对污染物吸附能力差,高表面能易发生团聚导致催化效率变低[5]。针对该问题,研究者尝试以多孔材料为载体对纳米TiO2进行负载化处理[6-10]。分子筛可为TiO2提供光催化场所,减少团聚,而且吸附性能可使有机物富集为TiO2提供高浓度环境,因此是一种理想的光催化载体。
由于纳米TiO2颗粒细小,使用后难分离是制约其应用的另一个难题。有研究者提出加入磁性物质,利用磁分离技术对材料进行回收[11-13]。陈芳等[14]将钛酸四丁酯包裹的Fe3O4纳米粒子负载于石墨烯片层中,制得石墨烯/Fe3O4/TiO2三元复合材料,不仅能借助外加磁场进行回收,同时光降解活性也有明显提高,对罗丹明B和对硝基苯酚的降解率高达98%和96%。目前,TiO2/分子筛/Fe3O4三元复合光催化材料的制备及研究还鲜有报道。
本工作采用超声辅助水热法、溶胶-凝胶法制备了磁性复合光催化剂TiO2-Fe3O4/SSZ-13,将TiO2的光催化性能、分子筛的吸附性能以及Fe3O4的磁性能进行优势互补,使复合材料具有较理想的光催化降解效果,同时解决了催化剂难回收的问题。
1 实验部分
1.1 材料、试剂和仪器
模拟有机废水:质量浓度为50 mg/L的活性艳红X-3B溶液。
N,N,N-三甲基-1-金刚烷基氢氧化铵(R)水溶液:模板剂,R质量分数25%;白炭黑:SiO2质量分数92%;硫酸铝,氢氧化钠,冰乙酸,纳米Fe3O4,钛酸四丁酯,无水乙醇:分析纯;SSZ-13晶种,实验室自制。
F-020S型超声清洗器:深圳福洋科技公司;101型电热鼓风干燥箱:杭州绿博仪器公司;SGQ型真空管式炉:湘潭三星仪器公司;DX-2700型X射线衍射仪:丹东方圆仪器公司;TENSOR27型傅立叶变换红外光谱仪:德国BRUKER公司;JSM-6700F型扫描电子显微镜、JEM-2100型透射电子显微镜:日本JEOL公司;7404型振动样品磁强计:美国Lake Shore公司;SU3900型紫外-可见漫反射光谱仪、F-4600型荧光光谱仪:日本日立公司;721N型可见光分光光度计:上海精科仪器公司。
1.2 制备方法
1.2.1 磁性分子筛Fe3O4/SSZ-13的制备
首先以少量去离子水将2.5 g纳米Fe3O4配制成分散液,然后在100 mL烧杯中按n(H2O)∶n(SiO2)∶n(Al2O3)∶n(Na2O)∶n(R) =11.300∶1.000∶0.005∶0.120∶0.070的比例依次加入剩余去离子水、白炭黑、硫酸铝、氢氧化钠和模板剂,另加入少量晶种,混合后室温下搅拌4 h,得到初始凝胶。向初始凝胶中加入纳米Fe3O4分散液,装入聚四氟乙烯内衬中,超声分散处理1 h,确保混合溶液分散均匀。然后将聚四氟乙烯内衬装入不锈钢反应釜,放入烘箱,水热温度165 ℃下晶化24 h。得到的产物用去离子水洗涤3次以上,100 ℃干燥,用玛瑙研钵研磨成粉末,制得磁性分子筛Fe3O4/SSZ-13。
1.2.2 磁性复合光催化剂TiO2-Fe3O4/SSZ-13的制备
将10 mL钛酸四丁酯与18 mL无水乙醇混合均匀,记为A液;将3 mL去离子水与10 mL无水乙醇混合均匀,强力搅拌20 min,记为B液。向A液中滴加2 mL冰乙酸,并加入3.2 g制好的磁性分子筛Fe3O4/SSZ-13,将B液逐滴缓慢滴入A液中,持续手动搅拌,直至形成黄褐色凝胶。将凝胶室温下陈化6 h,再放入烘箱中80 ℃干燥10 h后研磨,将研磨好的粉末置于坩埚中,氮气保护下在管式炉中缓慢升温至450 ℃,恒温煅烧5 h,即得磁性复合光催化剂TiO2-Fe3O4/SSZ-13。
1.3 表征方法
XRD测试条件:Cu靶Kα线,管电压40 kV,管电流30 mA,扫描范围2θ=5°~80°,8( °)/min,步长0.02。
FTIR测试条件:采用溴化钾压片法,波数范围:4 000~400 cm-1。
VSM测试条件:施加磁场强度-1.0~1.0 T。
UV-Vis测试条件:BaSO4基底,光源为氘灯,检测波长范围200~800 nm。
PL测试条件:激发光波长290 nm,检测波长范围400~700 nm。
1.4 光催化实验
将100 mL 质量浓度为50 mg/L的活性艳红溶液置于200 mL烧杯中,调节溶液pH 至7~8。称取100 mg催化剂加入溶液中,搅拌后放入暗箱30 min至吸附平衡,开始光催化降解实验。以200 W紫外汞灯为光源,光源与液面距离10 cm,环境温度控制在25 ℃,过程中持续搅拌,每隔10 min取5 mL溶液,以3 000 r/min的转速离心5 min,取上清液,在536 nm波长处(活性艳红X-3B最大吸收波长)测定吸光度A。实验中吸光度A与质量浓度ρ之间遵循朗伯-比耳定律,在低浓度范围内有很好的线性关系[15],据此计算溶液中活性艳红的质量浓度,继而可求出活性艳红去除率。
2 结果与讨论
2.1 XRD表征和分析
本实验所用纳米Fe3O4是一种结构为立方尖晶石的磁铁矿,标准PDF卡片:JCPDS19-0629。各试样的XRD谱图见图1。
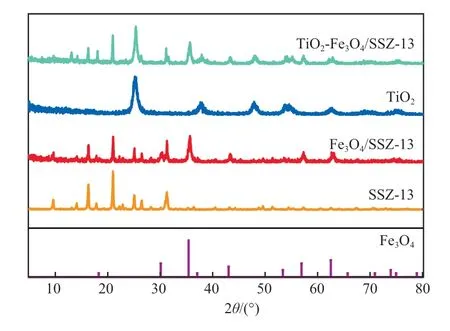
图1 各试样的XRD谱图
由图1可见,Fe3O4/SSZ-13中既出现2θ为16.2°,20.9°,25.1°,31.2°处的SSZ-13分子筛的特征衍射峰,也出现了磁性Fe3O4的衍射峰,说明Fe3O4在SSZ-13分子筛中并没有改变其晶格结构;在450 ℃下煅烧后的TiO2样品在2θ为25.3°,37.8°,48.0°,53.9°处出现对应锐钛矿相TiO2的衍射峰;TiO2-Fe3O4/SSZ-13的衍射峰均归属于Fe3O4、TiO2和SSZ-13分子筛3种物质,没有观察到新晶相的XRD衍射峰,表明复合物是Fe3O4颗粒、TiO2颗粒和SSZ-13分子筛的物理混合物。
2.2 FTIR表征和分析
各试样的FTIR谱图见图2。由图2可见,Fe3O4在580 cm-1附近的吸收峰对应于Fe—O键的特征峰,1 410 cm-1和3 420 cm-1处的吸收峰对应O—H键的伸缩振动峰[16];在545 cm-1、795 cm-1处的吸收峰均为SSZ-13分子筛的特征峰,1 100 cm-1附近的吸收峰为分子筛骨架中T—O—T反对称伸缩振动峰[17],1 410 cm-1和3 420 cm-1处的吸收峰较弱,表明—OH表面暴露面较低;TiO2在500~750 cm-1处的吸收峰对应Ti—O键的变形振动[18];在TiO2-Fe3O4/SSZ-13的谱图中,可看出同时存在Fe3O4、SSZ-13和TiO2的特征吸收峰,说明复合材料的结构没有发生明显变化,与XRD分析结论相吻合。
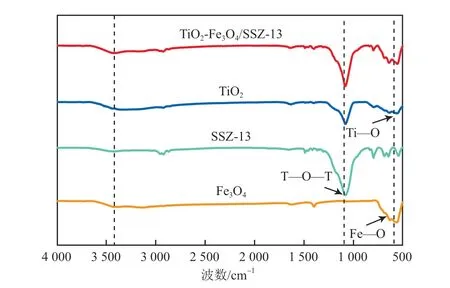
图2 各试样的FTIR谱图
2.3 SEM和TEM表征和分析
TiO2(a)和SSZ-13(b)的SEM照片见图3。

图3 TiO2(a)和SSZ-13(b)的SEM照片
由图3a可见,TiO2粉体出现明显团聚现象,团聚体大小不等,直径为0.2~5.0 μm。由图3b可见,SSZ-13分子筛的形貌比较规整,大多数呈方块状,粒径为400~600 nm。
TiO2-Fe3O4/SSZ-13的TEM照片见图4。由图4a可见,SSZ-13晶粒表面镶嵌有粒径为30~50 nm的黑色椭球状颗粒。由图4b可见,图4a中G区域的晶格间距为0.48 nm,对应于Fe3O4的(111)晶面。由图4c可见,SSZ-13表面附着有3~5层TiO2颗粒。由图4d可见:图4c中H区域可观察到很多不规则形状纳米颗粒,粒径为7 nm左右;经测量,0.32 nm的晶格对应于锐钛矿型TiO2的(101)晶面,与XRD表征结果相吻合。
由图3及图4可见,TiO2和Fe3O4颗粒的附着镶嵌对SSZ-13原本形貌几乎没有影响,就负载效果来看,明显减少了纳米TiO2的大规模团聚,且图中基本没有出现游离的TiO2和Fe3O4。
2.4 VSM表征和分析
Fe3O4和TiO2-Fe3O4/SSZ-13在常温下的磁滞回线见图5。

图4 TiO2-Fe3O4/SSZ-13的TEM照片
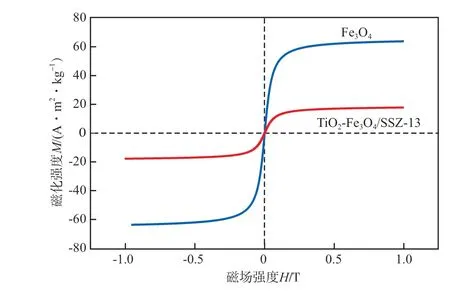
图5 Fe3O4和TiO2-Fe3O4/SSZ-13在常温下的磁滞回线
由图5可见,纯Fe3O4的饱和磁化强度为63.83(A·m2)/kg,TiO2-Fe3O4/SSZ-13的饱和磁化强度为17.80 (A·m2)/kg,说明通过本文方法制得的复合材料仍具有较强的磁性,磁性的减弱可能是复合材料中磁性Fe3O4的含量较低以及非磁性物质(TiO2和SSZ-13)的存在造成的。此外由图5可知,Fe3O4和TiO2-Fe3O4/SSZ-13的磁滞回线过原点对称,剩余磁化强度和矫顽力的值均趋于零,因此呈现超顺磁性。
2.5 UV-Vis表征和分析
各试样的紫外-可见漫反射光谱谱图(a)和禁带宽度谱图(b)见图6。
由图6a可见:TiO2在可见光区域没有吸收;Fe3O4对紫外光和可见光都有较好的吸收性;相较于TiO2,TiO2-Fe3O4/SSZ-13在波长200~800 nm范围内对光的整体响应能力增强,且吸收边缘明显红移,进入了可见光区域,说明复合提高了光吸收能力。利用Tauc公式计算出禁带宽度[19],结果见图6b。由图6b可见,TiO2和TiO2-Fe3O4/SSZ-13的禁带宽度分别为2.78 eV和2.59 eV,这可能是由于微量Fe3+的混入使TiO2的禁带宽度变窄,或者三相接触形成了异质结,在内置电场作用下电荷定向移动,费米能级发生偏移所导致的[20]。
2.6 PL表征和分析

图6 各试样的紫外-可见漫反射吸收光谱谱图(a)和禁带宽度谱图(b)
TiO2和TiO2-Fe3O4/SSZ-13的PL光谱谱图见图7。由图7可见,TiO2-Fe3O4/SSZ-13出现荧光峰的位置与TiO2基本一致,但荧光发射强度明显比TiO2弱,表明TiO2-Fe3O4/SSZ-13中光生电子-空穴对的复合几率较低,延长了载流子的寿命,提高了电荷分离效率,因此复合材料的光催化活性更佳。

图7 TiO2和TiO2-Fe3O4/SSZ-13的PL光谱谱图
2.7 催化性能评价
各试样对活性艳红的降解效果见图8。由图8可见:前30 min在暗环境下,试样达到吸附平衡后只对活性艳红有少量的吸附;开始光照后可看出Fe3O4和Fe3O4/SSZ-13无光催化活性;TiO2和TiO2-Fe3O4/SSZ-13随光照时间延长降解速率逐渐加快,30 min后逐渐减慢。经计算得出:TiO2在光照40 min时对活性艳红的去除率可达70.4%,光照60 min时降解基本结束,活性艳红去除率可达87.9%;TiO2-Fe3O4/SSZ-13在光照40 min时对活性艳红去除率达到89.7%(较TiO2提高了27%),光照60 min时活性艳红去除率达到93.6%(较TiO2提高了5.7%)。复合材料的光催化效率和降解总量都有明显提升,验证了材料性能的提高。
2.8 磁回收性能测试
TiO2-Fe3O4/SSZ-13的磁回收效果见图9。

图8 各试样对活性艳红的降解效果

图9 TiO2-Fe3O4/SSZ-13的磁回收效果
在外加磁场强度为1.0 T的条件下,多次实验的TiO2-Fe3O4/SSZ-13回收率都在90%左右,表明利用外加磁场能较好地对该磁性复合材料进行分离回收。
2.9 光催化剂稳定性实验
TiO2-Fe3O4/SSZ-13降解活性艳红的重复使用效果见图10。由图10可见,随着使用次数增加,TiO2-Fe3O4/SSZ-13在暗吸附环节对活性艳红的吸附量减少;在光降解环节,总体仍能够对活性艳红进行较好的降解,但是降解速率和总去除率有所降低,这是由于活性艳红降解的中间产物吸附在催化剂表面,使催化活性有一定程度下降。
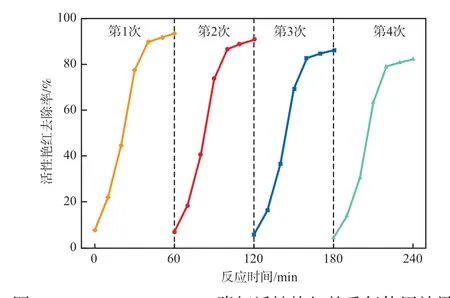
图10 TiO2-Fe3O4/SSZ-13降解活性艳红的重复使用效果
3 结论
a)采用超声辅助水热法制得磁性分子筛Fe3O4/SSZ-13,再采用溶胶-凝胶法成功制备了磁性复合光催化剂TiO2-Fe3O4/SSZ-13。
b)与TiO2相比,TiO2-Fe3O4/SSZ-13的光响应范围增大,禁带宽度变窄,电子-空穴对复合减慢,光催化活性提高。紫外光照下,反应40 min时对溶液中活性艳红去除率可达89.7%,60 min时可达93.6%,降解效率明显提升。
c)磁性纳米Fe3O4的加入不仅不会破坏分子筛的原有结构,且能较好地镶嵌在复合材料基体上,通过协同作用使复合材料拥有优异光催化性能的同时能够实现磁性回收。
