深绿卷柏总双黄酮对H9c2心肌细胞缺氧复氧的保护作用
2021-04-25黎维维孙成新
张 凤,黎 丹,秦 瑶,刘 超,黎维维,朱 蕾,孙成新,王 刚
(1.遵义医科大学,贵州 遵义 563099;2.毕节市第一人民医院,贵州 毕节 551700;3.遵义医科大学第一附属医院 心血管内科,贵州 遵义 563099)
缺血性心脏病是一种常见的致死致残类的疾病,是由于冠状动脉梗阻或狭窄,引起心肌血供不足、心脏氧供与氧需失去平衡,从而造成心肌细胞的缺失并形成了心肌瘢痕,最终导致心力衰竭[1]。然而,该疾病在治疗后常常会发生心肌缺血再灌注损伤的情况,从而导致大量的心肌细胞死亡,心肌损伤程度加重[2]。目前,临床上使用血小板调节药物、β受体阻断剂、钙通道拮抗剂等来治疗该疾病[3-5]。虽然现代医学在治疗心肌缺血方面取得了很大的进展,但尚未存在有效药物,若能够防治心肌缺血再灌注损伤,心肌缺血将得到更好的治疗。
心肌缺血再灌注损伤的病理生理机制较复杂,有研究表明在心肌细胞缺血时会促发炎症,通过再灌注就会导致心肌细胞凋亡,其中炎症因子可激活和趋化白细胞,同时又是白细胞活化后的产物,会加重心肌损伤[6]。由此可见炎症在心肌缺血再灌注损伤的发生、发展中具有重要作用。
深绿卷柏(Selaginelladoederleinii),为卷柏科卷柏属植物深绿卷柏的全草,多年生草本,在我国分布广泛,本草味辛,性平,具有活血通经,化瘀止血等功效[7]。深绿卷柏中含有多种生物活性成分,包括双黄酮、生物碱、木质素、有机酸等化合物[8]。双黄酮类化合物是其主要有效成分,包括银杏双黄酮、穗花杉双黄酮和扁柏双黄酮等[9],该类型的化合物具有抗炎、抗肿瘤等作用。例如Wan[10]等通过研究表明,扁柏双黄酮通过激活线粒体活性氧(mtROS)和c-Jun N-末端激酶(JNK)途径,并抑制NF-κB信号传导来诱导肝细胞癌凋亡。郭丽[11]等研究发现,银杏双黄酮通过降低TNF-α、IL-6 的表达,干预高糖致人微血管内皮细胞的炎症反应。Bais等[12]发现,20 mg/kg剂量的穗花杉双黄酮具有一定的抗关节炎活性,该药物是治疗炎症性疾病的新型植物药。
本课题组前期研究发现穗花杉双黄酮、银杏双黄酮具有很好的体外抗氧化活性[13],本实验通过研究深绿卷柏总双黄酮对缺氧复氧损伤心肌细胞的保护作用,为以后研究心肌缺血再灌注损伤的作用机制奠定基础。
1 材料与方法
1.1 药品与试剂 深绿卷柏(贵州省赤水市四洞沟);H9c2细胞(中国科学院上海生命科学研究所);穗花杉双黄酮标准品(宝鸡市翊瑞生物科技有限公司);高糖培养基(上海微科生物技术有限公司);胎牛血清(FBS,上海微科生物技术有限公司);AV-FITC/PI凋亡试剂盒、乳酸脱氢酶(LDH)试剂盒(Seaven sea biotech公司);肌酸激酶同工酶(CK-MB)试剂盒、肿瘤坏死因子(TNF-α)试剂盒(上海江莱有限公司);白细胞介素(IL-6,IL-10)试剂盒(武汉华美有限公司);0.25 %胰蛋白酶(hyclone公司);MTT(Solarbio公司)。
1.2 仪器 CO2细胞培养箱(上海喆图科学仪器有限公司);倒置显微镜(Nikon公司);低温离心机(湖南凯达科学仪器有限公司);超净工作台(上海灯晟仪器制造有限公司);全波长酶标仪(Microplate公司);缺氧小室(Stemcell公司);流式细胞仪(贝克曼公司);细胞破碎仪(上海新芝科技研究所)。
1.3 方法
1.3.1 深绿卷柏总双黄酮的制备 精确称取深绿卷柏粉末1 kg置于圆底烧瓶中,加入12 L 95 %的乙醇,75 ℃恒温水浴锅回流提取1 h,提取2次,用旋转蒸发仪浓缩合并的2次提取液,放入减压烘箱(60 ℃)烘干[14]。根据大孔吸附树脂纯化黄酮的文献[15],称取D101大孔树脂(1∶30)预处理后备用;提取物按1∶20热水溶解,湿法上柱后静置1 h,用纯净水洗脱,去除水溶性杂质,接着以流速为1 d/s的90%乙醇洗脱,收集洗脱液,浓缩、干燥得深绿卷柏双黄酮提取物7.85 g,通过氯化铝比色法绘制出穗花杉双黄酮标准品校准曲线,计算得到深绿卷柏总双黄酮含量为56%。
1.3.2 H9c2细胞实验
1.3.2.1 细胞培养与传代 从液氮中取出冷冻的细胞,快速将其置于37 ℃的恒温水浴箱中解冻,解冻完后移入紫外灭菌30 min的超净工作台,将细胞悬浮液吸出置于离心管中,加入10 mL培养基吹打均匀,以1 000 r/min的速度离心3 min后,弃去上清液,加入6 mL含10 %胎牛血清的高糖DMEM培养基(10 %FBS),吹打均匀,转移至3个培养瓶中,放入含5% CO2的培养箱中进行培养。
为了验证阳离子电荷数对TSR反应生成H 2 S的影响,在不同的硫酸盐-正辛烷反应体系中加入一定量的AlCl3,测定其H 2 S生成量,如表4所示。
当培养的H9c2心肌细胞生长至85%左右,取出心肌细胞置于紫外灭菌30 mim后超净台,将旧的培养基小心吸除,用PBS洗涤2~3次后,加入0.25 %预热至37 ℃的胰蛋白酶1 mL消化1 min,紧接着加入3 mL的培养基终止消化,吸出全部细胞悬液置于离心管中在1 000 r/min下离心3 min,倒掉上清液后加入6 mL培养基,吹打均匀后分别装于3个新的培养瓶中,轻轻振匀后放入培养箱中继续进行培养。
1.3.2.2 药物浓度和作用时间的筛选 选取对数生长期的H9c2心肌细胞铺于96孔板,分为Control组和深绿卷柏总双黄酮25、50、100、200、400 μg/mL浓度组,分别培养12、24 h。培养结束后吸除上清液,加入90 μL培养液和10 μL 5 mg/mL的MTT溶液,培养4 h。再吸掉上清液,每孔加入DMSO 250 μL,低速振荡10 min。于酶联免疫检测仪490 nm处测量吸光值。
1.3.2.3 缺氧复氧时间的筛选 将对数生长期的H9c2心肌细胞铺于96孔板,分组为Control组,缺氧6、12、24 h组,Control组正常培养,缺氧组每孔加缺氧液100 μL(低糖且不含胎牛血清的DMEM培养基),转移至缺氧小室中连续通3 min混合气体除尽氧气,分别进行6、12、24 h的缺氧培养,通过MTT法检测细胞存活率,获得最佳缺氧时间,将H9c2心肌细胞铺于96孔板并进行分组(Control组、H12R 2h组、H12R 4h组、H12R 6h组、H12R 8h组和H12R 12h组)。Control组正常培养,缺氧组缺氧培养后弃掉缺氧液,每孔加复氧液100 μL(含10 %胎牛血清的高糖DMEM培养基),置于培养箱中(95 %O2)培养2、4、6、8、12 h,通过流式细胞术检测AnnexinV-FITC及PI的荧光变化,确定最佳复氧时间。
1.3.2.4 深绿卷柏总双黄酮对H/R诱导H9c2心肌细胞损伤的保护作用 将对数生长期的H9c2心肌细胞铺于96孔板,待其长满底部85 %左右进行分组(Control组、Model组和深绿卷柏总双黄酮25、50、100 μg/mL浓度组)。(1)Control组的H9c2心肌细胞正常培养。(2)Model组的细胞缺氧培养12 h后复氧培养4 h,建立H/R损伤细胞模型。(3)给药组药物作用预处理12 h后,缺氧培养12 h后复氧培养4 h。
1.3.2.5 MTT法检测细胞活性 选取按照“1.3.2.4”分组实验后的H9c2细胞,按MTT法对细胞活性进行检测。
1.3.2.6 流式细胞仪检测细胞凋亡率 选取按照“1.3.2.4”分组实验后的H9c2细胞,按AnnexinV-FITC检测试剂盒进行操作,检测其AnnexinV-FITC及PI的荧光变化。
1.3.2.7 炎症因子的检测 选取按照“1.3.2.4”分组实验后的H9c2细胞,按大鼠白细胞介素(IL-6)试剂盒、大鼠肿瘤坏死因子(TNF-α)ELISA试剂盒和大鼠白细胞介素(IL-10)试剂盒在450 nm下测定细胞上清液中IL-6、IL-10和TNF-α的含量。
1.3.2.8 心肌酶LDH和CK-MB的检测 选取按照“1.3.2.4”分组实验后的H9c2细胞,按乳酸脱氢酶(LDH)活性检测试剂盒和大鼠肌酸激酶同工酶(CK-MB)试剂盒在450 nm下测定细胞中LDH和CK-MB的含量。

2 结果
2.1 最佳药物作用时间和药物浓度 深绿卷柏总双黄酮作用12 h时,与Control组比较,浓度组25、50、100 μg/mL对细胞有增殖作用,但没有显著差异;200 μg/mL和400 μg/mL组能显著抑制H9c2细胞的增殖(P<0.01),因此最佳药物浓度为100 μg/mL(见图1A)。
深绿卷柏总双黄酮作用24 h时,与Control组比较,浓度组在100 μg/mL范围内细胞存活率显著升高(P<0.05),而药物作用12 h时对细胞的增殖效果不显著,可以排除后续实验中药物作用时间的影响,因此最佳药物作用时间12 h(见图1B)。
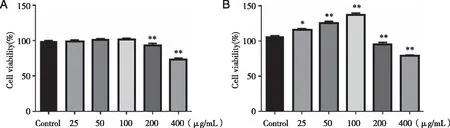
A:深绿卷柏总双黄酮作用12 h;B:深绿卷柏总双黄酮作用24 h;n=3,与Control组相比,*:P<0.05,**:P<0.01。
2.2 最佳缺氧复氧时间 与Control组比较,缺氧12 h组细胞存活率为(51.75±4.67)%,显著降低(P<0.01),因此最佳缺氧时间为12 h(见图2)。Control组的细胞凋亡率为(6.02±3.93)%,与Control组比较,H12R4 h组为(57.43±3.92)%,凋亡率显著升高(P<0.01),且其早调率为48.2%,最接近50%,并在H12R6 h组处出现明显拐点,因此最佳复氧时间为4 h(见图3)。
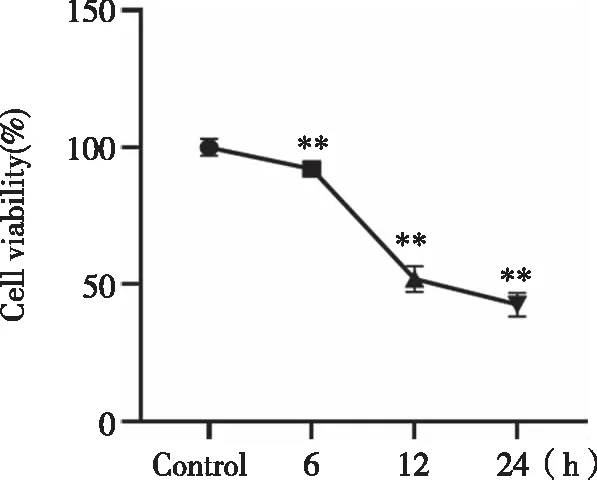
n=3,**:与Control组相比, P<0.01。
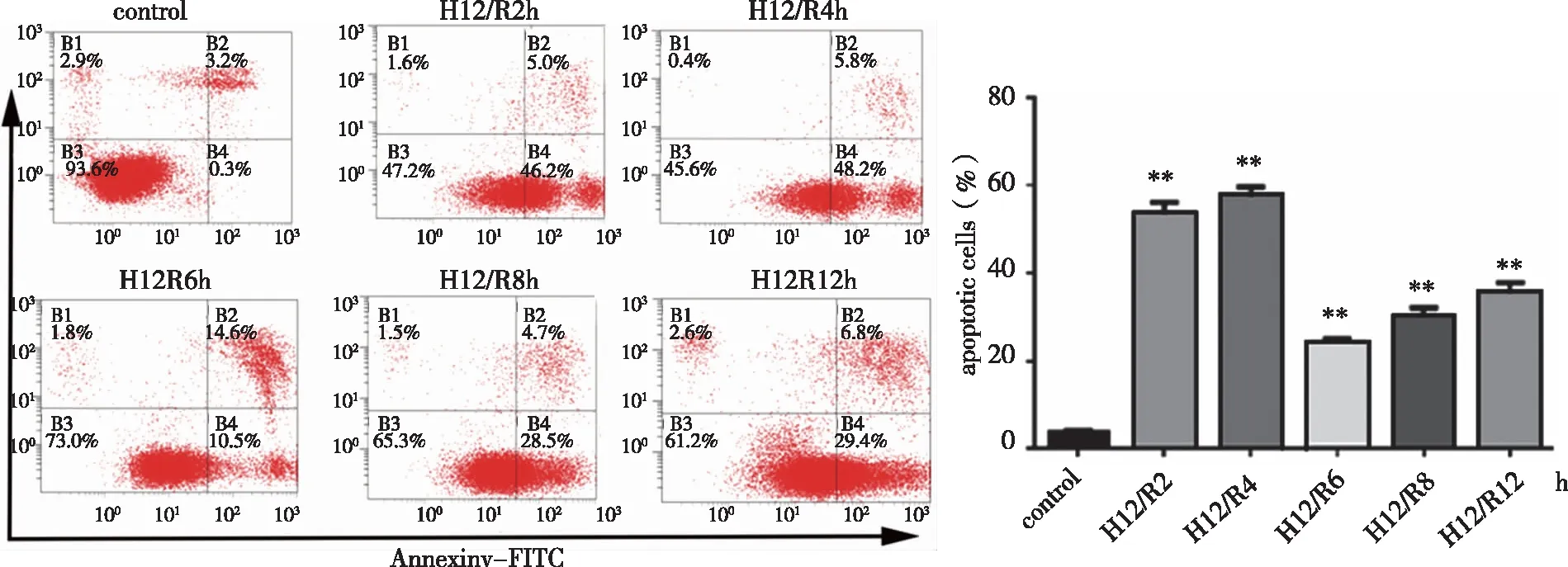
n=3,**:与Control组相比, P<0.01。
2.3 深绿卷柏总双黄酮作用H9c2心肌细胞缺氧复氧后的活性 与Control组比较,Model组H9c2细胞存活率显著下降(P<0.01);与Model组比较,药物浓度25、50、100 μg/mL组细胞存活率均显著升高(P<0.01,见图4)。

n=3,##:与Control组相比,P<0.01; **:与Model组比,P<0.01。
2.4 深绿卷柏总双黄酮作用H9c2心肌细胞缺氧复氧后的凋亡率 与Control组比较,Model组的细胞凋亡率显著升高(P<0.01);与Model组比较,药物浓度100 μg/mL组细胞凋亡率显著下降(P<0.01),25、50 μg/mL组的细胞凋亡率明显下降(P<0.01);药物浓度100 μg/mL组的细胞早期凋亡率仅为8.6 %,接近正常的细胞早调水平,25、50 μg/mL组的细胞早期凋亡率分别为26.0%、14.4%(见图5)。

n=3,##:与Control组相比, P<0.01; **:与Model组比,P<0.01。
2.5 炎症因子检测结果 与Control组比较,Model组细胞中的IL-6和TNF-α含量显著升高(P<0.01),IL-10含量显著降低(P<0.01);与Model组相比较,100 μg/mL浓度组IL-6和TNF-α含量显著降低(P<0.01),IL-10含量显著升高(P<0.01,见图6)。
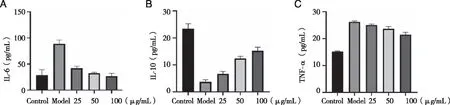
n=3,##:与Control组相比,P<0.01; **:与Model组比,P<0.01。
2.6 心肌酶LDH和CK-MB检测结果 与Control组比较,Model组的LDH、CK-MB含量显著升高(P<0.01),与Model组比较,100 μg/mL浓度组LDH、CK-MB含量显著降低(P<0.01,见图7)。

n=3,##:与Control组相比,P<0.01; **:与Model组比,P<0.01。
3 讨论
缺血性心脏病是全世界范围内的致死疾病之一,近年来有研究表明其致死率仍然排在致死病因的前列,严重威胁着人类的健康。其病因主要是由于冠脉循环狭窄或堵塞,导致心肌缺血,进而使心脏氧供需失衡,最终引起心肌细胞的损伤。恢复心肌供血后,损伤后的心肌细胞和器官得以修复,然而恢复供血后也有可能导致再灌注损伤,加重心肌细胞和器官的损伤程度,因此心肌缺血再灌注疗法现已成为医学研究的重要领域。
依据课题组前期研究,双黄酮类化合物有着显著的体外抗氧化活性,并已优化了该化合物的提取工艺,因此本次实验采用乙醇回流法提取并纯化得到深绿卷柏总双黄酮,为实验后续使用。心肌细胞培养是一种研究心血管的基本手段,作为体外研究模型,能够很方便快捷地从细胞水平对心血管相关疾病进行研究。在筛选最佳药物作用时间时,药物作用12 h对细胞的增殖效果不显著,但当药物作用24 h时,对细胞的增殖作用显著(P<0.05),由于研究主要探讨深绿卷柏总双黄酮对缺氧复氧诱导的H9c2心肌细胞损伤的保护作用,因此要排除药物对细胞的增殖影响,所以选择药物的作用时间为12 h。根据最佳药物作用浓度和时间,建立H9c2心肌细胞缺氧复氧损伤模型。结果显示,与Control组比较,Model组的细胞凋亡率显著升高(P<0.01),与Model组比较,深绿卷柏总双黄酮100 μg/mL浓度组细胞凋亡率显著降低(P<0.01)。
心肌酶是心肌细胞损伤的主要诊断指标,能通过血清中心肌酶的活性判断心肌组织缺血再灌注损伤的程度,相关研究表明检测LDH、CK-MB漏出量的变化可对心肌组织的损伤进行诊断。心肌细胞发生再灌注损伤,其发生机制与白细胞的炎症作用有关,心肌细胞在缺血再灌注时会促发炎症,因此H9c2细胞培养基中的TNF-α、IL-6、IL-10含量的可以反映细胞的炎症应激水平,可作为评价心肌缺血再灌注损伤程度的指标。结果显示,与Control组比较,Model组细胞中的IL-6、TNF-α、LDH和CK-MB含量显著升高(P<0.01),IL-10含量显著降低(P<0.01);与Model组相比较,100 μg/mL浓度组IL-6、TNF-α、LDH和CK-MB含量显著降低(P<0.01),IL-10含量显著升高(P<0.01)。
综上所述,本实验从细胞水平对深绿卷柏总双黄酮在缺氧复氧诱导的H9c2细胞损伤的作用进行了一定的研究,证明了深绿卷柏总双黄酮对其损伤具有良好的改善作用。但本实验仍然存在一定的不足,需要更深一步对其作用机理和在其他水平(动物水平等)进行探讨。
