子宫内膜透明细胞癌分子分型临床应用及其与PD-L1表达的关系
2021-04-25汤永峰周鹤鸣郑燕影
汤永峰,张 珦,周鹤鸣,郑燕影,李 惠
子宫内膜癌是女性高发的恶性肿瘤,发病率逐年增高[1-2]。子宫内膜癌根据有无激素依赖分为两型:Ⅰ型包括子宫内膜样癌和黏液癌,约占子宫内膜癌的85%;Ⅱ型包括高级别浆液性癌(占3%~10%)和透明细胞癌(<2%)等。组织学分型并不能很好地反应子宫内膜癌的生物学行为和预后,需要新的分型分层标准。2013年美国癌症基因组图谱(TCGA)项目将子宫内膜癌分为四种分子亚型:POLE超突变型、微卫星不稳定高突变型(microsatellite instability hypermutated, MSI-H)、高拷贝数型(copy number-high, CN-H)和低拷贝数型(copy number-low, CN-L)。目前关于子宫内膜癌分子分型在临床应用的研究越来越多[3-6],由于子宫内膜透明细胞癌(endometrial clear cell carcinoma, ECCC)病例数较少[7],其分子分型在临床上的应用国内尚未见报道。肿瘤免疫治疗是近年研究热点,以抗PD-1/PD-L1为代表的免疫治疗在MSI-H/错配修复缺陷(mismatch repair-deficiency, MMR-D)及高浓度肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)的肿瘤中显示较好的疗效。研究显示:高达29%的ECCC患者为MSI,使免疫治疗成为ECCC潜在的治疗选择[8]。本文旨在探讨ECCC分子分型的临床应用及其与PD-L1表达的关系,为ECCC的免疫治疗提供参考。
1 材料与方法
1.1 材料收集2012年1月~2019年12月南京市妇幼保健院病理科存档的15例ECCC手术标本,所有病例均经2位高年资专科病理医师确诊。患者年龄37~78岁,中位年龄60岁。其中5例有子宫颈浸润,4例淋巴结有转移。
1.2 方法
1.2.1免疫组化 所有标本均经10%中性福尔马林固定,常规包埋、3 μm厚切片,采用免疫组化EnVision两步法检测p53、MLH1、MSH2、MSH6、PMS2和PD-L1(22C3)蛋白表达,PD-L1(22C3)抗体购自丹麦DAKO公司,其余抗体均购自福州迈新公司。用PBS作为阴性对照。MLH1、MSH2、MSH6和PMS2阳性染色定位于细胞核,在阳性内对照(如肿瘤间质淋巴细胞)表达正常的情况下所有肿瘤细胞染色阴性判读为MMR-D,否则为错配修复完整(mismatch repair-proficiency, MMR-P)。p53判读标准:大于70%的肿瘤细胞中有强的细胞核染色或肿瘤细胞染色完全阴性为p53突变型,否则为野生型。PD-L1染色结果采用CPS评分:即PD-L1染色细胞(包括肿瘤细胞、淋巴细胞、巨噬细胞)数与样本中所有活肿瘤细胞数的比值,乘以100。阳性定义为CPS评分≥10。
1.2.2POLE基因突变检测 常规提取、纯化DNA后,将提取的DNA送至北京擎科生物公司进行Sanger测序:设计合成引物,PCR扩增后用ABI-3730xl测序仪进行测序,Data collection软件自动进行数据处理和分析。DNA sequencing analysis 5.1软件分析获取测序电泳图和序列。将样本序列与Genebank标准序列进行比对,观察序列有无突变。
1.3 统计学分析所有数据采用SPSS 22.0软件进行统计学分析;应用Fisher确切概率法进行显著性检验;P<0.05为差异有统计学意义。
2 结果
2.1 ECCC中POLE突变情况按照分子筛查流程(图1),首先进行POLE基因测序。本组15例ECCC标本均行POLE基因突变热点第9外显子P286R和第13外显子V411L点突变测序分析,均未发现病理性突变。

图1 ECCC分子分型筛查流程
2.2 ECCC中MMR、p53蛋白表达及与临床病理特征的关系15例ECCC中有5例(33.3%)MMR蛋白表达缺失,其中3例MLH1和PMS2表达共同缺失,缺失率为20.0%(3/15)(图2~7);1例MSH2和MSH6表达共同缺失,缺失率为6.7%(1/15);1例发生4种蛋白共同缺失。15例ECCC中p53突变8例(图8),p53野生7例。8例p53突变中有3例MMR-D,7例p53野生中有2例MMR-D(表1)。MLH1、PMS2、MSH2、MSH6、p53蛋白表达与患者肿瘤大小、年龄、浸润深度、子宫颈浸润及淋巴结转移无关(P>0.05,表2)。
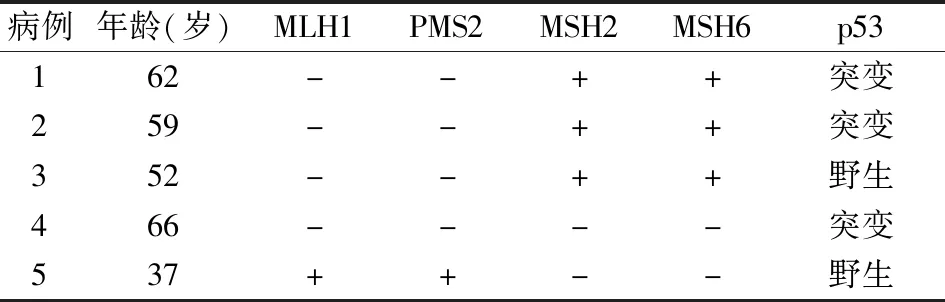
表1 MMR蛋白表达缺失和p53蛋白突变状态

表2 ECCC中MMR蛋白表达缺失、p53突变与临床病理特征的关系
2.3 不同分子分型ECCC中PD-L1的表达15例ECCC中,10例PD-L1 CPS评分≥10(图9),阳性率为66.7%(10/15)。与PD-L1阳性组相比,阴性组具有更深的肌层浸润(P=0.046)、更高的淋巴结转移率(P=0.004),与患者年龄、肿瘤大小、有无子宫颈浸润无关(P>0.05)。5例PD-L1阴性者均为MMR-P,10例MMR-P中PD-L1阳性率为50.0%(5/10),而5例MMR-D中PD-L1阳性率为100.0%(5/5)。结果显示MMR-D者PD-L1阳性比例更高,但由于病例数太少,PD-L1表达在MMR-D、MMR-P之间差异无统计学意义(P=0.084)。PD-L1表达在p53突变和野生之间差异无统计学意义(P=0.427,表3)。

表3 MMR-D、p53突变与PD-L1表达的关系
3 讨论
ECCC发病率低,临床罕见,侵袭力强,目前尚无针对性的治疗指南,预后生存数据差异较大,多数报道5年生存率不足50%。镜下肿瘤细胞可呈立方、扁平或鞋钉样,胞质透明或嗜酸性,乳头状、管囊状或实性生长方式是透明细胞癌的组织学特点。免疫组化标记ER、PR通常阴性或弱阳性,HNF-1β和Napsin A常阳性;以往将其归类为Ⅱ型子宫内膜癌。近年研究发现,ECCC也有与Ⅰ型子宫内膜癌相似的免疫表型及基因特征,如PTEN基因突变、MMR基因表达缺陷、ARID1A表达缺失、PIK3CA变异等[9]。DeLair等[10]对32例ECCC进行免疫组化检测及300个癌症相关的基因测序,结果显示11例p53异常表达、7例ARID1A表达缺失和6例MMR蛋白表达缺失。因此,寻找新的分型分层标准,更好的反应ECCC的生物学行为和预后,以及寻找新的治疗方法,成为近年的研究热点。

②③④⑤⑥⑦⑧⑨
通过TCGA对373例子宫内膜癌(307例子宫内膜样癌和66例浆液性癌)的全基因组及转录组测序,结合MSI检测结果和拷贝数分析,将子宫内膜癌分为POLE超突变、MSI-H、CN-H和CN-L四种亚型。POLE超突变是参与核DNA复制和修复的DNA聚合酶epsilon催化亚基的热点突变,发生在约10%的子宫内膜样癌中;MSI-H型与子宫内膜癌MMR基因改变有关;CN-H型主要包括浆液性癌,其特征是拷贝数变异大、TP53基因频繁突变及ER、PR表达低,该亚型具有与乳腺基底样癌和卵巢浆液性癌相同的特征;CN-L型突变率低,其中包括大多数子宫内膜样癌,并经常与PTEN、CTNNB1、PIK3CA、ARID1A和KRAS突变相关。TCGA分子分型已应用于子宫内膜样癌、浆液性癌和混合性癌。研究显示:不同分子分型的子宫内膜癌患者生存差异显著[3],POLE超突变型预后最好,与POLE超突变型和MSI-H型相比,CN-H型和CN-L型的患者显示出更高的转移率和更低的5年无复发生存率。因此,有POLE突变的患者可能不需要术后辅助化疗,而CN-H型患者几乎均需要辅助化疗。
子宫内膜癌TCGA分子分型程序复杂、费用贵,目前在日常工作中未得到广泛应用。TCGA数据表明,TP53基因突变分析是区分CN-H型和CN-L型肿瘤的灵敏且特异的方法。研究者将p53免疫组化与TP53基因突变分析和荧光原位杂交进行拷贝数分析比较,发现在鉴定拷贝数方面是等效的。因此,有两项研究[3,11]对TCGA分子分型方法进行改进,使用了更简化、更适合临床的替代方法,并验证了此方法在临床应用上的可行性。其中,Parra-Herran等[11]提出的替代方案是先用POLE基因测序筛选出POLE超突变型,再用MMR蛋白免疫组化筛选出MMR-D,最后用p53免疫组化区分p53突变型和p53野生型。Talhouk等[3]则提出ProMisE方案:先用MMR蛋白免疫组化筛选出MMR-D,MMR蛋白表达正常者再进行POLE基因测序,最后POLE野生型用p53免疫组化区分p53突变型和p53野生型。由于ProMisE方案容易将同时伴有MMR-D或p53突变型的POLE超突变型错误归类为MMR-D或p53突变型,故本实验采用先检测POLE基因突变的方案。
TCGA中关于子宫内膜癌的数据显示POLE超突变型占7%、MSI-H型占28%、CN-H型占26%、CN-L型占39%,但其中不包括ECCC。那么ECCC是否适用于TCGA分子分型呢?目前国外关于ECCC的TCGA分子分型研究主要有6项。2015年Hoang等[12]对14例纯ECCC行基因组和免疫组化分析,结果显示0例POLE突变、0例MSI-H、4例CN-H。Stelloo等[13]对18例ECCC行p53免疫组化、MSI和POLE突变检测,结果显示1例POLE突变、2例MSI-H和8例CN-H。2017年Le Gallo等[14]对16例ECCC进行肿瘤组织及对应正常组织的全外显子组测序,对另外47例ECCC进行了22个基因测序及MSI检测,结果显示0例POLE突变、6例MSI-H和23例CN-H。DeLair等[10]对32例ECCC行免疫组化及300个癌症相关的基因测序,结果显示2例POLE突变、4例MSI-H、11例CN-H。2019年Baniak等[15]对37例ECCC通过组织芯片评估MMR蛋白、p53表达,通过二代测序评估POLE、TP53基因突变状态,结果显示22例CN-H,没有发现POLE热点突变和MMR-D病例。Travaglino等[16]将上述5项研究进行综合分析,162例ECCC中CN-H型(42.5%)和CN-L型(40.9%)较多见,而MSI-H型(9.8%)和POLE超突变型(3.8%)较少见。由于ECCC病例数较少,本组15例标本POLE超突变型0、MMR-D/MSI-H型33.3%、p53野生型/CN-L型33.3%、p53突变型/CN-H型33.3%。在53.3%(8/15)的病例中p53蛋白异常表达,提示其突变谱似乎更像浆液性癌。但是有3例同时表现为MMR-D,所以p53突变型为33.3%(5/15);本实验未检出POLE突变,可能是由于本实验仅进行了P286R和V411L最常见的2个热点突变检测,而未进行全外显子测序。
晚期ECCC治疗难度大、病死率高,需寻找有效的标志物和治疗方法,抗PD-1/PD-L1免疫治疗成为新的希望。ECCC中PD-L1阳性率26.5%~76%[17-18]。关于PD-L1与子宫内膜癌预后关系的报道尚不统一。Jin等[19]应用免疫组化法检测23例ECCC中PD-1和PD-L1(SP142)的表达,结果显示PD-1/PD-L1阳性组具有更高的FIGO分级、更深的肌层浸润,提示患者预后不佳,差异无统计学意义。Yamashita等[20]对149例子宫内膜癌行PD-1/PD-L1检测,结果显示PD-L1阳性患者的无进展生存期显著延长。本组结果显示PD-L1(22C3)阴性组具有更深的肌层浸润、更高的淋巴结转移率,与Jin等报道的不一致,是否和人群异质性或使用不同的抗体有关需要进一步分析。目前认为MSI-H/MMR-D病例PD-1和PD-L1的表达更高,提示免疫检查点抑制剂在MSI-H/MMR-D病例中可能更有效。本实验结果显示,在ECCC中MMR-D组与MMR-P相比,PD-L1的表达呈更高趋势,但差异无统计学意义,需要收集更多标本进一步研究。
本实验初步展示了ECCC的分子异质性,显示ECCC部分与子宫内膜样癌相似,部分与浆液性癌相似,总体突变谱似乎比子宫内膜样癌更像浆液性癌。由于病例数较少,需扩大样本对ECCC的分子机制进行单独的研究,以明确ECCC是否可以根据TCGA分子标记细分为不同的子类别,以及这些类别是否具有不同的形态特征和治疗选择。
