PAK5/β-catenin信号通路在乳腺癌细胞多药耐药中的作用及机制
2021-04-25巩婵婵李艳青陆夏良
巩婵婵,李艳青,展 瑞,汤 颖,陆夏良
乳腺癌是女性最常见的恶性肿瘤,发病率以每年0.2%~8%的幅度上升,严重威胁女性身心健康[1-2]。肿瘤细胞多药耐药的产生是导致乳腺癌治疗失败的主要原因之一,因此,研究乳腺癌细胞耐药的分子机制,对发现新的治疗靶点具有重要意义[3]。PAK5是p21激活激酶(p21-activated kinase, PAK)家族中的成员之一[4]。研究表明,PAK5可通过调控NF-κB促进乳腺癌细胞增殖,并参与乳腺癌细胞侵袭、迁移过程[5]。此外,PAK5还参与了肝癌细胞及食管鳞状细胞癌对顺铂的耐药[6-7],PAK5表达可使卵巢癌细胞对紫杉醇产生耐药[8]。因此,PAK5很可能参与了肿瘤细胞的耐药进程,而PAK5在乳腺癌细胞耐药中的机制仍不清楚。本实验旨在验证PAK5在乳腺癌细胞产生耐药中的作用,并探讨PAK5对β-catenin通路的调控作用。
1 材料与方法
1.1 材料人乳腺癌细胞BT-549、MDA-MB-231购自中国科学院细胞所。RPMI-1640培养基购自美国GIBCO公司,L-15培养基、CCK-8细胞增殖试剂盒购自凯基生物公司;无支原体胎牛血清购自中国杭州四季青公司;胰酶购自美国Sigma公司;抗PAK5抗体购自美国Abcam公司,β-catenin抗体购自Santa Cruz公司,PAK5过表达质粒购自上海艾博思生物公司。PAK5干扰序列购自上海吉玛基因公司。BCA蛋白浓度测定试剂盒购自南京碧云天公司;X-treme GENE HP DNA Transfection Reagent转染试剂购自Roche公司。
1.2 细胞培养与耐药株诱导乳腺癌细胞株BT-549、MDA-MB-231分别于含10%胎牛血清的RPMI-1640、L-15培养基中,加入适量青霉素-链霉素溶液(双抗),在含5%CO2、37 ℃恒温培养箱中培养。取对数生长状态良好的BT-549和MDA-MB-231细胞常规胰酶消化后,离心弃上清,后重悬取约106个细胞接种于含阿霉素(ADR,初浓度0.02 μg/mL)、紫杉醇(PTX,初浓度为0.2 μg/mL)的培养基中,待细胞存活状态稳定后,不断提高药物浓度,直到其IC50值至少达到亲本细胞IC50值的10倍以上,并能在RPMI-1640(L15)培养液中稳定地生长,持续传代。后定期给予一定浓度的阿霉素或紫杉醇,间断刺激。
1.3 CCK-8细胞增殖实验胰酶消化对照组与实验组(耐药细胞株为实验组时,其对应的亲本细胞株为对照组;PAK5过表达组为实验组时,其对照组为转染空载质粒组;干扰PAK5组为实验组,其对照组为干扰无关序列组)。向96孔板每孔铺5×103个细胞。一竖排铺5个孔,每孔为含10%FBS完全培养基稀释的细胞100 μL;将铺好细胞的96孔板,分别加药后,置于细胞培养箱中分别培养24、48、72、96 h;将添加CCK-8检测液的96孔板再放入培养箱中继续孵育0.5、1、2、4 h;在相应的4个时间点拿出96孔板置酶标仪450 nm处测定相应孔的OD值。
1.4 克隆形成实验将对照组和实验组进行细胞消化计数,在6孔板中加入含10%FBS完全培养基3 mL,同时每行3个孔为一组,细胞数分别为100、300、500,实验孔细胞数与其相对应,分别加药后,将6孔板放入培养箱中培养。定期进行细胞换液,观察10~14天,当培养皿中出现肉眼可见的克隆时,即终止培养。弃去培养基,用PBS缓冲液浸洗后吸出;加入4%多聚甲醛固定15 min,后弃固定液,加适量结晶紫(或Giemsa)染色10~30 min,空气干燥;将各孔置于白色背景下拍照,最后进行统计学分析并作出统计图。
1.5 Western blot法收集对照组和实验组细胞,用RIPA裂解液充分裂解。按试剂盒方法提取总蛋白,将各组样品配平,以配制成同体积同浓度同质量的样品。按SDS聚丙烯酰胺凝胶制备分离样品,NC膜进行转膜(湿转),5%脱脂牛奶封闭,孵育一抗(PAK5,稀释比1 ∶1 000;Actin,稀释比1 ∶5 000)4 ℃过夜;将NC膜取出,室温复温30 min,Washing buffer洗膜;孵育二抗,室温条件下2 h,Washing buffer漂洗NC膜,滴加ECL发光液,显色。
1.6 细胞免疫荧光定位对照组与实验组细胞生长至80%~90%融合度后,接种于铺有盖玻片的6孔板内,待亲本细胞融合度达70%时开始转染;耐药株细胞不作转染处理,培养24 h后,吸出原有培养基,加入提前预冷的4%多聚甲醛,室温条件下固定15~20 min;后加入0.5%TritonX-100,室温下孵育10 min;5%BSA封闭1 h(勿洗);孵育一抗(β-catenin,稀释比1 ∶100,用5%BSA作稀释液),4 ℃过夜;次日取出6孔板,于室温条件下复温30 min;孵育二抗(稀释比1 ∶200,用5%BSA作稀释液),注意避光操作;后进行核染色;完成后取出盖玻片,略晾干,封片。荧光显微镜下观察拍照。
1.7 罗丹明实验对照组与实验组细胞生长至约70%融合度时,用含2%罗丹明的完全培养基培养,置于37 ℃温箱中30~50 min,后弃去培养液,PBS漂洗,荧光显微镜下观察拍照。
1.8 免疫共沉淀提取对照组和实验组细胞总蛋白,BCA测蛋白浓度;分为三个样品组:Input(80 μg)、对照组(1 mg)、实验组(1 mg);实验组加抗PAK5蛋白抗体(5 μg),对照组加兔源IgG,4 ℃过夜;Input组存放于-20 ℃冰箱。实验组及对照组加proteinA/G珠子(约30 μL),4 ℃条件下旋转混合2~4 h;将对照组与实验组4 ℃离心,去上清,后用Western及IP细胞裂解液洗3遍(每次1 mL),2 000 r/min离心1 min;加30 μL的2×Loading buffer,煮沸15 min;4 ℃,12 000g离心15 min,取上清;将所取样品及Input组进行Western blot实验。
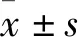
2 结果
2.1 构建乳腺癌耐药细胞模型选择两种常见的人乳腺癌细胞株BT-549和MDA-MB-231,阿霉素或紫杉醇小剂量浓度递增法建株,成功构建BT-549耐阿霉素细胞株(BT-549/ADR)、BT-549耐紫杉醇细胞株(BT-549/PTX)、MDA-MB-231耐阿霉素细胞株(MDA-MB-231/ADR)和MDA-MB-231耐紫杉醇细胞株(MDA-MB-231/PTX)。为进一步验证构建的乳腺癌耐药株细胞的耐药能力,将4种耐药株细胞分别加药培养后进行CCK-8细胞增殖实验,结果显示,与亲本细胞相比,耐药细胞株在24、48、72、96 h时细胞增殖均明显升高(P<0.001,图1)。同时,将4种耐药株细胞加药培养后进行克隆形成实验,结果显示,与亲本细胞株相比,耐药细胞株能形成大量的细胞集落,差异有统计学意义(P<0.001,图2)。上述实验表明,与亲本细胞相比,耐药细胞的增殖能力明显增强。

图2 克隆形成实验检测乳腺癌耐药细胞株的克隆形成能力:A.BT-549/ADR;B.BT-549/PTX;C.MDA-MB-231/ADR;D.MDA-MB-231/PTX
2.2 PAK5对乳腺癌细胞耐药株的影响Western blot法检测耐药细胞株中PAK5表达情况,结果显示,与亲本细胞相比,耐药细胞株中PAK5蛋白表达增加(P<0.001,图3)。乳腺癌细胞株中PAK5过表达,CCK-8实验结果显示,与对照组相比,PAK5过表达组的细胞增殖能力明显增强(P<0.001,图4)。乳腺癌细胞株中分别过表达PAK5和干扰PAK5,依次加药后,采用CCK-8细胞增殖实验检测其IC50值,与对照组相比,PAK5过表达组的IC50值明显增加,而PAK5干扰组的IC50值则明显降低(表1)。在乳腺癌细胞株中过表达PAK5后行罗丹明染色,结果显示,与对照组相比,PAK5过表达组的荧光强度更弱;对乳腺癌亲本细胞及其耐药株进行罗丹明染色,结果显示,与亲本细胞相比,耐药株细胞中的荧光强度更弱(图5)。上述实验结果提示,PAK5可以促进乳腺癌细胞产生多药耐药,且可能是通过影响其耐药蛋白的表达。

表1 乳腺癌细胞株BT-549和MDA-MB-231不同处理条件下的IC50值
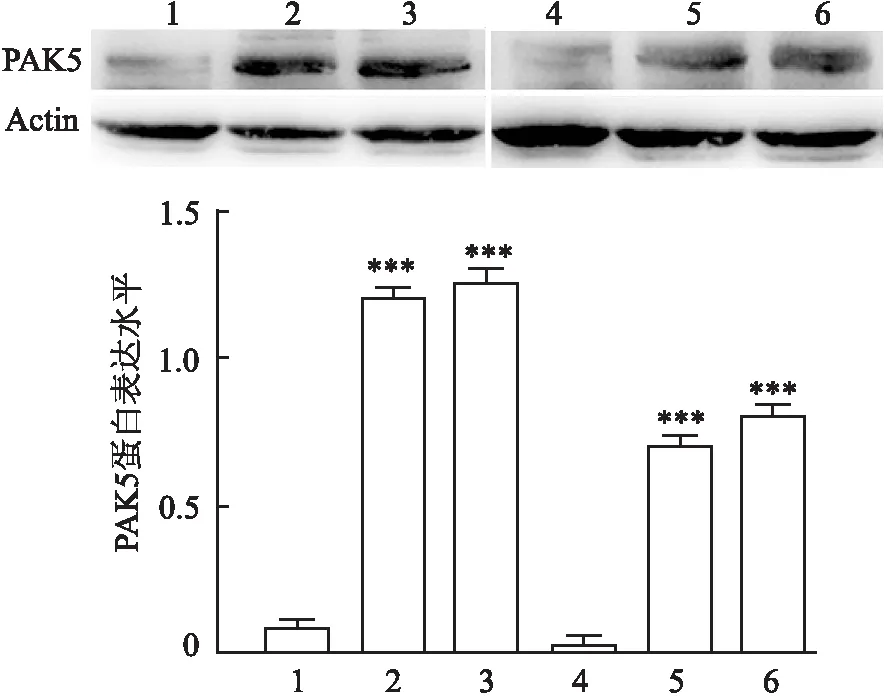
图3 Western blot法检测乳腺癌耐药细胞株中PAK5的表达:1. BT-549;2.BT-549/ADR;3.BT-549/PTX;4.MDA-MB-231;5.MDA-MB-231/ADR;6.MDA-MB-231/PTX; 与乳腺癌亲本细胞株相比,***P<0.001
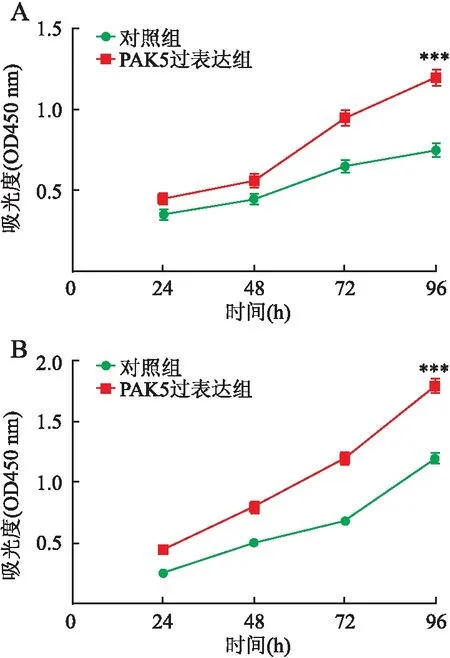
图4 PAK5可促进乳腺癌细胞的增殖:A.BT-549;B.MDA-MB-231;与对照组相比,***P<0.001
2.3 PAK5对β-catenin信号通路的影响乳腺癌细胞中过表达PAK5后行细胞免疫荧光实验观察β-catenin表达,结果显示,与对照组相比,PAK5过表达组中β-catenin表达明显增加,且以细胞核内增加为主(图6)。同时,亲本细胞株与耐药细胞株的免疫荧光结果显示,与亲本细胞株相比,耐药细胞株中β-catenin表达显著增加(图6)。为进一步探究PAK5与β-catenin的关系,本实验行免疫共沉淀实验,结果显示PAK5可以与β-catenin相结合;与亲本细胞株相比,在耐药细胞株中的结合增加(图7)。上述实验结果显示,PAK5可以与β-catenin结合,且促进其表达。
3 讨论
化疗在乳腺癌综合治疗中起着不可替代的作用,但往往会由于肿瘤细胞产生多药耐药,导致化疗无效或逐渐转为无效,严重影响患者的生存质量和生存率[9-10]。因此,寻找肿瘤细胞产生耐药的分子机制,可能为乳腺癌临床的治疗提供新的潜在作用靶点。PAK5是PAK家族中的成员之一,在多种肿瘤的发生、发展中起重要作用,而PAK5在乳腺癌细胞耐药中的作用仍有待于进一步研究。
本实验通过阿霉素及紫杉醇小剂量浓度递增法构建4种乳腺癌耐药株细胞,与亲本细胞株相比,耐药细胞株的细胞增殖能力增加,这些结果证实,构建的耐药细胞株具有稳定的耐药能力。此外,Western blot实验表明,PAK5在耐药细胞株中表达增加;CCK-8实验显示,PAK5过表达可促进乳腺癌细胞增殖。罗丹明123(Rhodamine 123)是一种可透过细胞膜的阳离子荧光染料,可以作为一种荧光指示剂,在耐药细胞株中被作为细胞内底物泵出细胞外,而使细胞内的荧光减弱。该实验结果表明,与亲本细胞相比,耐药细胞株中的耐药蛋白表达增多;且PAK5可影响乳腺癌细胞中耐药蛋白的表达。Wnt/β-catenin信号转导通路在多种癌症的发生、发展中起重要作用,Wnt信号通路激活后可抑制β-catenin的降解及磷酸化,导致其在细胞质或细胞核内的含量蓄积,启动与癌症相关的基因转录。细胞免疫荧光结果显示,在乳腺癌细胞中过表达PAK5,β-catenin的表达也增加,且以细胞核的增加为主;同时,与亲本细胞株相比,耐药细胞株中β-catenin表达也是增加的。免疫共沉淀结果证实,PAK5与β-catenin结合,且在耐药细胞株中的结合增加。以上结果表明,PAK5可促进乳腺癌细胞产生耐药,且可能是通过结合并促进β-catenin的转录活性实现的。
β-catenin是Wnt信号通路的核心调控因子,与肿瘤的发生、发展密切相关[11-12]。本实验揭示了PAK5通过β-catenin参与乳腺癌细胞耐药的产生,为临床乳腺癌患者耐药的治疗提供了新的理论依据。

图5 罗丹明实验检测PAK5对乳腺癌细胞中耐药蛋白表达的影响:A、B.细胞株BT-549和MDA-MB-231中分别过表达PAK5;C、D.罗丹明实验观察乳腺癌细胞系BT-549、MDA-MB-231及其耐药株中荧光的强弱

图6 细胞免疫荧光染色观察β-catenin的表达变化:A、B.细胞株BT-549和MDA-MB-231中β-catenin的表达;C、D.乳腺癌细胞系BT-549和MDA-MB-231及其耐药株中β-catenin的表达

图7 免疫共沉淀实验检测PAK5与β-catenin的关系:A.在乳腺癌细胞株BT-549中,PAK5可与β-catenin结合;B.在耐药株中PAK5与β-catenin结合增加
