曲古霉素A 对人膀胱癌细胞EJ 增殖的影响及其作用机制△
2021-04-25冷俊周晔施利琴张莉
冷俊,周晔,施利琴,张莉
上海交通大学医学院附属新华医院崇明分院检验科,上海 202150
膀胱癌是常见的泌尿系统恶性肿瘤。2013 年,中国的膀胱癌新发病例数已达7.44万,且其生物学行为呈多样性。大部分膀胱癌患者于初诊时处于浅表性膀胱癌阶段,但术后容易复发、转移,病死率较高。目前,以多柔比星、丝裂霉素等药物为主的常用术后化疗方案效果一直不甚满意,因此,临床需要寻找一种新型药物治疗途径防止膀胱癌术后复发。近年来,组蛋白去乙酰化酶抑制剂为肿瘤治疗提供了新的思路,而曲古霉素A(trichostatin A,TSA)作为其中的一种代表药物,可抑制肿瘤细胞的增殖、侵袭及迁移。WNT抑制因子 1(WNT inhibitory factor-1,WIF-1)作为 WNT信号通路的重要拮抗物,与肿瘤的发生、发展密切相关。本研究以体外培养的人膀胱癌细胞EJ为模型,观察了不同浓度的TSA对膀胱癌细胞EJ增殖及WIF-1基因表达的影响,现报道如下。
1 材料与方法
1.1 细胞株与主要试剂
人膀胱癌细胞株EJ购于美国菌种保藏中心,TSA、碘化丙啶、胰蛋白酶均购于Sigma公司,RNA抽提试剂TRizol购于Invitrogen公司,EZ ChIPChromatin Immunoprecipitation Kit购于Upstate公司,Anti-acetyl-Histone H3(Lys9)购于Abcam公司,逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒购于宝生物工程(大连)有限公司,RPMI 1640培养液、胎牛血清均购于Gbico公司,Taq Plantinum PCR Master-Mix购于TIANGEN公司,青、链霉素均购于碧云天公司。
1.2 实验方法
1.2.1 细胞培养 将膀胱癌细胞株EJ置于含10%胎牛血清、100 U/ml青霉素、0.1 mg/ml链霉素的RPMI 1640培养基中,在37 ℃、5% CO、100%饱和湿度的孵箱内进行培养。视细胞生长情况换液、传代。
1.2.2 四甲基偶氮唑蓝(methyl thiazolyl terazolium,MTT)比色法 取对数生长期的人膀胱癌细胞EJ接种于96孔培养板中,每孔约含1×10个细胞,置入培养箱,待细胞贴壁后进行实验:培养液中含终浓度为 0.1、0.2、0.4、0.8 和 1.6 μmol/L TSA 和仅加RPMI 1640培养液的空白对照。每组设3个复孔。继续培养,于24、48、72 h分别取生长良好的细胞测定细胞增殖抑制率,分析TSA对细胞增殖活性的影响。空白孔调零,采用酶标仪于490 nm波长处分别检测24、48、72 h后细胞的吸光度(absorbance,A)值。细胞增殖抑制率=1-细胞存活率;细胞存活率=实验细胞的平均OD值/空白对照细胞的平均OD值。实验重复3次。
1.2.3 流式细胞仪检测细胞周期分布情况 以1×10/ml的密度将处于对数生长期的人膀胱癌细胞EJ接种于6孔培养板内,加药处理,TSA的终浓度分别为0.2、0.4、0.8 μmol/L,空白组不加任何药物;置入孵箱中继续培养,72 h后胰蛋白酶消化回收细胞,在4℃下以1000 r/min的速度离心5 min,离心半径10 cm。磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3次,70%冰乙醇固定,加入RNaseA(终浓度为0.1 g/L)处理30 min,加入0.05 g/L碘化丙啶250 ml,室温避光染色30 min后上机检测。实验重复3次。
1.2.4 实时荧光RT-PCR法检测WIF-1mRNA相对表达量 实验细胞分别加入终浓度为0.2、0.4、0.8 μmol/L的TSA混合培养液,空白对照细胞加入等量的RPMI 1640培养液,于72 h后收集细胞。用Trizol试剂抽提细胞总RNA,按照TaKaRa公司SYBR Prime ScriptRT-PCR Kit试剂盒操作说明书的步骤进行实时荧光RT-PCR检测。采用20 ml反应体系,采用Roche公司生产Light Cycler荧光定量分析仪进行荧光定量分析。以β-actin为内参,上游引物为5'-GTGAAGGTGACAGCAGTCGGTT-3',下游引物为5'-AGAAGTGGGGTGGCTTTTAGGA-3',扩增长度为157 bp;WIF-1的上游引物为5'-TCTGTTCAAAGCCTGTCTGC-3',下游引物为5'-CCTTTTATTGCAGTGTCTTCCA-3',扩 增 长 度 为111 bp。采用 2法分析细胞中 WIF-1 mRNA 的相对表达量。实验重复3次。
1.2.5 染色质免疫沉淀实验(Chromatin immunoprecipitation assay,ChIP ) 将人膀胱癌细胞EJ以适宜的密度接种于15 cm的培养皿内,待细胞铺满至培养皿的70%后,分别加入终浓度为0.2、0.4和0.8 μmol/L的TSA进行干预,空白对照细胞不加药,继续培养72 h后收集细胞。按照EZ ChIPChromatin Immunoprecipitation Kit试剂盒说明书步骤进行DNA-蛋白质交联、细胞裂解、超声破碎DNA、免疫沉淀、逆转蛋白质-DNA交联、纯化DNA及PCR,将免疫沉淀后的PCR扩增产物于2%的琼脂糖凝胶电泳。试剂盒内含有阴性对照和阳性对照,以保证实验的有效性。阳性对照抗体是RNA聚合酶Ⅱ的小鼠单克隆抗体,用于检测人源的RNA聚合酶Ⅱ。阴性对照为正常小鼠免疫球蛋白G(immunoglobulin G,IgG),用于控制染色质的非特异性免疫选择。对照引物用于扩增人GAPDH启动子区域,上游引物为5'-TACTAGCGGTTTTACGGGCG-3',下游引物为5'-GCGAACAGGAGGAGCAGAGAGCGA-3',扩增长度为 167 bp;WIF-1 启动子区上游引物为5'-CGCACCGCACTGTGAA-3',下游引物为 5'-AACAGAAGAGCGGGAAGG-3',扩增长度为154 bp。以抗乙酰化组蛋白H3中第9位赖氨酸(histone H3 lysine 9,H3-K9)抗体作为一抗,当特定基因启动子区存在乙酰化组蛋白H3-K9时,则可将对应基因片段免疫沉淀,最终通过逆转交联、纯化DNA及PCR扩增出目的产物,目的产物的多寡与基因启动子区组蛋白H3-K9乙酰化水平的高低呈正相关。实验完成后,采用凝胶成像分析仪拍照分析。
1.3 统计学分析
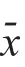
2 结果
2.1 TSA 对人膀胱癌细胞EJ增殖的影响
MTT比色法检测结果显示,TSA处理24 h后,0.4、0.8和 1.6 μmol/L 浓度组人膀胱癌细胞 EJ的增殖抑制率高于空白对照细胞,差异均有统计学意义(P
<0.05)。TSA处理48 h后,0.2、0.4、0.8和1.6 μmol/L浓度组人膀胱癌细胞EJ的增殖抑制率均高于空白对照组,差异均有统计学意义(P
<0.05);处理 72 h后,0.1、0.2、0.4、0.8和 1.6 μmol/L人膀胱癌细胞EJ的增殖抑制率均高于空白对照细胞,差异均有统计学意义(P
<0.05)。人膀胱癌细胞EJ的增殖抑制率随着TSA浓度的增加和TSA作用时间的延长而升高,存在一定的药物浓度及时间依赖性。(表1)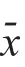
表1 不同浓度TSA作用不同时间后人膀胱癌细胞EJ增殖抑制率的比较(%,±s)
2.2 TSA 对人膀胱癌细胞EJ细胞周期的影响
流式细胞仪检测结果显示,经0.8 μmol/L浓度的TSA处理72 h后,G/G期细胞的数量高于空白对照组,差异有统计学意义(P
<0.05)。经0.2、0.4和0.8 μmol/L浓度的TSA处理72 h后,S期细胞的数量均低于对照组,差异均有统计学意义(P
<0.05)。经0.4、0.8 μmol/L浓度的TSA处理72 h后,G/M期细胞的数量高于对照组,差异有统计学意义(P
<0.05)。人膀胱癌细胞 EJ经 0.2、0.4和0.8 μmol/L浓度的TSA处理72 h后,G/G期、G/M期细胞的数量随着TSA浓度的升高而逐渐增加,S期细胞的数量随着TSA浓度的升高而逐渐减少。(表2)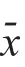
表2 TSA处理72 h后对人膀胱癌细胞EJ细胞周期的影响(%,±s)
2.3 TSA 对人膀胱癌细胞EJ中WIF-1mRNA表达的影响
RT-PCR检测结果显示,不同浓度(0.2、0.4和0.8 μmol/L)的TSA处理24、48、72 h后,与空白对照组比较,人膀胱癌细胞EJ中WIF-1
mRNA的相对表达量均升高,差异均有统计学意义(F
=64.332、336.948、457.151,P
<0.05)。经 0.4、0.8 μmol/L 的TSA处理72 h后,WIF-1
mRNA的相对表达量明显升高。(表 3)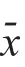
表3 不同浓度TSA作用不同时间后人膀胱癌细胞EJ中WIF-1 mRNA相对表达量的比较(±s)
2.4 TSA对WIF-1基因启动子区H3-K9乙酰化状态的影响
琼脂糖凝胶电泳结果显示,电泳条带符合预期的片段长度,未经TSA处理的人膀胱癌细胞EJ中未扩增出目的片段,经TSA处理后,人膀胱癌细胞EJ中扩增出目的片段,且随着TSA浓度的增加,目的片段的产物增多,即WIF-1
基因启动子区的组蛋白H3-K9出现了乙酰化,且乙酰化水平随着TSA浓度的增加而升高,呈一定的药物浓度依赖性(图1)。
图1 ChIP 法分析不同浓度TSA 干预人膀胱癌细胞EJ后WIF-1基因启动子组蛋白H3-K9的乙酰化水平
3 讨论
近年来,表观遗传调控在肿瘤发生、发展中的作用备受关注。组蛋白修饰作为表观遗传调控的一种重要方式,不同组蛋白的不同氨基酸可以在不同位点发生不同类型的修饰,其中,以乙酰化为主。正常情况下,组蛋白乙酰化修饰在组蛋白脱乙酰酶(histone deacetylase,HDAC)和组蛋白乙酰转移酶(histone acetyltransferase,HAT)的调控下维持动态平衡,保证相应基因的正常表达。研究发现,HDAC活性的增高可降低组蛋白的乙酰化水平,降低诱导细胞分化和凋亡的相关基因的表达水平,进而导致肿瘤发生。然而,HDAC抑制剂TSA可以通过抑制HDAC的活性,并提高特定组蛋白的乙酰化水平,从而提高或激活相应基因的表达水平,阻断相关进程。
国内外研究发现,TSA在体外可抑制结肠癌、卵巢癌、宫颈癌、横纹肌肉瘤等多种肿瘤细胞的增殖、侵袭和转移。本研究采用MTT比色法观察TSA对体外培养人膀胱癌细胞EJ生长的影响,证实不同浓度的TSA可明显抑制人膀胱癌细胞EJ的增殖,且抑制作用具有一定的浓度和时间依赖性,表明TSA对人膀胱癌细胞EJ存在类似的抑制作用。本研究进一步使用流式细胞术检测了TSA干预72 h后EJ细胞周期的变化情况,结果显示,随着药物浓度的增加,G/G期和G/M期的细胞数目逐渐增多,而S期的细胞数目逐渐下降,表明TSA可将细胞阻滞于G/G期和G/M期。Wang等分析了不同浓度的TSA(125、250和500 nmol/L)处理膀胱癌细胞12、24 h后的细胞周期分布情况,结果显示,随着TSA浓度的升高,出现了G/M期阻滞和亚G峰(sub-G)形成,与本研究结果类似。
WIF-1是近年来发现的肿瘤抑制因子,其基因定位于染色体12q14.3上,全长约200 kb,可通过结合WNT蛋白抑制WNT通路的活性。大量研究证明,肺癌、宫颈癌、甲状腺乳头状癌等恶性肿瘤中存在WIF-1的表达缺失或下调,最终导致WNT信号通路被异常激活,从而引起相应肿瘤发生。本研究通过实时荧光RT-PCR法发现,人膀胱癌细胞EJ中的WIF-1 mRNA呈低表达,而经TSA处理后,WIF-1 mRNA的表达水平明显升高。研究发现,组蛋白H3-K9和组蛋白H4中第16位赖氨酸(histone H4 lysine 16,H4-K16)的乙酰化状态与肺癌复发密切相关。为了解在膀胱癌中是否存在类似情况,本研究进一步利用染色质免疫沉淀技术检测了人膀胱癌细胞EJ中WIF-1基因启动子区H3-K9的乙酰化状态,结果显示,于TSA处理前,WIF-1基因启动子区未发现组蛋白H3-K9的乙酰化,用药后,组蛋白H3-K9出现乙酰化,且乙酰化水平随着TSA浓度的增加而升高,与WIF-1 mRNA表达水平的变化趋势一致。初步表明,TSA能够改变WIF-1基因启动子区组蛋白H3-K9的低乙酰化状态,提高乙酰化水平,使WIF-1 mRNA的表达水平升高。
综上所述,TSA可以在体外抑制人膀胱癌细胞EJ的增殖,其作用机制可能与细胞周期阻滞、WIF-1基因启动子区组蛋白H3-K9乙酰化状态改变、WIF-1基因表达水平提高有关,为更好地了解膀胱癌的发病机制和寻找新型治疗药物提供了一定的实验依据。
