发酵类中药饮片淡豆豉和六神曲微生物污染情况及耐热菌考察
2021-04-24丁纯洁陈丽艳孙银玲郑宏宇王伟明
石 柳 丁纯洁 陈丽艳 孙银玲 曹 阳 郑宏宇 王伟明
黑龙江省中医药科学院中药研究所,黑龙江哈尔滨 150036
近年来,中药饮片微生物污染问题引起广泛关注,而发酵类中药饮片比普通中药饮片存在更高安全风险。发酵类中药饮片是指采用发酵法炮制,因复杂生物转化而起到改变药性、增强药效、降低毒性等作用的中药饮片[1-2]。其中参与发酵的微生物受环境等多种因素影响种群变化较大,使其质量不可控、易污染内外源有害微生物[3]。此外,部分发酵类中药饮片也存在可调整肠道菌群的有益发酵菌[4-6],如枯草芽孢杆菌、地衣芽孢杆菌等[7-8],不应作为污染菌加以限制。目前对发酵类中药饮片微生物限度标准未见特殊规定[9-10],相关系统研究也鲜有报道。
淡豆豉(Sojae Semen Praeparatum)和六神曲(Massa Medicata Fermentata)在临床及成方制剂中最为常用,分别收载于《中华人民共和国药典》[11]及部颁标准[12]中。因此本研究选择不同产地和批次的淡豆豉和六神曲,对其需氧菌、霉菌和酵母菌、控制菌及耐热菌进行考察,鉴定耐热菌,为发酵类中药饮片微生物限度标准的制订提供更完整的依据。
1 材料与方法
1.1 供试品
10批次淡豆豉饮片产地分别为:山东(D1-1)、云南(D2-1)、广东(D3-1)、北京(D4-1)、北京(D4-2)、河北(D5-1)、河北(D5-2)、安徽(D6-1)、安徽(D6-2)、安徽(D6-3);5批次六神曲饮片产地分别为:四川(L7-1)、福建(L8-1)、河北(L9-1)、安徽(L10-1)、安徽(L10-2)。所有饮片均购自哈尔滨市各药店。
1.2 标准菌株
金黄色葡萄球菌CMCC(B)26003、大肠埃希菌CMCC(B)44102、白色念珠菌CMCC(B)98001和黑曲霉CMCC(F)98003购自中国医学细菌保藏管理中心;枯草芽孢杆菌CMCC(B)63501、铜绿假单胞菌CMCC(B)10104和乙型副伤寒沙门菌CMCC(B)50094购自北京北纳创联生物技术研究院。
1.3 仪器
DHP9272恒温培养箱(上海一恒科学仪器有限公司);DL-CJ-2N超净工作台(北京东联哈尔仪器制造有限公司);BSA224S赛多利斯电子天平(0.0001 g)(德国赛多利斯科学仪器有限公司);LDZX-50KBS立式压力蒸汽灭菌器(哈尔滨华仪行经贸有限公司);Biolog微生物自动分析仪(美国Biolog公司);MF3迅数菌落分析仪(杭州迅数科技有限公司)。
1.4 培养基及主要试剂
沙氏葡萄糖琼脂培养基HB0253-81、胰酪大豆胨琼脂培养基HB0177-1、麦康凯液体培养基HB8313-5、麦康凯琼脂培养基HB6238-10、紫红胆盐葡萄糖琼脂培养基HB0116-4、肠道菌增菌液体培养基HBKP0 126-4、RV沙门菌增菌液体培养基HB4198-11、木糖赖氨酸脱氧胆酸盐琼脂培养基HB4105-6、三糖铁琼脂培养基HB4088-62、溴化十六烷基三甲铵琼脂培养基HBKP5184-31、甘露醇氯化钠琼脂培养基HB41 28-22、念珠菌显色培养基HB7015均购自青岛海博生物技术有限公司;Biolog-Gen ⅢMicroplate购自美国Biolog公司;1%二盐酸N,N-二甲基对苯二胺试液(批号:20191014)和吐温80(批号:301C054)均为国产分析纯。
1.5 供试液制备
取供试品25 g加入225 mL pH 7.0的无菌氯化钠-蛋白胨缓冲液,充分振摇荡洗制成1∶10供试液。
1.6 方法适用性实验
方法适用性实验参考2015年版 《中华人民共和国药典》四部微生物限度检查法通则1105和1106[13]。
1.6.1 倾注法计数方法适用性试验 试验组取适当稀释的供试液10 mL与0.1 mL菌液混匀,取混合液1 mL于无菌平皿中,注入培养基,平行制备2个平皿。用pH 7.0无菌氯化钠-蛋白胨缓冲液替代菌液为供试品对照组,替代供试液为菌液对照组。需氧菌30~35℃培养3 d,霉菌和酵母菌20~25℃培养5 d。
1.6.2 控制菌方法适用性试验 分别取供试液10 mL,接种至100 mL每一控制菌对应液体培养基中,再加入相应菌液1 mL,33℃培养18 h。取上述培养物划线接种于对应培养基平板,33℃培养18 h。
1.7 需氧菌、霉菌和酵母菌考察
参照“1.6.1”项下,取适当稀释倍数的3个连续稀释级供试液1 mL于无菌平皿中,分别加入胰大豆胨琼脂培养基和沙氏葡萄糖琼脂培养基平行制备2个平皿,分别以最接近且小于300 cfu和100 cfu菌落数的胰大豆胨琼脂培养基和沙氏葡萄糖琼脂培养基平皿计数。
1.8 控制菌污染情况考察
参照“1.6.2”项下,检测淡豆豉和六神曲饮片中金黄色葡萄球菌、大肠埃希菌、耐胆盐革兰阴性菌、铜绿假单胞菌、乙型副伤寒沙门菌和白色念珠菌。
1.9 耐热菌考察
取供试品10 g加入pH 7.0无菌氯化钠-蛋白胨溶液至100 mL,煎煮30 min,参照“1.6.1”项下,测定耐热菌菌落总数并分离、纯化优势耐热菌株,加入GenⅢ板孵育后通过显色孔产生的“表型指纹”同Biolog数据库比较,在种的水平上鉴定微生物。
2 结果
2.1 需氧菌、霉菌和酵母菌方法适用性试验结果
倾注法计数及控制菌检查方法均符合《中华人民共和国药典》[13]规定。见表1~2。
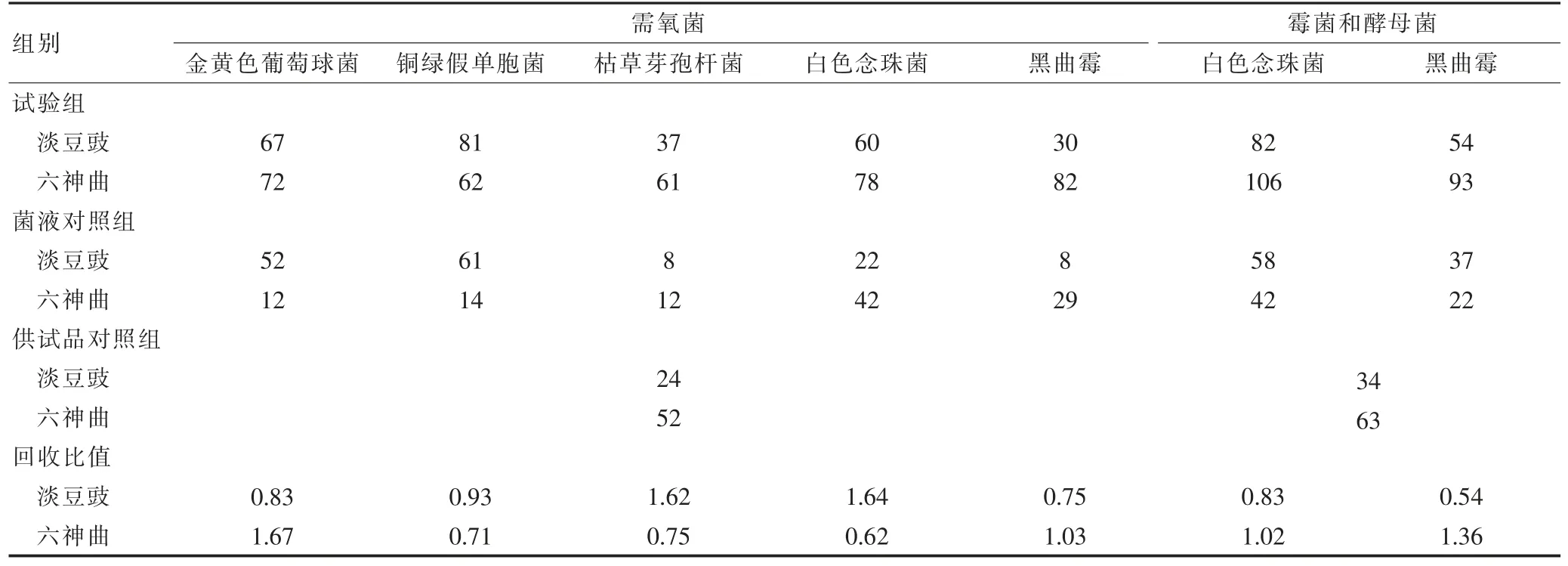
表1 需氧菌、霉菌和酵母菌方法适用性试验结果(x,cfu/平皿,n=2)

表2 控制菌方法适用性试验结果(n=2)
2.2 需氧菌、霉菌和酵母菌微生物计数结果
市售淡豆豉饮片各批次需氧菌介于104~108cfu/g,霉菌和酵母菌介于103~108cfu/g;六神曲饮片各批次需氧菌、霉菌和酵母均介于103~105cfu/g。见表3。
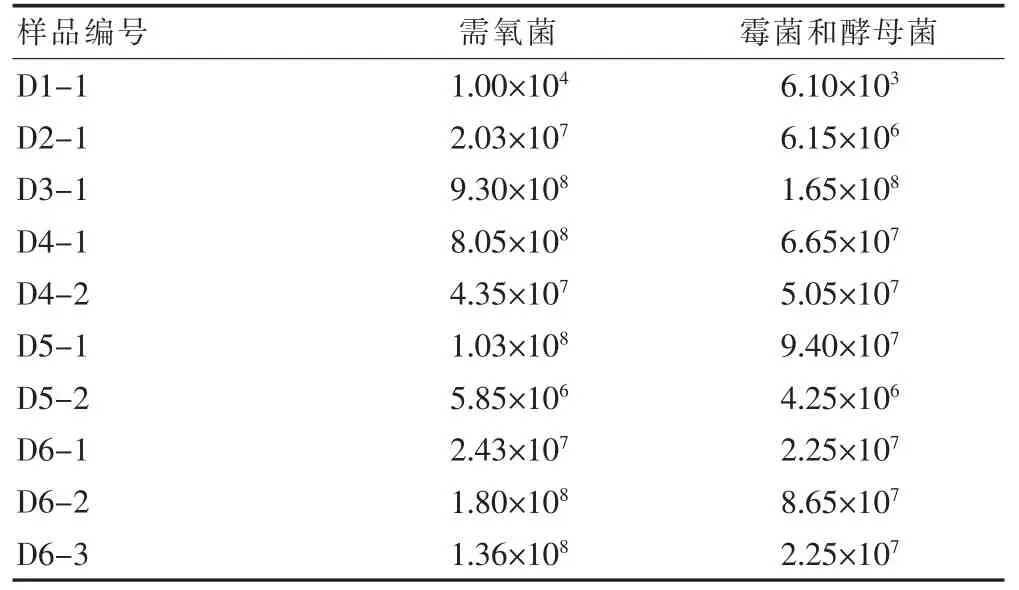
表3 淡豆豉饮片需氧菌、霉菌和酵母菌微生物计数结果(cfu/g)

表4 六神曲饮片需氧菌、霉菌和酵母菌微生物计数结果(cfu/g)
2.3 控制菌检查结果
10批次淡豆豉饮片均检出控制菌,其中全部批次检出金黄色葡萄球菌,8批次检出大肠埃希菌,4批次检出耐胆盐革兰阴性菌数量>103cfu/g,6批次检出铜绿假单胞菌,乙型副伤寒沙门菌和白色念珠菌均未检出。
5批次六神曲饮片中有4批次检出控制菌,其中2批次检出金黄色葡萄球菌,4批次检出大肠埃希菌,1批检出次耐胆盐革兰阴性菌数量>103cfu/g,铜绿假单胞菌、乙型副伤寒沙门菌和白色念珠菌均未检出;L9-1均未检出上述控制菌。
2.4 耐热菌检查结果
淡豆豉和六神曲饮片经加热煮沸后需氧菌总数分别平均降低1.5和3.2个对数单位。淡豆豉饮片耐热菌数量介于103~108cfu/g,>105cfu/g的样品比例达80%。其中D2-1耐热菌总数水平最低,D3-1最高。六神曲饮片L8-1和L10-2未检测出耐热菌,其余3批次含量介于10~102cfu/g,L9-1耐热菌总数水平最高。共分离出8株优势耐热菌株,均为芽孢杆菌,其中6株为枯草芽孢杆菌及亚种,1株地衣芽孢杆菌,1株索诺拉沙漠芽孢杆菌。
3 讨论
发酵炮制的中药饮片不仅易受原辅料及环境中有害微生物污染[14-16],还需确保一定数量有益发酵菌促进发酵基质活性成分的生物转化[17-18]。而《中华人民共和国药典》[13]2015年版仅对“研粉口服用贵细饮片、直接口服及泡服饮片”的部分控制菌进行检查,以国外标准判断饮片质量会存在一定比例不合格率[19-20],阻碍中药国际化进程。
本研究显示淡豆豉饮片需氧菌、霉菌和酵母菌的数量最高可达108cfu/g,如用于中成药中很难达到药典标准,此外,不同批次的淡豆豉饮片控制菌污染严重,提示无论直接口服或做成含原粉制剂都存在一定安全隐患。以枯草芽孢杆菌为主的耐热菌具有丰富营养成分及广泛药理活性[21-22],提示发酵类中药饮片可采用无菌可控温条件下纯菌种发酵制备以保证用药安全和质量稳定。目前淡豆豉、六神曲等发酵类中药饮片的纯种发酵工艺研究已有报道[23-25],对其质量标准提升提供了依据,但尚需系统研究。
综上所述,应在纯种发酵前提下根据不同发酵类中药饮片品种,针对性建立微生物限度指标,从控制污染和确保药效两个角度发挥发酵类中药的特殊优势。
