天然石墨表面自组装SnO2-FeO(OH)高容量锂离子电池负极
2021-04-23杨稳稳周玉林王梦月张利亚雷建飞
杨稳稳, 周玉林, 王梦月, 张利亚, 雷建飞
(河南科技大学物理工程学院, 洛阳 471023)
石墨是最早实现锂离子电池商业化的负极材料,同时也是目前商业化应用最成功的负极材料. 石墨导电性能优异,因此石墨负极的电化学过程动力学主要取决于Li+在石墨内部的扩散行为. 理论上,石墨的片层状结构非常利于Li+在片层间的快速传输而展现出优异的倍率性能,但实际情况并非如此,纯石墨负极的倍率性能较差,大电流充放电容易使处在石墨表面的Li+因来不及扩散而发生局部沉积,形成锂枝晶[1-3]. 通常情况下,Li在石墨负极中主要以石墨层间嵌入储存、石墨层端面储存和石墨晶体表面储存的方式进行,其中主要容量贡献来自层间嵌入储存[4]. 在Li+的嵌入反应过程中,电极/电解液界面的烷基会促使溶剂分子与Li+的共嵌入,由此引起石墨片层的剥落,材料的循环稳定性下降. 为避免这种现象的出现,将石墨表面氧化、氟化以及包覆等处理是行之有效的解决办法. 石墨表面的氧化具有2个功能:一方面,可以减少表面烷基以阻止溶剂分子与Li+的共嵌入;另一方面,可使石墨表面的酸性基团转变为-COOLi和-OLi,从而形成稳定的固态电解质界面(SEI)膜,改善材料的循环性能[5-6]. 表面氟化处理则可使石墨表面形成分子间作用力较大的C—F结构,加强石墨的结构稳定性,防止在循环过程中石墨片层的脱落[7]. 表面包覆是在石墨表面形成一层保护膜,可减少石墨与溶剂的直接接触,从而有效避免因溶剂分子的共嵌入导致的石墨片层剥离现象. 同时,石墨表面包覆层还可扩大电解液体系的选择范围并提高电极材料的循环稳定性[8]. 在石墨表面进行无定形碳包覆是最常采用的策略之一. 经无定形碳包覆的石墨负极,由于无定形碳的层间距比石墨的层间距大,可以改善Li+在其中的扩散性能. 此外,无定形碳在石墨外表面形成一层Li+的缓冲层,可有效提高材料的倍率性能[9-10]. 金属包覆的石墨负极,其表面电荷转移电阻较小,利于Li+的扩散,从而抑制电解液在石墨表面的分解,提高材料的电化学性能[11-12]. 金属氧化物包覆石墨可在一定程度上阻止电解液中溶剂分子与石墨间的反应,从而降低材料的不可逆容量,提高充放电效率[13]. 由此可见,改善石墨负极电化学性能的有效方式是对石墨表面进行功能化处理. 一方面可阻止溶剂分子的共嵌入,另一方面可促进处于石墨表面的Li+快速扩散. 不过,石墨表面修饰虽然能使石墨负极的稳定性和倍率性能有所改善,但能量密度仍未得到有效提升.
基于上述分析,大多文献报道的表面包覆层结构只起到了对石墨的保护作用,对其容量没有贡献作用. 本文报道了一种能同时提高石墨负极稳定性和容量的表面包覆结构,即在天然石墨表面构建SnO2-FeO(OH)精细结构. 该精细结构的设计目的:实现阻止溶剂分子与Li+的共嵌入,促进处于石墨表面Li+的快速扩散,通过Li+与SnO2和FeO(OH)的转化反应提高石墨负极的容量.
1 实验方法
1.1 主要试剂与仪器
试剂:锡酸钾(K2SnO3·3H2O,AR)、三氯化铁(FeCl3·6H2O,AR)、天然石墨(深圳贝特瑞)、导电剂(Super-P-Li)、粘结剂(聚偏氟乙烯,PVDF)、N-甲基吡咯烷酮(NMP)、微孔聚丙烯膜(Cellgard 2300)、碳酸乙烯酯(EC)、碳酸二甲酯(DMC).
仪器:扫描电子显微镜(JSM-7800F,德国ZEISS)、X射线粉末衍射仪(D8 Advance,德国布鲁克)、傅里叶变换红外光谱仪(FT-IR 1500,日本岛津)、电池测试系统(CT2001A,武汉蓝电)、电化学工作站(CHI 660E,上海辰华).
1.2 材料制备
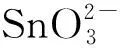
1.3 结构表征
利用配带有能谱分析仪的扫描电子显微镜观察材料的表面形貌,并分析表面元素分布及半定量分析元素的质量分数. 利用X射线粉末衍射仪对石墨表面的包覆层进行物相分析. 利用傅里叶变换红外光谱仪确认铁元素的存在形式.
1.4 电化学测试
材料的电化学性能测试采用CR2025型扣式电池进行. 活性材料、导电剂和粘结剂按质量比8∶1∶1配制,并用NMP调浆后涂布在铜箔集流体上,经干燥、辊压、切片后制成工作电极. 对电极和参比电极为锂片,微孔聚丙烯膜为隔膜. 电解液为含1.0 mol/L LiPF6的EC(碳酸乙烯酯)和DMC(碳酸二甲酯)体积比为1∶1的混合体系,在高纯度氩气保护的手套箱中组装电池. 使用蓝电电池测试系统在不同电流密度下进行充放电循环测试,电压窗口为0~2 V(vs. Li/Li+,全文同). 循环伏安曲线(CV)和电化学交流阻抗谱(EIS)在电化学工作站上进行. 充放电流密度1C=372 mA/g.
2 结果与讨论
2.1 材料的表征结果
图1为制备样品的分析表征测试结果. 图1为天然石墨和修饰石墨C@SnO2-FeO(OH)的扫描电子显微照片. 对比发现,经溶胶处理后的修饰石墨样品与天然石墨样品的显微结构没有区别,说明C@SnO2-FeO(OH)的包覆层均匀且极薄. 依据本文的前期研究结果[14],当天然石墨分散于H2SnO3@Fe(OH)3稳定胶束体系时,静电作用会促使H2SnO3@Fe(OH)3在石墨表面自组装形成均匀的表面包覆层,该包覆层在水热反应过程中转变为SnO2纳米晶弥散于非晶态FeO(OH)的超薄精细结构,其中SnO2的粒径不到6 nm. 从图1C的元素分布图可以看出,C@SnO2-FeO(OH)结构分布均匀,未出现SnO2和FeO(OH)的堆积现象. 由能谱测试结果(图1D)可估算石墨表面SnO2-FeO(OH)结构的质量分数约3.3%,其中SnO2和FeO(OH)各占1.6%和1.7%. 由此可见,经表面处理后的石墨,SnO2和FeO(OH)的质量分数极低,如此薄的包覆层几乎不会影响石墨的振实密度. 傅里叶变换红外光谱(图1E)则可以证明体系中的铁元素经水热反应后转变为FeO(OH)而不是铁氧化物. 由图1E可见,在波数400~800 cm-1范围内可以观察到在489、510和678 cm-1处有3个明显的吸收峰,对应于铁的氧化物或氢氧化物中Fe—O键的伸缩振动,这与文献报道的结果一致[15-17]. 在843 cm-1处出现-OH基团较弱的弯曲振动吸收峰,而在1 629 cm-1和3 420 cm-1处分别出现了-OH基团的弯曲振动和伸缩振动的强吸收峰. 由此可以推断制备材料中的Fe元素以FeO(OH)的形式存在. 同时,结合图1F的XRD图谱可知,SnO2-FeO(OH)中FeO(OH)为非晶态结构而SnO2为晶态结构. 因此,利用溶胶自组装技术结合水热反应,在天然石墨表面构建超细SnO2纳米晶弥散于非晶态FeO(OH)的超薄精细结构. 本文通过这种结构的设计,期望石墨负极在充放电循环过程中,利用SnO2-FeO(OH)包覆层在有效阻止溶剂分子与Li+共嵌入的同时,能够促进石墨表面Li+的快速扩散,并通过Li+与SnO2和FeO(OH)的转化反应进一步提高石墨负极的容量.
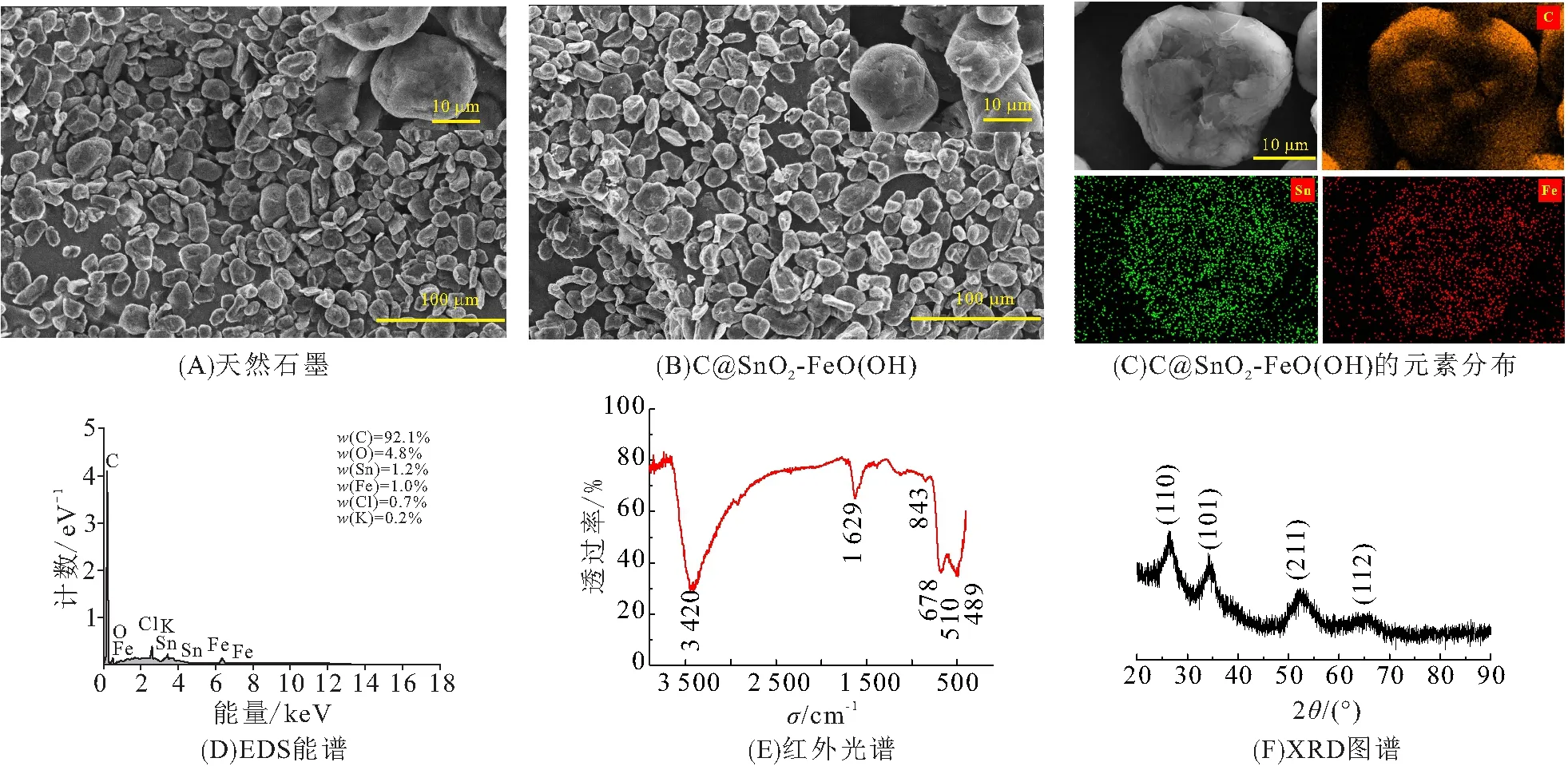
图1 材料的表征结果
2.2 电池的循环稳定性
为了评价C@SnO2-FeO(OH)的电化学性能,分别组装天然石墨和修饰石墨C@SnO2-FeO(OH)负极组成的纽扣电池,并对比测试了两者的电化学性能. 图2为循环稳定性对比图,修饰石墨的容量比商业化天然石墨的容量更高. 在0.1C电流密度下,C@SnO2-FeO(OH)的首次放电容量达到501 mAh/g,首次充放电效率为77.5%,与商业石墨(79%)接近. 循环100次后放电容量仍保持在384.4 mAh/g,与第二次的放电容量(394 mAh/g)相比,容量损失率仅为2.4%. 此外,修饰石墨的放电容量在相同充放电条件下也超出了商业化天然石墨放电容量(312 mAh/g)的23%,说明表面包覆的SnO2-FeO(OH)结构明显提高了石墨负极的容量. 从图2A还可看出,修饰石墨的稳定性也有所改善,天然石墨在循环50次后变得不太稳定.
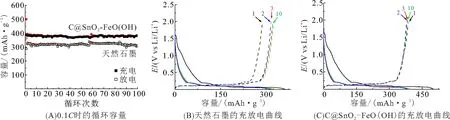
图2 不同材料的循环稳定性对比
2.3 电池的倍率性能
对比可知,C@SnO2-FeO(OH)的倍率性能优于天然石墨的倍率性能(图3). 即使在1C电流密度下,表面修饰后石墨的平均放电容量也可达到94.4 mAh/g. 当材料经倍率测试后,再经小电流充放电循环(0.1C)测试,容量仍能回到初始容量的90%以上,而天然化石墨的容量仅恢复到初始容量的77.4%,表明修饰石墨电极材料经大电流充放电循环后结构仍能保持完好. 倍率性能测试结果说明:天然石墨经表面构建SnO2@FeO(OH)精细结构后,不但提高了石墨的充放电容量和稳定了电极体系,还提高了Li+扩散速度.
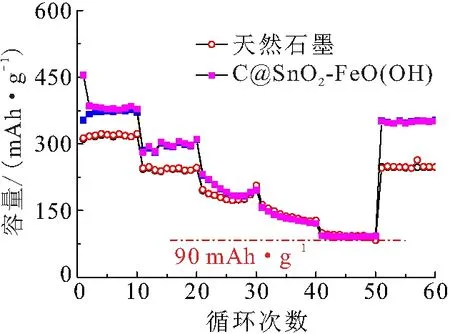
图3 材料的倍率性能对比
2.4 电池的循环伏安特性
C@SnO2-FeO(OH)的循环伏安特性如图4所示,表面修饰的石墨首次放电过程在1.27 V和1.50 V处明显出现了FeO(OH)与Li+的转化反应还原峰,随着充放电循环的进行,第4、5次循环在0.16 V出现了Sn与Li的合金化反应还原峰. 说明表面包覆层在充放电循环过程参与了储锂反应,对材料具有一定的容量贡献. 第二次以后的充放电循环曲线基本重合,说明材料在首次放电过程中已经形成了稳定的SEI膜,后续循环中电极表面处于稳定状态.
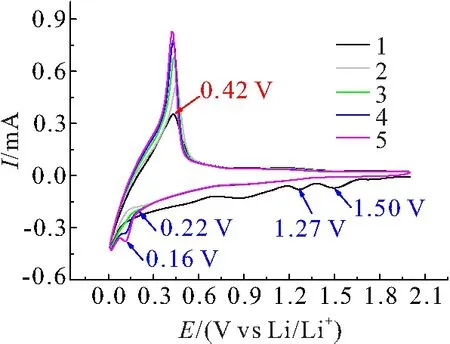
图4 2 mA/s扫描速率下C@SnO2-FeO(OH)的循环伏安曲线
2.5 交流阻抗特性
天然石墨与修饰石墨经不同次数循环后测试交流阻抗图(图5),并拟合出等效电路的参数(表1). 在拟合数据时采用Ro(RctQ)Zw等效电路,其中Ro代表欧姆接触电阻,Rct代表电荷传递电阻,Zw代表韦伯扩散(Warburg)电阻. 首先,从交流阻抗拟合数据可以看出,经历首次循环后,天然石墨和修饰石墨的Rct分别从815.5、796.6 Ω减小到246.5、154.2 Ω,说明电极材料经首次循环后得到充分活化,导电性增强;其次,当经历5次充放电循环后,天然石墨和修饰石墨的Rct与首次循环的Rct相比变化不大,说明电极材料的结构已基本达到稳定状态. 从拟合等效电路可知,低频处反应主要受韦伯扩散过程控制,据此可计算Li+的扩散系数[18]
其中,R为常数(8.314 J/(mol·K)),T为温度(K),n为转移电子数,A为电极面积(cm2),F为法拉第常数(96 480 C/mol),c为Li+体相浓度(约1 mol/mL),σ为阻抗因子. 计算结果列于表1,电极材料经首次循环活化后更利于Li+的扩散,且石墨表面构建SnO2-FeO(OH)精细结构后,其扩散系数DLi+也明显高于天然石墨,此结果也可以间接说明表面包覆层能够促进处于石墨正面的Li+扩散. 电化学交流阻抗实验结果表明:SnO2-FeO(OH)界面结构能够稳定石墨表面的SEI膜,有利于石墨正面的Li+扩散,此结论与上述倍率性能结果一致.
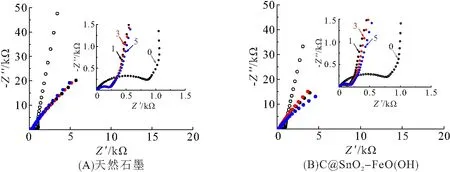
图5 天然石墨与C@SnO2-FeO(OH)的交流阻抗图
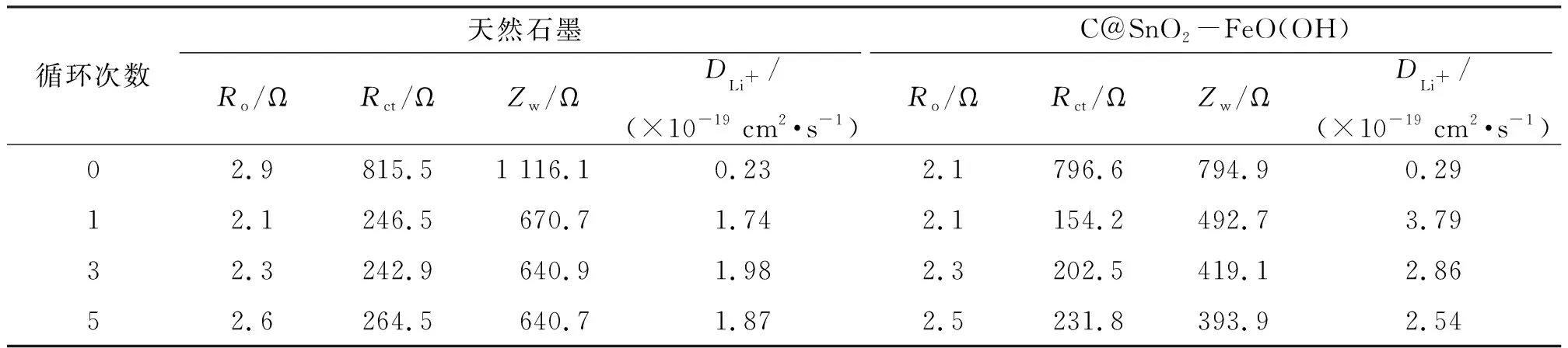
表1 天然石墨与C@SnO2-FeO(OH)的交流阻抗拟合值Table 1 The fitting values of the graphite and C@SnO2-FeO(OH) based on the AC impedance experiments
图6说明石墨表面构建SnO2-FeO(OH)界面结构对其电化学性能的促进作用. 对于天然石墨而言,Li+只能通过石墨端面的层间嵌入,处于石墨正面的Li+因无法穿越石墨烯二维面到达片层之间,只能以表面缓慢迁移或沉积的方式完成电化学过程(图6A). 这样会导致锂在石墨表面以锂枝晶的形式快速沉积. 此外,未经表面修饰的天然石墨在循环的开始阶段发生溶剂分子与Li+的共嵌入,并引起石墨片层被剥离,使形成的SEI膜遭到破坏,从而导致循环性能下降.

图6 Li+在天然石墨和C@SnO2-FeO(OH)中的嵌入示意图
当石墨表面包覆纳米结构时(图6B),纳米尺度的包覆结构既不会影响Li+扩散进入石墨的端面层间,又可阻止溶剂分子的共嵌入,从而避免了石墨在多次循环过程中的剥离现象. 同时,当包覆结构本身具有锂活性时,一方面可增加石墨的容量,另一方面也可以改善处于石墨正面Li+的扩散状况,不会造成表面锂的堆积现象,安全性能也得到提高.
3 结论
溶胶法结合水热反应可以快速、大量地制备表面包覆纳米结构的石墨负极材料. 在天然石墨表面构建具有晶态/非晶态的纳米薄层结构,一方面可阻止溶剂分子与Li+的共嵌入,可促进石墨表面Li+的快速扩散,另一方面可通过Li+与SnO2和FeO(OH)的转化反应提高石墨负极的比容量.
