不同方式干燥对猴头菌营养成分含量及抗氧化活性的影响
2021-04-22王悦姜永红张强李美秋闫宝松郑健
王悦 姜永红 张强 李美秋 闫宝松 郑健
摘要:以采摘于黑龙江省海林市的猴头菌为研究对象,分别使用自然干燥、加热鼓风干燥、真空低温干燥、真空加热干燥以及真空微波干燥方式将猴头菌制备成干燥样品,然后利用紫外可见光分光光度计定量分析经不同干燥方式处理后制备的样品中黄酮、总酚、可溶性蛋白以及可溶性糖的含量。同时利用紫外可见光分光光度计定量分析样品对自由基的清除活性进而评价经不同干燥方式处理后样品的抗氧化活性。结果表明:(1)60 ℃与70 ℃真空加热干燥处理的样品其黄酮含量显著高于通过其他干燥处理方式处理的样品。50 ℃加热鼓风干燥处理的样品的黄酮含量最低;60 ℃与70 ℃真空加热干燥处理的猴头菌其总酚含量显著高于通过其他干燥方式处理的样品。真空低温干燥处理的样品中总酚含量最低;可溶性蛋白含量由高到低依次为真空低温干燥、加热鼓风干燥、真空加热干燥、真空微波干燥。真空低温干燥处理的样品中可溶性糖含量显著低于其他处理,50 ℃真空加热干燥处理的样品中可溶性糖含量显著较高。(2)60 ℃真空加热干燥组的样品其水提物的1,1-二苯基-2-苦肼基自由基(DPPH)清除率较高,但是所有干燥处理样品的DPPH自由基清除能力均弱于维生素C。经过不同干燥方式处理的猴头菌样品其水提液对2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基(ABTS)清除率较维生素C均相对较高。以上结果表明不同的干燥方式会对猴头菌中营养成分含量及抗氧化能力造成影响。
关键词:猴头菌;干燥方式;紫外可见光分光光度法;营养成分;抗氧化
中图分类号:TS255.36 文献标志码: A
文章编号:1002-1302(2021)05-0159-05
猴头菌(Hericium erinaceus)属真菌门担子菌亚门猴头科猴头属,是一种珍贵的药食兼用菌。猴头菌具有较高的营养与保健价值,富含多糖、甾醇、酚类、萜类等多种活性物质,具有提高免疫力、增强肿瘤治疗效果以及抗衰老等多种保健作用[1]。近年来研究人员对于猴头菌的研究,多集中于其生物学特征、栽培技术及活性物质的药理作用方面。而对于后加工处理对猴头菌营养成分造成的影响鲜有研究。
人体持续不断地与外界接触,由于呼吸、外界污染、放射线照射等因素在人体体内不断地产生自由基。研究表明,衰老、癌症或某些疾病大都与过量自由基的产生有关联。研究抗氧化可以有效地克服自由基所带来的危害,所以保健品、化妆品企业将抗氧化能力列为主要的研发方向之一,也是市场最重要的功能性诉求之一。本研究对几种干燥处理后的猴头菌样品水提取液营养成分及自由基清除能力进行比较,旨在为猴头菇产品的后加工处理提供一定的理论基础。
1 材料与方法
1.1 试验材料
新鲜猴头菌样品采自黑龙江省牡丹江市海林市土砬子村菇棚。
本试验所用的药品与试剂包括一水合·没食子酸、1,1-二苯基-2-苦肼基自由基(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基(ABTS)购自西格玛奥德里奇(上海)贸易有限公司。
1.2 猴头菌鲜样的干燥处理
猴头菌的干燥方式主要有加热鼓风干燥、真空低温干燥、真空加热干燥以及真空微波干燥。其中加热鼓风干燥温度分别设为50、60、70 ℃;真空冷冻干燥温度设为-80 ℃,压强条件为不大于50 MPa;真空加热干燥温度条件分别为50、60和70 ℃,压强条件为-0.06 MPa;真空微波干燥压强条件为 -0.06 MPa,微波功率分别为1.34、2.68、4.02 kW。
1.3 猴头菌供试液的制备
猴头菌干燥处理后,将粉末置于蒸馏水中,经过超声提取,12 000 r/min离心10 min,取上清液得猴头菌供试品液。
1.4 猴头菌可溶性糖、可溶性蛋白、总酚及黄酮含量的测定
利用苯酚-硫酸法测定可溶性糖含量[5]。制备葡萄糖标准品溶液,经紫外-可见光分光光度计定量分析可溶性糖含量后绘制标准曲线。以可溶性糖含量(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线。线性回归方程为y=0.010 4x+0.040 1,r2=0.999 6。
利用考马斯亮蓝法测定可溶性蛋白含量[6]。制备蛋白质标准品溶液,经紫外-可见光分光光度计定量分析可溶性蛋白含量后绘制标准曲线。以吸光度(x)为横坐标,粗蛋白含量(y)为纵坐标绘制标准曲线,得回归方程为y=0.143 5x+0.000 6,r2=0.993 3。
利用福林-酚法测定总酚含量[7]。制备一水合·没食子酸标准品溶液,经紫外-可见光分光光度计定量分析总酚含量后绘制标准曲线。以吸光度(x)为横坐标,总酚含量(y)为纵坐标绘制标准曲线,得回归方程为y=0.054 5x-0.000 4,r2=0998 2。
制备芸香苷标准品溶液,作为测定黄酮含量的标准液。经紫外-可见光分光光度计定量分析黄酮含量后绘制标准曲线[8]。以吸光度(x)为横坐标,黄酮含量(y)为纵坐标绘制标准曲线,得回归方程为y=0.243 6x+0.002 4,r2=0.996 4。
分别根据标准曲线计算猴頭菌供试液中的可溶性糖、可溶性蛋白、总酚和黄酮含量。
1.5 猴头菌供试液抗氧化能力的测定
通过DPPH自由基清除活性测定[9]与ABTS自由基清除活性测定[10]评价猴头菌供试液的抗氧化活性。
系列供试液的制备:根据“1.4”节测得的总酚含量确定上清液浓度,将提取溶液稀释至1 mg/mL作为母液,利用母液制备浓度梯度0.050 0~0.000 5 mg/mL(0.050 0、0.025 0、0.010 0、0.005 0、0.002 5、0.001 0、0.000 5 mg/mL)的系列供试液,于4 ℃避光保存。
1.5.1 DPPH自由基清除活性测定
将系列供试液与固定浓度的DPPH自由基溶液(0.2 mmol/L DPPH-乙醇溶液)混合,于黑暗条件下放置30 min,利用紫外-可见光分光光度计测定混合溶液在 517 nm处的吸光度。维生素C为阳性对照,DPPH自由基清除率按下列公式计算:
清除率=/D0×100%。
式中:D0为空白对照组吸光度(水);D1为试验组吸光度;D2为环境对照组吸光度(乙醇)。
1.5.2 ABTS自由基清除活性测定
ABTS自由基溶液的制备:将7 mmol/L ABTS溶液与2.45 mmol/L K2S2O8溶液按照体积比1 ∶1混合,室温避光搅拌,黑暗反应16 h,然后用无水乙醇稀释至734 nm处的吸光度为0.70±0.02。将系列供试液与ABTS自由基溶液混合,利用紫外-可见光分光光度计测定混合溶液在734 nm的吸光度。维生素C为阳性对照,ABTS自由基清除率按下列公式计算:
清除率=(D0-D1)/D0×100%。
式中:D0为空白对照组吸光度;D1为试验组吸光度。
1.6 数据处理
所有试验均重复3次以上,数据结果以平均值±标准差的形式表示。采用Microsoft Excel 2010、SPSS 17.0、GraphPad Prism 6.0軟件和主成分分析法对试验数据进行分析。
2 结果与分析
2.1 干燥速率比较
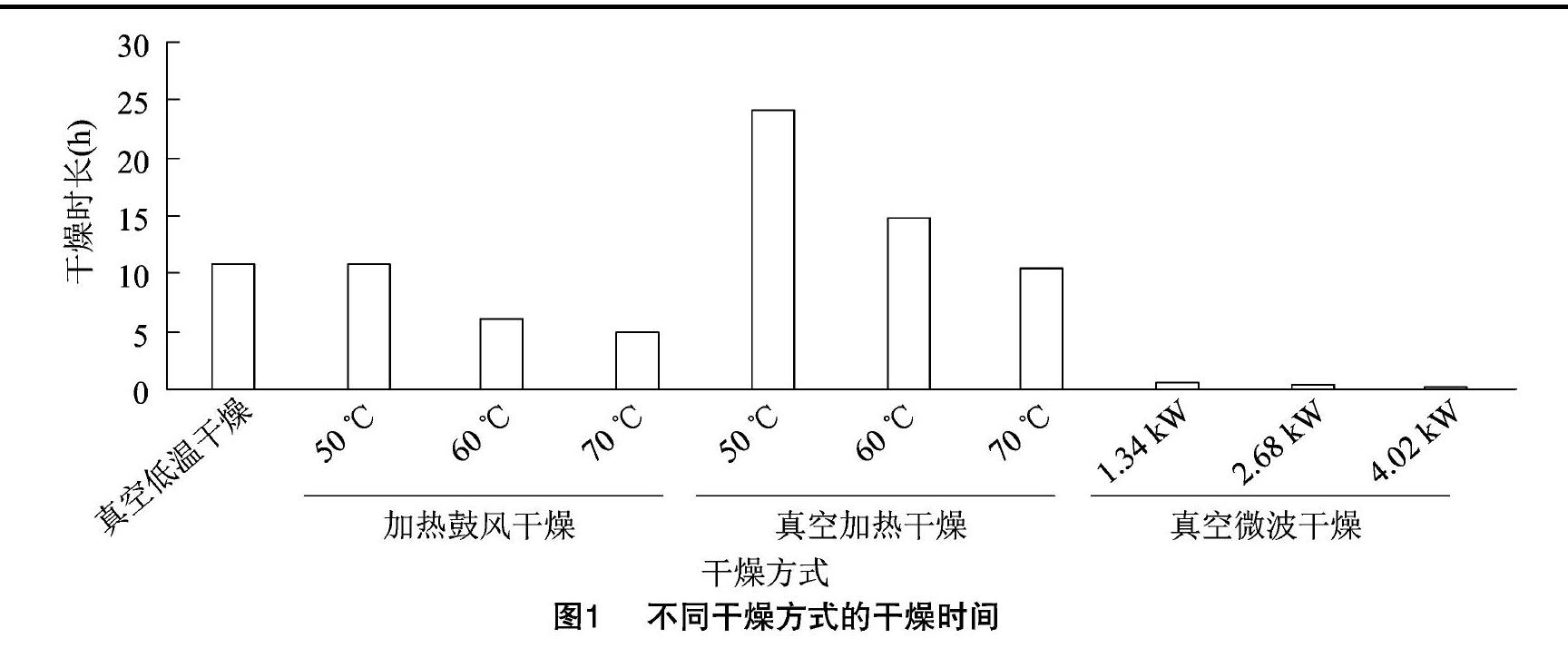
如图1所示,对定量的猴头菇鲜样进行干燥处理,真空微波干燥处理速率最高,干燥时长最短。其中微波功率1.34 kW条件下干燥时长为(37.0±6) min;微波功率2.68 kW条件下干燥时长为(230±3) min;微波功率4.02 kW条件下干燥时长为(14.0±1.2) min。加热鼓风干燥处理速率普遍高于真空加热干燥处理。真空低温干燥处理速率介于加热鼓风干燥处理与真空加热干燥处理之间。
真空加热干燥速率较慢可能是由于在干燥处理过程中汽化产生的水蒸气不能及时排出,导致干燥环境水汽过大,水蒸气饱和,造成干燥速率降低。真空微波干燥速率较快可能是因为其干燥特性造成的[11]。由于微波功率较大,造成样品内外温度快速增加,样品快速脱水。
2.2 不同干燥方式处理的猴头菌中可溶性糖、可溶性蛋白、总酚和黄酮含量比较
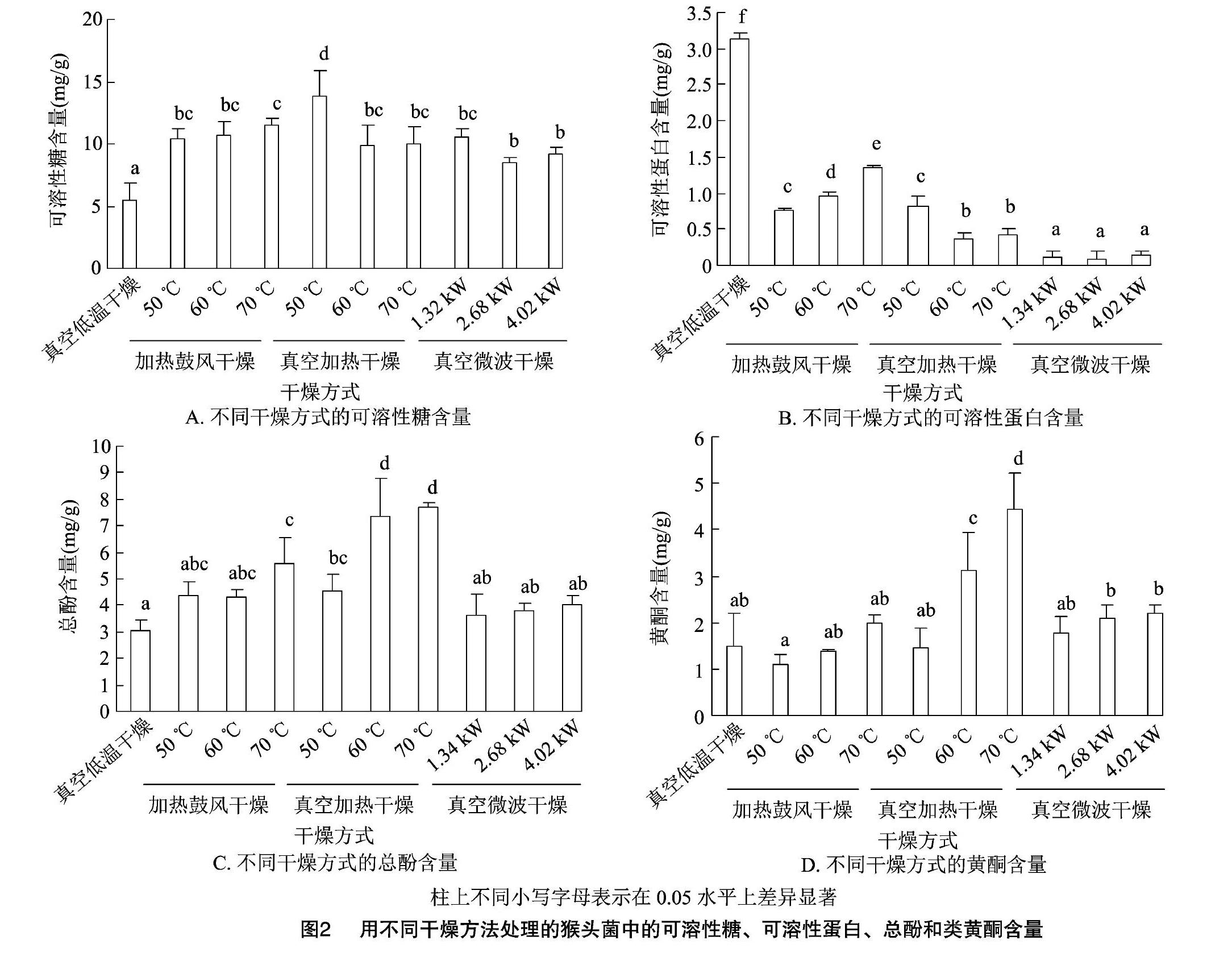
猴头菌经干燥处理后的可溶性糖、可溶性蛋白、总酚和黄酮含量见图2。经过不同干燥方式处理后样品中真空低温干燥处理的样品中可溶性糖含量显著低于其他处理,为(5.54±1.26) mg/g。50 ℃真空加热干燥处理的样品中可溶性糖含量显著高于其他处理,为(13.77±2.05) mg/g。其次为70 ℃加热鼓风干燥处理的样品,其可溶性糖含量为(11.49±0.55) mg/g。其他干燥方式处理的样品中可溶性糖含量差异不显著(图2-A)。
经过不同干燥方式处理后样品中可溶性蛋白含量由高到低依次为真空低温干燥、加热鼓风干燥、真空加热干燥、真空微波干燥。其中真空低温干燥处理的样品中可溶性蛋白含量显著较高,为(3.14±0.07) mg/g,微波功率为2.68 kW真空微波干燥处理的样品中可溶性蛋白含量最低,为(009±0.10) mg/g。这可能是干燥处理温度与有氧条件不同造成的。适宜的温度能促进蛋白质的酶解,过高的温度造成蛋白质的变性,而氧气的存在促进了蛋白质的氧化水解(图2-B)。
经过60 ℃与70 ℃真空加热干燥处理的猴头菌的总酚含量显著高于通过其他干燥处理方式处理的样品。经过不同干燥处理后真空低温干燥处理的样品中总酚含量最低,为(3.06±0.41)mg/g。这可能是由于低温真空干燥处理相较于其他处理方式耗时最长,且近一半时间处于-80 ℃冰箱内,因长时间氧化造成。真空加热干燥处理的样品总酚含量较高,其中70 ℃真空加热干燥处理的样品中总酚含量最高,为(7.72±0.18) mg/g。笔者发现总酚含量整体上随干燥温度的升高而升高。这可能是由于温度越高干燥速率越快,酚类物质在干燥过程中被氧化等消耗的越少,继而含量越高。同样笔者发现,真空干燥处理相较于非真空干燥处理总酚含量较高。这可能是因为真空干燥处理相较于非真空干燥处理其所含酚类物质在干燥过程中被氧化的量较少[12],因此真空干燥这一条件有利于酚类物质的保存。笔者还发现真空微波干燥处理总酚含量相对较低。这可能是由于真空微波干燥处理干燥效果不佳,后经真空状态50 ℃干燥处理,必然造成酚类物质的损耗(图2-C)。
经过60 ℃与70 ℃真空加热干燥处理的样品其黄酮含量显著高于通过其他干燥处理方式处理的样品,黄酮含量分别为(3.11±084)、(4.44±076) mg/g。50 ℃加热鼓风干燥处理的样品其黄酮含量最低,为(1.12±0.19) mg/g。笔者发现黄酮含量随干燥温度的升高而升高。这可能是由于温度越高干燥速率越快,黄酮类物质在干燥过程中消耗的越少,继而含量越高。同时真空干燥处理相较于非真空干燥处理黄酮含量相对较高。这可能是由于黄酮类物质具有抗氧化作用[13],其可作用于自由基或自由基前体,在处理过程中由于氧化作用的存在导致黄酮类物质的消耗,继而造成真空干燥处理相较于非真空干燥处理黄酮量相对较高的现象(图2-D)。
2.3 干燥处理后水提物抗氧化能力的比较
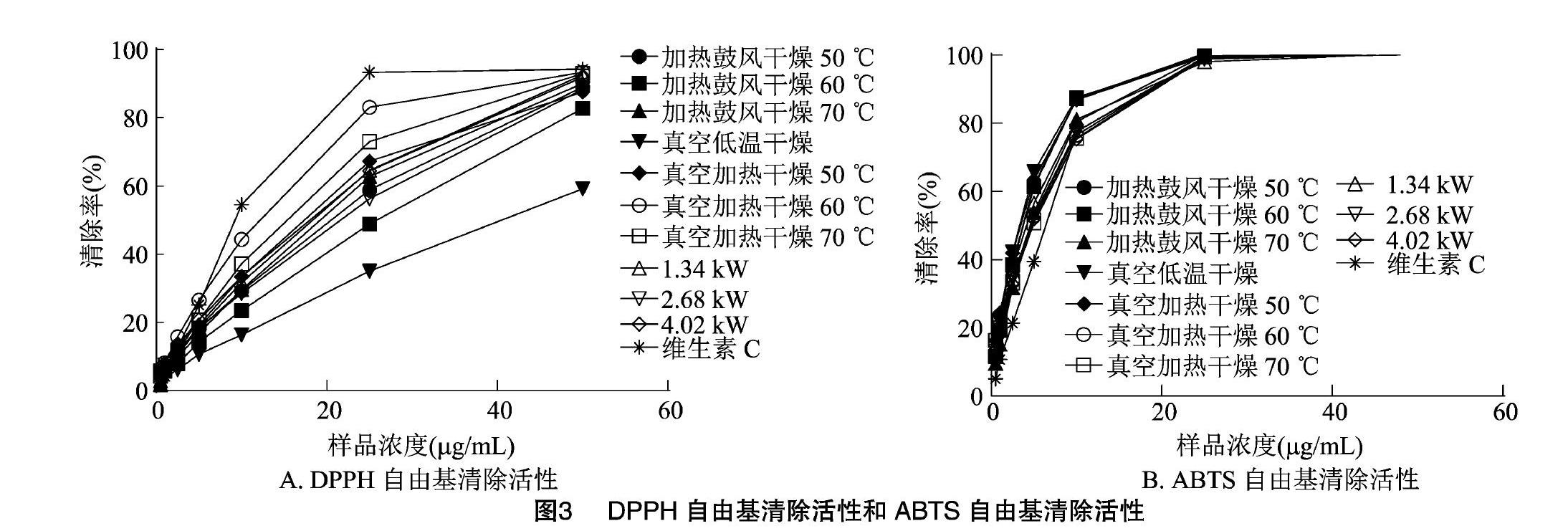
通过DPPH自由基清除试验和ABTS自由基清除试验,分析不同干燥方式对干燥处理后水提物体外抗氧化活性的影响。利用Prism 6.0 软件分析得出不同干燥方式处理后水提物体外抗氧化活性的半最大效应浓度(EC50),通过比较EC50的差异进而评价不同干燥方式对处理后水提物体外抗氧化活性的影响。自由基清除活性见图3、表1。
作为阳性对照,浓度为50 μg/mL时维生素C对DPPH自由基清除率可达到94.29%,DPPH自由基清除率随着水提物浓度的增加而增加。如表1所示,真空低温干燥处理的猴头菌水提物的DPPH自由基清除率较低,其EC50为(40.59±6.63) μg/mL,其次是60 ℃加热鼓风干燥组,其EC50为(22.08±3.38) μg/mL。60 ℃真空加热干燥组的猴头菌水提物的DPPH自由基清除率较高,其EC50为(10.13±165) μg/mL。结合图3与表1,其他样品对DPPH自由基的清除率均低于维生素C。
浓度为25 μg/mL时维生素C对ABTS自由基清除率接近100%,且不同干燥方式处理的猴头菌水提液对ABTS自由基清除率较维生素C相对较高。浓度为0~25 μg/mL时,水提物对ABTS自由基清除活性随着浓度的增加而增强。当浓度大于25 μg/mL时,ABTS自由基的清除率基本保持不变,这说明此时ABTS自由基基本已清除完全。由图3和表1可知,不同干燥方式处理的猴头菌其水提液的EC50值略微差异,EC50值在(2.84±0.59)~(4.11±0.95) μg/mL之间,50 ℃真空加热干燥组的EC50值最小,对ABTS自由基清除活性最高。综上所述用不同干燥方式处理的猴头菌其水提液都具有很强的ABTS自由基清除能力。
2.4 相关性分析
通过对比不同干燥方式处理的猴头菌水提液的自由基清除活性(EC50值)与可溶性糖、可溶性蛋白、总酚和黄酮含量的相关性,确定影响其水提液自由基清除活性的相关因素。相关性分析见表2,猴頭菌水提液对DPPH自由基清除活性的EC50值与样品可溶性糖和总酚含量在0.01水平上显著负相关,与黄酮含量在0.05水平上显著负相关,而与可溶性蛋白含量在0.01水平上显著正相关。这表明,猴头菌水提液对DPPH自由基清除活性随着可溶性糖、总酚和黄酮含量的增加而增强,但随着可溶性蛋白含量的增加,猴头菌水提液对DPPH自由基清除活性显著下降,但对于ABTS自由基的清除活性显著提高。
3 结论与讨论
采自黑龙江省海林市土砬子村的猴头菌鲜样分别经过加热鼓风干燥、真空低温干燥、真空加热干燥以及真空微波干燥处理后制备成猴头菌水提液。利用紫外-可见分光光度法定量分析比较经过各种干燥处理后猴头菌干燥样品水提液中可溶性糖、可溶性蛋白、总酚及黄酮的含量。其中,真空低温干燥处理的样品中可溶性糖含量显著低于其他处理,50 ℃真空加热干燥处理的样品中可溶性糖含量显著高于其他处理;可溶性蛋白含量由高到低依次是真空低温干燥、加热鼓风干燥、真空加热干燥与真空微波干燥。60 ℃与70 ℃真空加热干燥处理的猴头菌总酚含量显著高于通过其他干燥处理方式处理的样品,真空低温干燥处理的样品中总酚含量最低;60 ℃与70 ℃真空加热干燥处理的样品的黄酮含量显著高于通过其他干燥处理方式处理的样品,50 ℃鼓风加热干燥处理的样品其黄酮含量最低。
通过各种干燥处理后,测定猴头菇干燥样品水提取液的自由基清除能力,比较经过不同干燥处理后猴头菌样品的抗氧化能力。其中60 ℃真空加热干燥的猴头菌水提物的DPPH自由基清除率明显较高,但是所有干燥处理样品的DPPH自由基清除能力均弱于维生素C。经过不同干燥方式处理的猴头菌样品的水提液对ABTS自由基清除率较维生素C均较高。通过对DPPH自由基清除活性与ABTS自由基清除活性与样品中可溶性糖、蛋白、总酚及黄酮含量进行相关性分析,发现猴头菌水提液DPPH自由基清除活性与样品的可溶性糖、总酚及黄酮含量具有显著负相关性,与可溶性蛋白含量具有显著正相关性;猴头菌水提液ABTS自由基清除活性与样品可溶性蛋白含量具有显著负相关性。
参考文献:
[1]谭佳媛,王栩俊,王星丽,等. 猴头菇的养生保健价值. 食药用菌,2015,23(3):183-193.
[2]于立坚,杨世勇. 自由基与肿瘤. 国外医学(肿瘤学分册),1981(3):97-99.
[3]李 云. 综述自由基对人体健康的影响及目前的预防措施. 内蒙古石油化工,2011,37(1):87-89.
[4]陈 础, 徐学峥. 氧自由基对心肌细胞的损伤作用. 浙江医科大学学报,1988,17(1):37-40.
[5]胡斌杰,师兆忠. 超声法提取猴头菇多糖最佳工艺优化研究. 化学世界,2009,50(9):557-560.
[6]何幼莺. 生物化学实验. 武汉:华中师范大学出版社,2006.
[7]Vieira P A F,Gontijo D C,Vieira B C,et al. Antioxidant activities,total phenolics and metal contents in Pleurotus ostreatusmushrooms enriched with iron,zinc or lithium. LWT-Food Science and Technology,2013,54(2):421-425.
[8]李利华. 香菇总黄酮的超声波辅助提取及抗氧化性能研究. 中国食品添加剂,2015(11):90-94.
[9]Liu J,Jia L,Kan J,et al. In vitroand in vivoantioxidant activity of ethanolic extract of white button mushroom (Agaricus bisporus) . Food and Chemical Toxicology,2013,51:310-316.
[10]Abul Hasnat M,Pervin M,Debnath T,et al. DNA protection,total phenolics and antioxidant potential of the mushroom Russula virescens. Journal of Food Biochemistry,2014,38(1):6-17.
[11]杜 冉,郑新雷,王世雄,等. 真空微波干燥技术对食用菌粉品质的影响. 食品科技,2018,43(7):76-82.
[12]沈恒胜,陈君琛,汤葆莎,等. 栽培料纤维转化与食用菌酚类抗氧化营养的关系. 福建农业学报,2007,22(4):337-340.
[13]缪钱江,刘 宇,许 峰,等. 4种食用菌总黄酮生物功能的研究. 食品科技,2014,39(7):206-209.
