芦荟大黄素-吲哚偶联物的合成及抗肿瘤活性研究
2021-04-22原凤蕉李晓雪李凌宇宋艳玲邹忠梅
原凤蕉,李晓雪,尚 海,李凌宇,宋艳玲,邹忠梅*
芦荟大黄素-吲哚偶联物的合成及抗肿瘤活性研究
原凤蕉1, 2,李晓雪2, 3,尚 海2,李凌宇2,宋艳玲1*,邹忠梅2, 3*
1. 沈阳化工大学制药与生物工程学院,辽宁 沈阳 110142 2. 中国医学科学院 北京协和医学院药用植物研究所,北京 100193 3. 沈阳药科大学中药学院,辽宁 沈阳 110016
合成芦荟大黄素-吲哚偶联物,并对偶联物进行体外抗肿瘤活性评价。以芦荟大黄素为起始原料,通过溴代、叠氮化、click反应等得到目标化合物,采用噻唑蓝(MTT)法考察所合成的目标化合物对人乳腺癌MCF-7细胞、人肝癌HepG2细胞和人胃腺癌AGS细胞等多种肿瘤细胞的体外抗增殖活性。合成了17个芦荟大黄素衍生物,其结构经1H-NMR、13C-NMR及HRMS确定。活性测试结果表明,部分衍生物表现出良好的抗肿瘤活性。其中,化合物5h对人乳腺癌MCF-7细胞和人卵巢癌SKOV3细胞2种肿瘤细胞表现出明显的抗增殖活性,半数抑制浓度(IC50)值分别为1.73、3.09 μmol/L,且活性优于阳性对照药依托泊苷。部分芦荟大黄素-吲哚偶联物表现出良好的抗肿瘤活性,化合物5h具有进一步研究价值。
芦荟大黄素;吲哚;结构修饰;抗肿瘤活性;构效关系
大黄为寥科植物掌叶大黄L.、唐古特大黄Maxim ex Balf.或药用大黄Baill.的干燥根和根茎,是我国传统的中药之一。大黄性味苦寒,归脾、胃、大肠、肝、心包经。《中国药典》2015年版记载大黄具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄等功效,常用于治疗实热积滞便秘、血热吐魈、目赤咽肿、痈肿疔疮、肠痈腹痛、瘀血经闭、跌打损伤、湿热痢疾、黄疸尿赤等症。大黄的化学成分研究表明,其主要包括蒽醌类、蒽酮类、二苯乙烯类、苯丁酮类等成分,蒽醌类是大黄的主要特征成分,也是其药理作用成分[1-2]。其中,芦荟大黄素作为蒽醌类成分的代表性化合物,因其广泛的药理活性和较低的毒副作用而备受关注。研究表明芦荟大黄素具有抗肿瘤、抗病毒、抗炎、抗菌、保肝、免疫调节等多种药理活性[3-12]。尤其是抗肿瘤活性,已成为芦荟大黄素生物活性研究的热点方向之一[13-15]。
吲哚作为一类结构独特的含氮杂环,其广泛存在于天然产物和生物活性分子中,并表现出多种药理作用[16-22]。其中,抗肿瘤活性是吲哚类化合物最具代表性的药理作用之一,许多含有吲哚结构的天然产物和药物分子都表现出显著的抗肿瘤作用,如长春碱、长春新碱、盐酸安罗替尼等。由于吲哚结构在抗肿瘤方面表现出的优势,其已广泛应用于抗肿瘤药物设计中。如Hu等[23]采用分子杂交策略,将青蒿素与吲哚偶联,合成得到的青蒿素-吲哚偶联物显示出比母体化合物青蒿素更好的抗肿瘤作用。Li等[24]同样采用上述策略,合成了一系列槐定碱-吲哚偶联物,抗肿瘤活性评价证明,偶联物对多个肿瘤细胞株表现出明显的抗肿瘤作用,且活性远优于槐定碱。可见在进行抗肿瘤药物设计时,引入吲哚骨架结构是提升原有化合物抗肿瘤活性,获得活性更优化合物的有效策略之一。
基于吲哚在抗肿瘤化合物中的独特优势,本实验运用药物设计的拼合原理,将吲哚片段引入到芦荟大黄素结构中,合成了17个未见文献报道的芦荟大黄素-吲哚偶联物,其结构均经1H-NMR、13C-NMR和HRMS确证,合成路线见图1。并通过体外抗肿瘤活性筛选模型,测试了偶联物对人乳腺癌MCF-7细胞、人肝癌HepG2细胞和人胃腺癌AGS细胞等多种肿瘤细胞的体外抗增殖活性。
1 仪器与试剂
Bruker AV III 600核磁共振仪(北京布鲁克科技有限公司);Waters SYNAPT G2 HDMS高分辨质谱仪(上海沃特世科技有限公司);薄层色谱板GF254(烟台化工厂);快速柱色谱用硅胶(200~300目,青岛海洋化工厂);IKA RCT basic磁力搅拌器(德国艾卡仪器设备有限公司);EYELA-N1100旋转蒸发仪(东京理化器械株式会社);DLSB-5/20型低温冷却液循环泵(郑州长城科工贸有限公司);DHJF-4002低温恒温搅拌反应浴(郑州长城科工贸有限公司);SHB-III循环水式多用真空泵(北京信诺凯科技有限公司);DZF-6050型真空干燥箱(北京陆希科技有限公司)。
芦荟大黄素(质量分数98%,批号A56737)、四溴化碳(质量分数98%,批号A62601)、叠氮化钠(质量分数98%)、吲哚(质量分数99%,批号A02268)、4-甲基吲哚(质量分数98%,批号A22097)、噻吩-2-甲酸亚铜(质量分数98%,批号A35823)均购于北京伊诺凯科技有限公司;三苯基磷(质量分数98%,批号01005575)、3-溴丙炔(质量分数98%,批号01012761)、氢化钠(质量分数60%,批号01006693)、7-甲基吲哚(质量分数98%,批号01007469)、6-氟吲哚(质量分数97%,批号01004150)、6-溴吲哚(质量分数97%,批号01004891)、4-甲氧基吲哚(质量分数98%,批号1004600)、4-硝基吲哚(质量分数97%,批号1004584)、5-溴吲哚(质量分数97%,批号01000352)、5-氯吲哚(质量分数97%,批号1002294)、6-硝基吲哚(质量分数97%,批号01009719)、5-硝基吲哚(质量分数97%,批号1005699)均购自北京偶合科技有限公司;6-甲氧基吲哚(质量分数98%,批号M123429)、2-甲基吲哚(质量分数98%,批号M100903)、7-硝基吲哚(质量分数99%,批号N111468)、7-氮杂吲哚(质量分数98%,批号A124841)、5-氰基吲哚(质量分数99%,批号C101133)、5, 6-二氯吲哚(质量分数98%,批号D155109),二甲亚砜(DMSO,质量分数99.9%,批号D103277)均购于上海阿拉丁生化科技股份有限公司;其余试剂均为分析纯,购于北京通广精细化工有限公司。MCF-7细胞、HepG2细胞、AGS细胞、SKOV3细胞、HeLa细胞、A549细胞和MGC-803细胞株均购自中国医学科学院基础医学研究所细胞资源中心;噻唑蓝(MTT)购于Amresco公司。
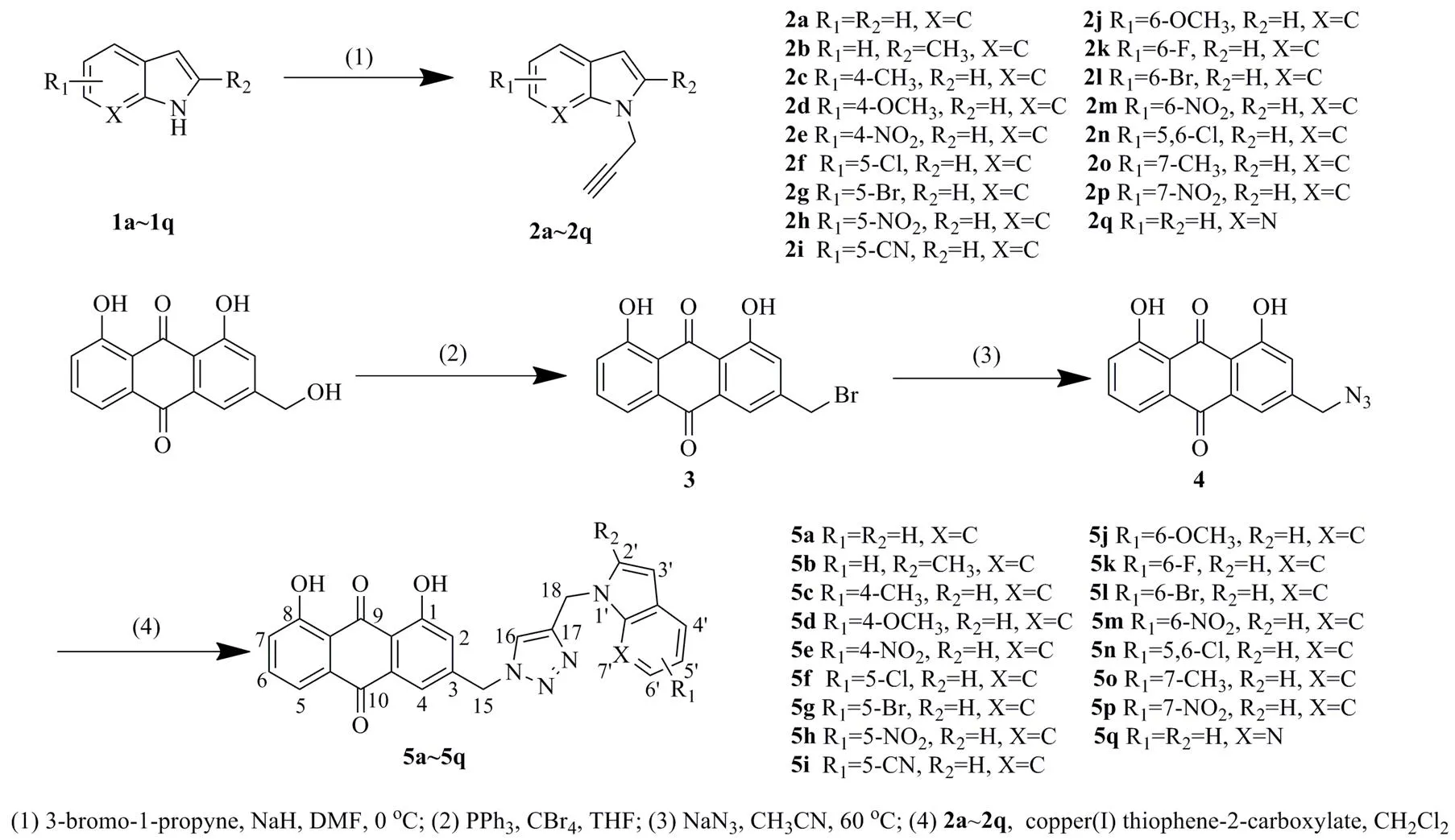
图1 目标化合物5a~5q的合成路线
2 合成实验方法
以吲哚1a或取代吲哚1b~1q为起始原料,在碱性条件下经-烷基化反应得中间体2a~2q。以芦荟大黄素为起始原料,在三苯基磷和四溴化碳的条件下进行溴代反应,得中间体3。接着与叠氮化钠反应得到叠氮化合物4。最后,化合物4与中间体2a~2q在噻吩-2-甲酸亚铜催化条件下进行click反应得目标化合物5a~5q。
2.1 取代1-炔丙基吲哚的合成
2.1.1 1-炔丙基吲哚(2a)的合成 将吲哚(300 mg,2.56 mmol)溶于,-二甲基甲酰胺(5 mL)中,0 ℃加入氢化钠(148 mg,6.17 mmol),加毕,0 ℃下反应30 min。将3-溴丙炔(365 mg,3.07 mmol)加入反应液中,加毕,室温反应30 min。TLC检测反应完全后,停止反应,加水(50 mL),醋酸乙酯(50 mL×3)萃取,合并有机相,无水硫酸钠干燥,滤过,浓缩,硅胶柱色谱纯化,流动相为石油醚-醋酸乙酯(30∶1),得白色固体化合物2a,收率为50.5%。
2.1.2 1-炔丙基-2-甲基吲哚(2b)的合成 以2-甲基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得浅红色固体化合物2b,收率为58.2%。
2.1.3 1-炔丙基-4-甲基吲哚(2c)的合成 以4-甲基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得棕色固体化合物2c,收率为67.1%。
2.1.4 1-炔丙基-4-甲氧基吲哚(2d)的合成 以4-甲氧基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得灰白色固体化合物2d,收率为69.6%。
2.1.5 1-炔丙基-4-硝基吲哚(2e)的合成 以4-硝基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得黄色固体化合物2e,收率为71.4%。
2.1.6 1-炔丙基-5-氯吲哚(2f)的合成 以5-氯吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得白色固体化合物2f,收率为50.0%。
2.1.7 1-炔丙基-5-溴吲哚(2g)的合成 以5-溴吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得白色固体化合物2g,收率为78.3%。
2.1.8 1-炔丙基-5-硝基吲哚(2h)的合成 以5-硝基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得黄色固体化合物2h,收率为30.2%。
2.1.9 1-炔丙基-5-氰基吲哚(2i)的合成 以5-氰基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得白色固体化合物2i,收率为41.7%。
2.1.10 1-炔丙基-6-甲氧基吲哚(2j)的合成 以6-甲氧基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得白色固体化合物2j,收率为63.6%。
2.1.11 1-炔丙基-6-氟吲哚(2k)的合成 以6-氟吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得浅棕色固体化合物2k,收率为61.5%。
2.1.12 1-炔丙基-6-溴吲哚(2l)的合成 以6-溴吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得棕色固体化合物2l,收率为50.8%。
2.1.13 1-炔丙基-6-硝基吲哚(2m)的合成 以6-硝基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得黄色固体化合物2m,收率为84.4%。
2.1.14 1-炔丙基-5,6-二氯吲哚(2n)的合成 以5,6-二氯吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得白色固体化合物2n,收率为77.3%。
2.1.15 1-炔丙基-7-甲基吲哚(2o)的合成 以7-甲基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得灰色固体化合物2o,收率为75.5%。
2.1.16 1-炔丙基-7-硝基吲哚(2p)的合成 以7-硝基吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得黄色固体化合物2p,收率为75.2%。
2.1.17 1-炔丙基-7-氮杂吲哚(2q)的合成 以7-氮杂吲哚和3-溴丙炔为原料,操作方法同“2.1.1”项化合物2a的合成,得棕色固体化合物2q,收率为79.3%。
2.2 3-(溴甲基)-1,8-二羟基蒽-9,10-二酮(3)的合成
将三苯基磷(12.13 g,46.25 mmol)溶于四氢呋喃(400 mL)中,分批将四溴化碳(15.34 g,46.25 mmol)加入反应液中,加毕,室温反应10 min。将芦荟大黄素(5.0 g,18.5 mmol)加入反应液中,加毕,室温反应6 h。TLC监测反应完全,停止反应,抽滤,滤饼用少量四氢呋喃洗涤,浓缩滤液,硅胶柱色谱纯化,流动相石油醚-二氯甲烷(1∶1),得黄色固体5.83 g,收率94.6%。1H-NMR (600 MHz, DMSO-6): 11.92 (1H, s, OH-8), 11.91 (1H, s, OH-1), 7.82 (1H, dd,= 8.3, 7.5 Hz, H-6), 7.78 (1H, d,= 1.7 Hz, H-4), 7.72 (1H, dd,= 7.5, 1.1 Hz, H-5), 7.47 (1H, d,= 1.7 Hz, H-2), 7.40 (1H, dd,= 8.3, 1.1 Hz, H-7), 4.82 (2H, s, CH2-15)。
2.3 3-(叠氮基甲基)-1,8-二羟基蒽-9,10-二酮(4)的合成
将化合物3(500 mg,1.5 mmol)、叠氮化钠(117 mg,1.8 mmol)依次溶于乙腈(10 mL)中,加热至60 ℃反应3 h。TLC监测反应完全,停止反应,冷却至室温,加水(50 mL),二氯甲烷(50 mL×3)萃取,合并有机相,无水硫酸钠干燥,滤过,浓缩,硅胶柱色谱纯化,流动相石油醚-二氯甲烷(1∶1),得黄色固体374.6 mg,收率84.6%。1H-NMR (600 MHz, DMSO-6): 11.92 (1H, s, 8-OH), 11.91 (1H, s, 1-OH), 7.82 (1H, dd,= 8.4 Hz, 7.4 Hz, H-6), 7.71 (1H, dd,= 7.4, 1.1 Hz, H-5), 7.68 (1H, d,= 1.6 Hz, H-4), 7.39 (1H, dd,= 8.4, 1.1 Hz, H-7), 7.35 (1H, d,= 1.6 Hz, H-2), 4.68 (2H, s, CH2-15)。
2.4 目标化合物5a~5q的合成
2.4.1 化合物5a的合成 将化合物4(50 mg,0.17 mmol)溶于二氯甲烷(10 mL)中,待溶解后加入化合物2a(41 mg,0.19 mmol)和噻吩-2-甲酸亚铜(13 mg,0.068 mmol),室温搅拌6 h。TLC检测反应完全后,停止反应,浓缩反应液,残留物硅胶柱色谱纯化,流动相二氯甲烷-甲醇(50∶1),得黄色固体化合物5a,收率84.4%。mp 188.9~190.4 ℃;1H-NMR (600 MHz, DMSO-6): 11.90~11.81 (2H, m, 1, 8-OH), 8.18 (1H, s, H-16), 7.77 (1H, dd,= 8.3, 7.1 Hz, H-6), 7.67 (1H, d,= 7.1 Hz, H-5), 7.56 (1H, d,= 8.2 Hz, H-7′), 7.53 (1H, d,= 1.2 Hz, H-4), 7.52 (1H, d,= 7.9 Hz, H-4′), 7.45 (1H, d,= 3.1 Hz, H-2′), 7.36 (1H, d,= 8.3 Hz, H-7), 7.18 (1H, d,= 0.8 Hz, H-2),7.12 (1H, t,= 7.4 Hz, H-6′), 7.00 (1H, dd,= 7.4, 7.3 Hz, H-5′), 6.43 (1H, d,= 2.9 Hz, H-3′), 5.71 (2H, s, CH2-15), 5.49 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 144.2, 137.4, 135.5, 133.7, 133.2, 128.6, 128.2, 124.5, 123.9, 122.8, 121.1, 120.4, 119.4, 119.1, 118.2, 115.9, 115.6, 110.0, 101.0, 51.9, 40.8;HRMS/: 451.140 5,计算值451.140 6,C26H19N4O4[M+H]+。
2.4.2 化合物5b的合成 以化合物4和化合物2b为原料,操作方法同化合物5a的合成,得黄色固体化合物5b,收率96.0%。mp 129.7~131.4 ℃;1H-NMR (600 MHz, DMSO-6): 11.90~11.83 (2H, m, 1, 8-OH), 8.17 (1H, s, H-16), 7.77 (1H, dd,= 8.3, 7.5 Hz, H-6), 7.67 (1H, dd,= 7.5, 1.0 Hz, H-5), 7.53~7.50 (2H, m, H-4, 4′), 7.39 (1H, d,= 7.7 Hz, H-7′), 7.36 (1H, dd,= 8.3, 1.0 Hz, H-7), 7.17 (1H, d,= 1.4 Hz, H-2), 7.03 (1H, ddd,= 8.1, 7.5, 1.0 Hz, H-6′), 6.94 (1H, ddd,= 8.1, 7.3, 0.8 Hz, H-5′), 6.20 (1H, s, H-3′), 5.69 (2H, s, CH2-15), 5.43 (2H, s, CH2-18), 2.51 (3H, s, CH3-2′);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 144.4, 137.5, 136.6, 136.2, 133.7, 133.2, 127.7, 124.5, 123.8, 122.8, 120.2, 119.4, 119.2, 119.1, 118.2, 115.9, 115.6, 109.6, 99.9, 51.9, 37.8, 12.6;HRMS: 465.156 3,计算值465.156 3,C27H21N4O4[M+H]+。
2.4.3 化合物5c的合成 以化合物4和化合物2c为原料,操作方法同化合物5a的合成,得黄色固体化合物5c,收率97.8%。mp 159.3~161.2 ℃;1H-NMR (600 MHz, DMSO-6): 11.86 (1H, s, OH-8), 11.85 (1H, s, OH-1), 8.15 (1H, s, H-16), 7.76 (1H, dd,= 8.4, 7.4 Hz, H-6), 7.66 (1H, dd,= 7.4, 0.7 Hz, H-5), 7.53 (1H, d,= 1.4 Hz, H-4), 7.41 (1H, d,= 3.3 Hz, H-2′), 7.36 (1H, d,= 8.3 Hz, H-7′), 7.35 (1H, dd,= 8.4, 0.8 Hz, H-7), 7.17 (1H, d,=1.2 Hz, H-2), 7.00 (1H, dd,= 8.0, 7.4 Hz, H-6′), 6.79 (1H, d,= 7.1 Hz, H-5′), 6.45 (1H, d,= 2.9 Hz, H-3′), 5.70 (2H, s, CH2-15), 5.47 (2H, s, CH2-18), 2.42 (3H, s, CH3-4′);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 144.4, 137.5, 135.2, 133.7, 133.1, 129.3, 128.1, 128.0, 124.5, 123.9, 122.8, 121.3, 119.4, 119.3, 118.2, 115.9, 115.6, 107.7, 99.6, 51.9, 41.0, 18.4;HRMS/: 465.156 7,计算值465.156 3,C27H21N4O4[M+H]+。
2.4.4 化合物5d的合成 以化合物4和2d为原料,操作方法同化合物5a的合成,得黄色固体化合物5d,收率95.9%。mp 197.6~199.5 ℃;1H-NMR (600 MHz, DMSO-6): 11.89~11.83 (2H, m, 1, 8-OH), 8.14 (1H, s, H-16), 7.78 (1H, dd,= 8.4, 7.4 Hz, H-6), 7.67 (1H, d,= 7.4 Hz, H-5), 7.54 (1H, s, H-4), 7.36 (1H, d,= 8.4 Hz, H-7), 7.32 (1H, d,= 3.1 Hz, H-2′), 7.18 (1H, s, H-2), 7.15 (1H, d,= 8.2 Hz, H-7′), 7.03 (1H, dd,= 7.9, 7.8 Hz, H-6′), 6.51 (1H, d,= 7.7 Hz, H-5′), 6.42 (1H, d,= 3.0 Hz, H-3′), 5.71 (2H, s, CH2-15), 5.45 (2H, s, CH2-18), 3.83 (3H, s, OCH3-4′);13C-NMR (150 MHz, DMSO-6): 191.5, 181.2, 161.4, 161.3, 152.8, 145.6, 144.3, 137.5, 136.9, 133.7, 133.2, 127.1, 124.5, 123.9, 122.8, 122.2, 119.4, 118.5, 118.2, 115.9, 115.7, 103.5, 99.4, 98.3, 54.9, 51.9, 41.1;HRMS/: 481.151 4,计算值481.151 2,C27H21N4O5[M+H]+。
2.4.5 化合物5e的合成 以化合物4和2e为原料,操作方法同化合物5a的合成,得黄色固体化合物5e,收率89.5%。mp 236.3~238.1℃;1H-NMR (600 MHz, DMSO-6): 12.01~11.74 (2H, m, 1, 8-OH), 8.25 (1H, s, H-16), 8.14 (1H, dd,= 7.9, 2.3 Hz, H-5′), 8.06 (1H, dd,= 7.9, 3.6 Hz, H-7′), 7.90~7.85 (1H, m, H-2′), 7.80~7.73 (1H, m, H-6), 7.68~7.62 (1H, m, H-5), 7.51 (1H, d,= 6.4 Hz, H-4), 7.39~7.31 (2H, m, H-6′, 7), 7.18 (1H, d,= 3.7 Hz, H-2), 7.04 (1H, d,= 3.7 Hz, H-3′), 5.72 (2H, s, CH2-15), 5.66 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 143.6, 139.3, 137.8, 137.5, 134.1, 133.7, 133.2, 124.5, 124.2, 122.9, 121.9, 120.6, 119.4, 118.2, 118.1, 117.3, 115.9, 115.7, 101.1, 52.0, 41.3;HRMS: 496.125 3,计算值496.125 7,C26H18N5O6[M+H]+。
2.4.6 化合物5f的合成 以化合物4和2f为原料,操作方法同化合物5a的合成,得黄色固体化合物5f,收率89.4%。mp 186.1~188.1℃;1H-NMR (600 MHz, DMSO-6): 11.88~11.83 (2H, m, 1, 8-OH), 8.19 (1H, s, H-16), 7.78~7.74 (1H, m, H-6), 7.66 (1H, d,= 7.4 Hz, H-5), 7.59(1H, d,= 8.8 Hz, H-7′), 7.57 (1H, d,= 1.9 Hz, H-4′), 7.54~7.50 (2H, m, H-2′, 4), 7.35 (1H, d,= 8.4 Hz, H-7), 7.18 (1H, s, H-2), 7.11 (1H, dd,= 8.7, 2.0 Hz, H-6′), 6.43 (1H, d,= 3.1 Hz, H-3′), 5.71 (2H, s, CH2-15), 5.51 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 144.0, 137.5, 134.1, 133.7, 133.2, 130.5, 129.4, 124.5, 124.0, 124.0, 122.8, 121.1, 119.6, 119.4, 118.2, 115.9, 115.6, 111.7, 100.9, 52.0, 41.0;HRMS: 485.102 1,计算值485.101 7,C26H18ClN4O4[M+H]+。
2.4.7 化合物5g的合成 以化合物4和2g为原料,操作方法同化合物5a的合成,得黄色固体化合物5g,收率81.2%。mp 189.8~191.3℃;1H-NMR (600 MHz, DMSO-6): 11.88~11.83 (2H, m, 1, 8-OH), 8.19 (1H, s, H-16), 7.78 (1H, dd,= 8.3 Hz, 7.4 Hz, H-6), 7.71 (1H, d,= 1.9 Hz, H-2′), 7.67 (1H, dd,= 7.4 Hz, 0.8 Hz, H-5), 7.55 (1H, d,= 8.7 Hz, H-7′), 7.53 (1H, d,= 1.5 Hz, H-4), 7.51 (1H, d,= 3.1 Hz, H-4′), 7.36 (1H, dd,= 8.3, 0.8 Hz, H-7), 7.23 (1H, dd,= 8.8, 1.9 Hz, H-6′), 7.18 (1H, d,= 1.4 Hz, H-2), 6.43 (1H, d,= 3.0 Hz, H-3′), 5.72 (2H, s, CH2-15), 5.50 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.2, 161.4, 161.3, 145.6, 144.0, 137.5, 134.3, 133.7, 133.2, 130.3, 130.1, 124.5, 124.0, 123.7, 122.8, 122.6, 119.4, 118.2, 115.9, 115.7, 112.2, 111.9, 100.8, 52.0, 41.0;HRMS: 529.050 8,计算值529.051 1,C26H18BrN4O4[M+H]+。
2.4.8 化合物5h的合成 以化合物4和2h为原料,操作方法同化合物5a的合成,得黄色固体化合物5h,收率59.8%。mp 261.8~263.8℃;1H-NMR (600 MHz, DMSO-6): 11.95~11.78 (2H, m, 1, 8-OH), 8.55 (1H, d,= 1.4 Hz, H-4′), 8.26 (1H, s, H-16), 8.02 (1H, dd,= 9.0, 1.7 Hz, H-6′), 7.82~7.75 (2H, m, H-7′, 6), 7.72 (1H, d,= 3.0 Hz, H-2′), 7.67 (1H, d,= 7.4 Hz, H-5), 7.52 (1H, s, H-4), 7.36 (1H, d,= 8.4 Hz, H-7), 7.19 (1H, s, H-2), 6.76 (1H, d,= 2.8 Hz, H-3′), 5.73 (2H, s, CH2-15), 5.61 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.2, 161.4, 161.3, 145.6, 143.5, 140.9, 138.5, 137.5, 133.8, 133.3, 132.6, 127.6, 124.6, 124.2, 122.9, 119.4, 118.2, 117.6, 116.6, 116.0, 115.7, 110.8, 104.1, 52.0, 41.3;HRMS: 496.125 6,计算值496.125 7,C26H18N5O6[M+H]+。
2.4.9 化合物5i的合成 以化合物4和化合物2i为原料,操作方法同化合物5a的合成,得黄色固体化合物5i,收率71.4%。mp 263.4~264.8℃;1H- NMR (600 MHz, DMSO-6): 11.89~11.84 (2H, m, 1, 8-OH), 8.24 (1H, s, H-16), 8.08 (1H, s, H-4′), 7.81~7.77 (2H, m, H-6, 7′), 7.68 (1H, d,= 7.5 Hz, H-5), 7.67 (1H, d,= 3.4 Hz, H-2′), 7.53 (1H, d,= 1.1 Hz, H-4), 7.49 (1H, dd,= 8.5, 1.1 Hz, H-6′), 7.37 (1H, d,= 8.3 Hz, H-7), 7.19 (1H, s, H-2), 6.61 (1H, d,= 3.1 Hz, H-3′), 5.73 (2H, s, CH2-15), 5.59 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6)191.5, 181.2, 161.4, 161.3, 145.6, 143.7, 137.5, 137.2, 133.8, 133.3, 131.5, 128.0, 126.1, 124.6, 124.1, 124.0, 122.9, 120.6, 119.4, 118.2, 116.0, 115.7, 111.6, 102.3, 101.4, 52.0, 41.0;HRMS: 476.135 7,计算值476.135 9,C27H18N5O4[M+H]+。
2.4.10 化合物5j的合成 以化合物4和2j为原料,操作方法同化合物5a的合成,得黄色固体化合物5j,收率93.4%。mp 149.3~150.4℃;1H-NMR (600 MHz, DMSO-6)11.88~11.83 (2H, m, 1, 8-OH), 8.17 (1H, s, H-16), 7.76 (1H, dd,= 8.4, 7.5 Hz, H-6), 7.66 (1H, d,= 7.5 Hz, H-5), 7.53 (1H, s, H-4), 7.37 (1H, d,= 8.5 Hz, H-4′), 7.35 (1H, d,= 8.4 Hz, H-7), 7.28 (1H, d,= 3.2 Hz, H-2′), 7.18 (1H, s, H-2), 7.10 (1H, d,= 1.7 Hz, H-7′), 6.65 (1H, dd,= 8.5, 2.2 Hz, H-5′), 6.34 (1H, d,= 3.0 Hz, H-3′), 5.72 (2H, s, CH2-15), 5.44 (2H, s, CH2-18), 3.75 (3H, s, 6′-OCH3);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 155.6, 145.7, 144.3, 137.5, 136.4, 133.7, 133.2, 127.4, 124.5, 123.9, 122.8, 122.3, 121.0, 119.4, 118.2, 115.9, 115.6, 109.2, 101.1, 93.6, 55.3, 52.0, 40.8;HRMS: 481.150 9,计算值481.151 2, C27H21N4O5[M+H]+。
2.4.11 化合物5k的合成 以化合物4和2k为原料,操作方法同化合物5a的合成,得黄色固体化合物5k,收率95.1%。mp 205.9~207.3℃;1H-NMR (600 MHz, DMSO-6): 11.94~11.79 (2H, m, 1, 8-OH), 8.22 (1H, s, H-16), 7.77 (1H, dd,= 8.3 Hz, 7.5 Hz, H-6), 7.67 (1H, d,= 7.5 Hz, H-5), 7.54 (1H, d,= 1.1 Hz, H-4), 7.51 (1H, dd,= 8.6, 5.5 Hz, H-4′), 7.45 (1H, dd,= 10.5, 2.0 Hz, H-5′), 7.44 (1H, d,= 3.2 Hz, H-2′), 7.36 (1H, d,= 8.3 Hz, H-7), 7.19(1H, s, H-2), 6.88~6.84 (1H, m, H-7′), 6.45 (1H, d,= 2.9 Hz, H-3′), 5.72 (2H, s, CH2-15), 5.47 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.2, 161.4, 161.3, 158.7 (d,= 234.6 Hz), 145.6, 143.9, 137.5, 135.6 (d,= 12.8 Hz), 133.7, 133.2, 129.4 (d,= 3.3 Hz), 124.9, 124.5, 124.0, 122.9, 121.5 (d,= 10.3 Hz), 119.4, 118.3, 115.9, 115.7, 107.7 (d,= 24.4 Hz), 101.4, 96.7 (d,= 26.4 Hz), 52.0, 40.8;HRMS: 469.131 1,计算值469.131 2,C26H18FN4O4[M+H]+。
2.4.12 化合物5l的合成 以化合物4和2l为原料,操作方法同化合物5a的合成,得黄色固体化合物5l,收率83.8%。mp 144.3~145.7℃;1H-NMR (600 MHz, DMSO-6): 11.87 (1H, s, 8-OH), 11.86 (1H, s, 1-OH), 8.21 (1H, s, H-16), 7.85 (1H, s, H-7′), 7.77 (1H, dd,= 8.3, 7.3 Hz, H-6), 7.67 (1H, d,= 7.3 Hz, H-5), 7.54 (1H, s, H-4), 7.48 (1H, d,= 8.5 Hz, H-5′), 7.47 (1H, d,= 3.1 Hz, H-2′), 7.36 (1H, d,= 8.3 Hz, H-7), 7.20 (1H, s, H-2), 7.12 (1H, dd,= 8.3, 1.3 Hz, H-4′), 6.46 (1H, d,= 2.9 Hz, H-3′), 5.73 (2H, s, CH2-15), 5.50 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 144.0, 137.5, 136.5, 133.7, 133.2, 129.7, 127.2, 124.5, 124.0, 122.9, 122.2, 122.1, 119.4, 118.3, 115.9, 115.7, 114.2, 112.9, 101.5, 52.0, 40.8;HRMS: 529.051 3,计算值529.051 1,C26H18BrN4O4[M+H]+。
2.4.13 化合物5m的合成 以化合物4和2m为原料,操作方法同化合物5a的合成,得黄色固体化合物5m,收率83.2%。mp 265.4~267.3℃;1H-NMR (600 MHz, DMSO-6):11.98~11.78 (2H, m, 1, 8-OH), 8.64 (1H, s, H-7′), 8.28 (1H, s, H-16), 7.95~7.84 (2H, m, H-5′, 4′), 7.80 (1H, dd,= 7.9, 6.8 Hz, H-6), 7.73 (1H, d,= 8.5 Hz, H-2′), 7.68 (1H, d,= 6.8 Hz, H-5), 7.52 (1H, s, H-4), 7.38 (1H, d,= 7.9 Hz, H-7), 7.19 (1H, s, H-2), 6.68 (1H, s, H-3′), 5.74 (2H, s, CH2-15), 5.69 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6)191.5, 181.2, 161.4, 161.3, 145.6, 143.6, 142.1, 137.5, 135.4, 134.1, 133.8, 133.2, 124.6, 124.2, 122.8, 120.8, 119.4, 118.2, 116.0, 115.7, 114.4, 107.4, 102.4, 52.0, 41.1;HRMS: 496.125 2,计算值496.125 7,C26H18N5O6[M+H]+。
2.4.14 化合物5n的合成 以化合物4和2n为原料,操作方法同化合物5a的合成,得黄色固体化合物5n,收率96.4%。mp 112.4~114.3℃;1H-NMR (600 MHz, DMSO-6): 11.87~11.83 (2H, m, 1, 8-OH), 8.22 (1H, s, H-16), 7.93 (1H, s, H-4′), 7.79~7.73 (2H, m, H-7′, 6), 7.64 (1H, d,= 7.5 Hz, H-5), 7.56 (1H, d,= 3.1 Hz, H-2′), 7.52 (1H, s, H-4), 7.34 (1H, d,= 8.3 Hz, H-7), 7.18 (1H, s, H-2), 6.45 (1H, d,= 3.1 Hz, H-3′), 5.72 (2H, s, CH2-15), 5.52 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 143.7, 137.5, 134.6, 133.7, 133.2, 131.4, 128.1, 124.5, 124.1, 123.7, 122.9, 121.9, 121.5, 119.4, 118.2, 115.9, 115.6, 112.0, 101.2, 52.0, 40.9;HRMS: 519.062 5,计算值519.062 7,C26H17Cl2N4O4[M+H]+。
2.4.15 化合物5o的合成 以化合物4和2o为原料,操作方法同化合物5a的合成,得黄色固体化合物5o,收率83.5%。mp 195.6~197.3℃;1H- NMR (600 MHz, DMSO-6): 11.87~11.82 (2H, m, 1, 8- OH), 7.97 (1H, s, H-16), 7.77 (1H, dd,= 8.3 Hz, 7.4 Hz, H-6), 7.66 (1H, d,= 7.4 Hz, H-5), 7.50 (1H, s, H-4), 7.39 (1H, d,= 3.2 Hz, H-2′), 7.37~7.33 (2H, m, H-7, H-4′), 7.15(1H, s, H-2), 6.87 (1H, dd,= 7.6, 7.3 Hz, H-5′), 6.82 (1H, d,= 7.0 Hz, H-6′), 6.43 (1H, d,= 3.2 Hz, H-3′), 5.69 (2H, s, CH2-15), 5.68 (2H, s, CH2-18), 2.68 (3H, s, CH3-7′);13C-NMR (150 MHz, DMSO-6)191.5, 181.1, 161.4, 161.3, 146.2, 145.7, 137.5, 134.2, 133.7, 133.2, 130.3, 129.4, 124.5, 124.2, 123.4, 122.7, 120.8, 119.4, 119.4, 118.7, 118.1, 115.9, 115.6, 101.7, 51.9, 43.6, 19.4;HRMS: 465.156 3,计算值465.156 3,C27H21N4O4[M+H]+。
2.4.16 化合物5p的合成 以化合物4和2p为原料,操作方法同化合物5a的合成,得黄色固体化合物5p,收率91.4%。mp 239.4~241.3℃;1H-NMR (600 MHz, DMSO-6): 11.87~11.83 (2H, m, 1, 8-OH), 8.02 (1H, s, H-16), 7.97 (1H, dd,= 7.8, 0.9 Hz, H-6′), 7.79~7.74 (2H, m, H-6, 4′), 7.74 (1H, d,= 3.2 Hz, H-2′), 7.66 (1H, dd,= 7.4, 1.0 Hz, H-5), 7.51 (1H, d,= 1.6 Hz, H-4), 7.35 (1H, dd,= 8.3, 1.0 Hz, H-7), 7.18(1H, dd,= 7.8, 7.7 Hz, H-5′), 7.10 (1H, d,= 1.4 Hz, H-2), 6.77 (1H, d,= 3.2 Hz, H-3′), 5.67 (2H, s, CH2-15), 5.61 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.1, 161.4, 161.3, 145.6, 143.6, 137.5, 136.7, 134.2, 133.8, 133.7, 133.2, 127.4, 125.7, 124.5, 123.7, 122.8, 119.7, 119.4, 119.0, 118.3, 115.9, 115.6, 103.3, 51.9, 44.1;HRMS: 496.125 8,计算值496.125 7,C26H18N5O6[M+H]+。
2.4.17 化合物5q的合成 以化合物4和2q为原料,操作方法同化合物5a的合成,得黄色固体化合物5q,收率95.6%。mp 231.6~232.5℃;1H-NMR (600 MHz, DMSO-6): 11.97~11.81 (2H, m, 1, 8- OH), 8.26 (1H, d,= 2.9 Hz, H-4′), 8.18 (1H, s, H-16), 7.97 (1H, d,= 7.0 Hz, H-6′), 7.80 (1H, dd,= 8.2, 7.0 Hz, H-6), 7.70 (1H, d,= 7.0 Hz, H-5), 7.61 (1H, d,= 3.5 Hz, H-2′), 7.56 (1H, s, H-4), 7.38 (1H, d,= 8.2 Hz, H-7), 7.20 (1H, s, H-2), 7.10 (1H, dd,= 7.3, 4.6 Hz, H-5′), 6.50 (1H, d,= 2.8 Hz, H-3′), 5.72 (2H, s, CH2-15), 5.57 (2H, s, CH2-18);13C-NMR (150 MHz, DMSO-6): 191.5, 181.2, 161.4, 161.3, 146.8, 145.6, 144.3, 142.5, 137.5, 133.8, 133.3, 128.9, 128.7, 124.5, 124.0, 122.9, 120.0, 119.4, 118.3, 116.0, 115.9, 115.7, 99.7, 51.9, 38.9;HRMS: 452.136 1,计算值452.135 9,C25H18N5O4[M+H]+。
3 体外抗肿瘤活性评价
采用MTT法,以依托泊苷为阳性对照药,测试了目标化合物5a~5q在40 μmol/L浓度下对MCF-7细胞、HepG2细胞和AGS细胞3种肿瘤细胞的体外抗肿瘤活性。取对数生长期的上述不同肿瘤细胞接种于96孔细胞板中,每孔7×103个细胞100 μL,在CO2培养箱(37 ℃、5% CO2、相对湿度90%)中培养24 h。弃上清后每孔加入200 μL含40 μmol/L待测物质的培养基,空白组加入等体积的空白培养基,设3个复孔,于CO2培养箱中继续培养48 h。在避光条件下,每孔加入5 mg/mL的MTT溶液(20 μL/孔),在培养箱中继续孵育4 h,弃上清后每孔加入150 μL DMSO。放置于微孔板振荡器上震摇10 min,使甲臢充分溶解之后,使用酶标仪测定492 nm的吸光度()值,按照公式计算目标化合物5a~5q对肿瘤细胞的抑制率,结果见表1。进一步评价了初筛活性优良的化合物5h、5i和5m对MCF-7细胞、HepG2细胞、AGS细胞、SKOV3细胞、HeLa细胞、A549细胞和MGC-803细胞7种肿瘤细胞的抗增殖作用,结果见表2。
抑制率=(空白-给药)/空白
从表1中可以看出,在40 μmol/L浓度下,化合物5h、5i和5m对MCF-7肿瘤细胞株表现出良好的抑制肿瘤细胞增殖作用,活性优于母体化合物芦荟大黄素和阳性对照药依托泊苷。此外,化合物5h在HepG2和AGS肿瘤细胞株上也表现出较好的抑制作用,活性也优于芦荟大黄素。
4 讨论
活性测试结果表明,吲哚上取代基位置和类型对化合物发挥抗肿瘤活性有着重要影响。吲哚5位和6位引入硝基和氰基可明显增强化合物的抗肿瘤活性,且活性优于卤素、甲氧基取代的化合物。而吲哚2、4和7位取代的化合物,无论是连有吸电子的硝基,还是供电子的甲基和甲氧基,其抗肿瘤活性均没有显著提高,且活性低于母体化合物芦荟大黄素。选取了初筛具有良好活性的化合物5h、5i和5m进行了进一步的抗肿瘤活性评价,结果显示化合物5h对7种肿瘤细胞均表现出良好的抗肿瘤活性。其中,化合物5h在MCF-7和SKOV3 2种肿瘤细胞上表现出最好的活性,IC50值分别为(1.73±0.15)、(3.09±0.96)μmol/L,具有进一步的研究价值。此外,化合物5h、5i和5m对MCF-7和SKOV3 2种肿瘤细胞株的抗增殖活性优于其他肿瘤细胞株,说明该类化合物对不同肿瘤细胞的抗增殖作用存在一定选择性。
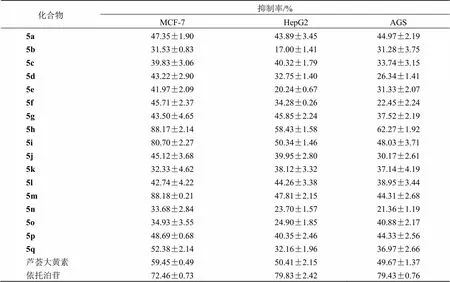
表1 目标化合物5a~5q的体外抗肿瘤活性结果

表2 化合物5h、5i和5m的体外抗肿瘤活性结果
利益冲突 所有作者均声明不存在利益冲突
[1] 金丽霞, 金丽军, 栾仲秋, 等. 大黄的化学成分和药理研究进展 [J]. 中医药信息, 2020, 37(1): 121-126.
[2] 王玉, 杨雪, 夏鹏飞, 等. 大黄化学成分、药理作用研究进展及质量标志物的预测分析 [J]. 中草药, 2019, 50(19): 4821-4837.
[3] Gao R, Wu X W, Huang Z,. Anti-tumor effect of aloe-emodin on cervical cancer cells was associated with human papillomavirus E6/E7 and glucose metabolism [J]., 2019, 12: 3713-3721.
[4] Lin C W, Wu C F, Hsiao N W,. Aloe-emodin is an interferon-inducing agent with antiviral activity against Japanese encephalitis virus and71 [J]., 2008, 32(4): 355-359.
[5] Li S W, Yang T C, Lai C C,. Antiviral activity of aloe-emodin against influenza A virus via galectin-3 up-regulation [J]., 2014, 738: 125-132.
[6] Hu B Y, Zhang H, Meng X L,. Aloe-emodin from rhubarb () inhibits lipopolysaccharide- induced inflammatory responses in RAW264.7macrophages [J]., 2014, 153(3): 846-853.
[7] 李晓红, 齐云, 蔡润兰, 等. 芦荟大黄素对LPS诱导的RAW264.7细胞NO生成及iNOS表达的影响 [J]. 中国药理学通报, 2010, 26(4): 488-492.
[8] Agarwal S K, Singh S S, Verma S,. Antifungal activity of anthraquinone derivatives from[J]., 2000, 72(1/2): 43-46.
[9] Smolarz H D, Swatko-Ossor M, Ginalska G,. Antimycobacterial effect of extract and its components from[J]., 2013, 96(1): 155-160.
[10] Arosio B, Gagliano N, Fusaro L M,. Aloe-emodin quinone pretreatment reduces acute liver injury induced by carbon tetrachloride [J]., 2000, 87(5): 229-233.
[11] Yu C S, Yu F S, Chan J K,. Aloe-emodin affects the levels of cytokines and functions of leukocytes from Sprague-Dawley rats [J]., 2006, 20(4): 505-509.
[12] Tabolacci C, Cordella M, Turcano L,. Aloe-emodin exerts a potent anticancer and immunomodulatory activity on BRAF-mutated human melanoma cells [J]., 2015, 762: 283-292.
[13] Wu Y Y, Zhang J H, Gao J H,. Aloe-emodin (AE) nanoparticles suppresses proliferation and induces apoptosis in human lung squamous carcinoma via ROS generationand[J]., 2017, 490(3): 601-607.
[14] Li Q H, Wen J, Yu K T,. Aloe-emodin induces apoptosis in human oral squamous cell carcinoma SCC15 cells [J]., 2018, 18(1): 1-5.
[15] Dong X, Fu J, Yin X,. Aloe-emodin induces apoptosis in human liver HL-7702 cells through fas death pathway and the mitochondrial pathway by generating reactive oxygen species [J]., 2017, 31(6): 927-936.
[16] Whitfield-Cargile C M, Cohen N D, Chapkin R S,. The microbiota-derived metabolite indole decreases mucosal inflammation and injury in a murine model of NSAID enteropathy [J]., 2016, 7(3): 246-261.
[17] Roaiah H M, Ghannam I A Y, Ali I H,. Design, synthesis, and molecular docking of novel indole scaffold-based VEGFR-2 inhibitors as targeted anticancer agents [J]., 2018, 351(2): 1700299.
[18] Kherkhache H, Benabdelaziz I, Silva A M S,. A new indole alkaloid, antioxidant and antibacterial activities of crude extracts from[J]., 2020, 34(11): 1528-1534.
[19] Konus M, Çetin D, Yılmaz C,. Synthesis, biological evaluation and molecular docking of novel thiophene-based indole derivatives as potential antibacterial, GST inhibitor and apoptotic anticancer agents [J]., 2020, 5(19): 5809-5814.
[20] Wan Y C, Li Y H, Yan C X,. Indole: A privileged scaffold for the design of anti-cancer agents [J]., 2019, 183: 111691.
[21] Dadashpour S, Emami S. Indole in the target-based design of anticancer agents: A versatile scaffold with diverse mechanisms [J]., 2018, 150: 9-29.
[22] Singh T P, Singh O M. Recent progress in biological activities of indole and indole alkaloids [J]., 2018, 18(1): 9-25.
[23] Hu Y P, Li N, Zhang J Y,. Artemisinin-indole and artemisinin-imidazole hybrids: Synthesis, cytotoxic evaluation and reversal effects on multidrug resistance in MCF-7/ADR cells [J]., 2019, 29: 1138-1142.
[24] Li Z, Luo M Y, Cai B,. Design, synthesis, biological evaluation and structure-activity relationship of sophoridine derivatives bearing pyrrole or indole scaffold as potential antitumor agents [J]., 2018, 157: 665-682.
Synthesis and antitumor evaluation of aloe-emodin-indole hybrids
YUAN Feng-jiao1, 2, LI Xiao-xue2, 3, SHANG Hai2, LI Ling-yu2, SONG Yan-ling1, ZOU Zhong-mei2, 3
1. School of Pharmaceutical and Biological Engineering, Shenyang University of Chemical Technology, Shenyang 110142, China 2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China 3. School of Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
To synthesize aloe-emodin-indole hybrids and evaluate the antitumor activities of the derivatives.Taking aloe-emodin as the starting material, the target compound was obtained by bromination reaction, azide reaction and click reaction. The anti-proliferation activity of the synthesized target compounds on MCF-7, HepG2, AGS and other tumor cellswas investigated by MTT method.Seventeen aloe-emodin-indole hybrids were synthesized, and their structures were confirmed by1H-NMR,13C-NMR and HRMS. MTT assay showed that some derivatives exhibited good antitumor activities. Among them, compounds 5h showed the most potent antiproliferative activity against MCF-7 and SKOV3 tumor cells with IC50values of 1.73 μmol/L and 3.09 μmol/L, which was better than that of the positive control drug etoposide.Some derivatives show good antitumor activity, and compound 5h was worth further studying.
aloe emodin; indole; structural modification; antitumor activity; structure-activity relationship
R284.1
A
0253 - 2670(2021)08 - 2217 - 09
10.7501/j.issn.0253-2670.2021.08.004
2020-12-13
国家自然科学基金资助项目(81502929);中国医学科学院医学与健康科技创新工程经费资助(2016-I2M-3-015);辽宁省教育厅基础科研项目(LJ2020025)
原凤蕉(1995—),女,硕士研究生,研究方向为天然产物结构修饰与活性研究。E-mail: 993145843@qq.com
宋艳玲,女,博士,副教授,研究方向为天然产物及其衍生物的活性研究。Tel: 13840387750 E-mail: yanlingsong521@126.com
邹忠梅,女,博士,博士生导师,研究方向为天然产物化学研究。Tel: (010)57833290 E-mail: zmzou@implad.ac.cn
[责任编辑 王文倩]
