关于中药新药复方制剂“整体鉴别”新模式的思考
2021-04-22周跃华路金才宋宗华
周跃华,路金才,周 娟,宋宗华
·专 论·
关于中药新药复方制剂“整体鉴别”新模式的思考
周跃华1,路金才2,周 娟3,宋宗华4
1. 国家药品监督管理局 药品审评中心,北京 100022 2. 沈阳药科大学,辽宁 沈阳 110016 3. 四川省食品药品检验检测院,四川 成都 611731 4. 国家药典委员会,北京 100061
中药新药复方制剂质量标准【鉴别】项设置薄层色谱(thin layer chromatography,TLC)鉴别的目的既是检验制剂是否按规定的处方药味投料,也是反映制剂的整体质量特征进行真伪鉴别。在此基础上,提出中药新药复方制剂质量标准【鉴别】项TLC研究可按“整体鉴别”的新模式开展,并对TLC“整体鉴别”的思路、方法等提出建议,对TLC的处方药味鉴别与制剂整体鉴别进行了对比分析。TLC整体鉴别具有以下优势或特点:可充分利用样品展开后的斑点信息,可提高结果判断的准确性,鉴别试验次数相对较少。TLC“整体鉴别”为中药新药复方制剂质量标准【鉴别】项研究提供了可反映中药制剂整体质量特征的新模式。
中药复方制剂;薄层色谱;处方药味鉴别;整体鉴别;质量标准
薄层色谱(thin layer chromatography,TLC)法具有设备简单、鉴别专属性强等特点。20世纪80年代以来,TLC板、点样技术、展开技术、仪器设备等方面快速发展。目前TLC法已成为中药复方制剂质量标准中定性鉴别的主要手段,是中药质量标准的重要组成部分,在提高中药制剂质量可控性方面发挥了积极作用。但是,在TLC鉴别研究的思路及方法等方面仍有一些内容值得进一步探讨。本文提出中药新药复方制剂TLC“整体鉴别”的设想,并对相关问题进行讨论,供同行参考。
1 TLC鉴别的目的
1.1 检验中药复方制剂是否按规定处方药味投料
业内一般认为:中药复方制剂质量标准【鉴别】项TLC鉴别的目的在于检验中药制剂是否按规定的处方药味进行投料。包括《中国药典》在内的中药复方制剂质量标准【鉴别】项的设置大多按鉴别药味分列,1个处方药味1个鉴别项。鉴别研究多以对照药材或化学对照品为对照,同时,以不含相应处方药味的样品为阴性对照。《中药新药研究的技术要求》中“中药复方制剂质量标准的起草说明”【鉴别】项下要求:“可根据处方组成及研究资料确定建立相应的鉴别项目,原则上处方各药味均应进行试验研究,根据试验情况,选择列入标准中。首选君药、贵重药、毒性药。因鉴别特征不明显,或处方中用量较小而不能检出者应予说明,再选其他药材鉴别”。从上述内容看,中药复方制剂质量标准【鉴别】项一般是针对处方药味进行研究。
从处方药味投料的管理看,不按国家药品标准规定的处方投料,应属于“药品所含成分与国家药品标准规定的成分不符”,所生产的药品为假药。《药品管理法》(2019年版)规定“生产、销售假药的,没收违法生产、销售的药品和违法所得,责令停产停业整顿,吊销药品批准证明文件,并处违法生产、销售的药品货值金额十五倍以上三十倍以下的罚款……”。《药品生产监督管理办法》(2020年版)要求“从事药品生产活动,应当遵守药品生产质量管理规范,按照国家药品标准、经药品监督管理部门核准的药品注册标准和生产工艺进行生产……,对质量体系运行过程进行风险评估和持续改进,保证药品生产全过程持续符合法定要求。生产、检验等记录应当完整准确,不得编造和篡改”。《药品生产质量管理规范》也要求企业必须建立质量保证系统,同时建立完整的文件体系,保证系统有效运行。在中药制剂的生产过程中,药材、饮片、中间体、制剂的接受、发放、生产等均有完整记录及检验报告。生产企业还应进行质量风险管理,建立追溯体系,防止可能的差错和混淆。此外,省级药品监管部门负责对辖区内的药品生产企业进行监督检查。依据现行法规,如果不按规定的处方药味投料生产属于严重的违法行为,而不仅是药品质量不合格的问题。根据上述制度设计,是否按规定处方药味投料的监管并非主要通过质量标准【鉴别】项的检验来实现。
目前,已上市中药复方制剂质量标准中,鉴别的药味数一般仅占处方的1/4~1/3,大多数品种未能覆盖处方的全部药味(处方较小的复方制剂除外),尤其是处方药味数较多的品种。如采用TLC鉴别对中药复方制剂处方药味实现基本全覆盖,所需的试验次数往往较多,操作繁琐,时间较长,成本较高。此外,由于中药复方制剂所含成分的种类复杂、含量较低,给鉴别带来不少困难。客观上通过处方药味鉴别来检验中药制剂是否按规定的处方药味投料存在一定困难。
1.2 反映中药复方制剂的整体质量特征,进行真伪鉴别
从“鉴别”这一名词的释义看,为“未知物通过比较试验或用其他方法试验后,确认某种特定物质的操作;药品标准中通过化学或物理方法对待测物质进行真伪鉴定的试验”[1];或鉴别指“辨别真假好坏”[2]。即鉴别是对待测药品进行真伪鉴定的试验。如药材质量标准中的【鉴别】项是检验药材的质量特点,辨别其真伪。化学药质量标准的【鉴别】项主要是检验活性化合物的理化性质特征,辨别其真伪。疫苗检定规程中的鉴别试验可采用与相应血清的凝集试验,血清则采用动物中和试验或利用免疫反应鉴别真伪。同理,中药复方制剂质量标准【鉴别】项的TLC鉴别,也可以是通过检验该中药制剂的整体质量特征来辨别其真伪,发挥与同列于【鉴别】项下的理化鉴别相似的作用。
中药复方制剂与化学药不同,其特征往往不是所含有的某个特殊成分,而是含有若干种成分的特定组合,这些成分可能分别存在于多个不同的中药制剂中。如三黄片的质量特征是同时含有且仅含有源自黄芩、黄连、大黄的相关成分,这些成分在其他中药制剂中不同时存在或同时含有源自其他药味的成分。中药新药的“新”在于处方药味组成的“新”,而不是处方中特定药味的“新”(首次在人体暴露)。大多数情况下,中药新药处方中的药味已在多个已上市品种中出现过,但其处方组成是独特的。目前,已上市中成药品种约有6万个批准文号,9000多个质量标准,而常用中药材有500~600种。中药复方制剂的质量特征为源自处方药味的多种成分的特定组合,其真伪鉴别也可以此为依据。
反映中药复方制剂的整体质量特征进行真伪鉴别是质量标准【鉴别】项TLC试验的目的之一。检验中药制剂是否按规定的处方药味投料与反映其整体质量特征二者密切相关,不可分割,并符合整体与局部关系的规律。中药复方制剂的整体质量特征由源自处方各药味的特征组成。源自各处方药味个体的质量特征整合起来形成了不同于各药味的整体质量特征,具备了各药味没有的特点。整体鉴别更有利于反映中药复方制剂质量的特点。
2 整体鉴别的思路
中药新药复方制剂TLC整体鉴别以反映中药复方制剂整体质量特征为研究重点,以辨识中药复方制剂的真伪为目的。可按该思路进行中药制剂整体鉴别试验的设计、研究及验证。中药制剂处方药味所含成分的化学结构、理化性质、生物活性等研究结果,中药复方制剂提取纯化后可能在制剂中保留的成分以及药物代谢研究发现的血液移行成分等的理化性质,都是中药制剂整体鉴别研究的重要参考。
2.1 试验的设计
TLC整体鉴别应体现中药新药复方制剂的整体质量特征。应尽可能多地反映处方各药味进入制剂的有效成分、指标成分等信息,尤其是具有专属性、特征性的成分。可将待鉴别中药制剂作为一个整体,以不同的方法制备成多个供试品溶液,分别选用适宜的展开剂展开,并以合适条件显色、检视,建立多个TLC鉴别试验项。这样,可通过多个TLC试验,从不同的角度反映出中药新药复方制剂的整体质量特征,达到有效鉴别的目的。
2.2 样品预处理
可根据中药复方制剂所含成分的极性分组,以不同极性的溶剂按极性大小梯度提取或分别提取,制成几种供试品溶液,分别进行TLC试验,以展现待检制剂中不同极性成分的整体质量特点。
中药复方制剂所含成分较复杂,而TLC展开距离有限,如采用不同极性的溶剂提取后,样品中含有的成分较多,TLC难以有效分离,可根据所含黄酮、皂苷、三萜、香豆素、生物碱等不同结构类型成分的理化性质进行进一步的分离纯化,建立多个TLC鉴别项,分别反映制剂中不同结构类型成分的特点。
2.3 对照物选择
中药对照制剂是中药标准物质发展的新形式[3]。对照制剂对照有利于充分利用TLC薄层斑点信息,反映制剂的整体质量特点,可作为鉴别相应中药制剂用标准参照物,也可用以评价不同批次中药制剂质量的一致性。如果说对照药材对照相对于对照品对照是薄层鉴别研究在适应中药特点方面的一个进步,那么,对照制剂对照在中药制剂薄层鉴别中的应用相对于对照药材对照也是一个进步。
中药新药复方制剂的整体鉴别一般以对照制剂为对照。可直接以临床试验用中药新药复方制剂样品或申请生产时符合要求的样品为对照制剂。参照《中药对照制剂研制指导原则和技术要求》[3]进行研究。应在中药新药复方制剂质量标准的基础上进一步提高,研究建立对照制剂的质量标准,建立必要的检测项目,规定更严格的质量要求,保证不同批次对照制剂质量特征的稳定。应规定对照制剂所用饮片的基原、产地及质量要求,并按规定的生产工艺制备。应开展对照制剂的稳定性研究,确定合理的包装、贮存条件及有效期。在更换新批号时应进行全面的对比研究,确保新旧批号对照制剂TLC行为的一致。此外,为提高对照物的可及性,可根据品种的具体情况,选用复方制剂处方药味相应的对照药材为原料,按照处方与制法临用时制备对照物;如制法影响不大的,也可简化制备方法。
一般情况下,中药复方制剂的TLC图谱中,制剂样品的薄层斑点数比对照药材多。如连花清瘟胶囊、牛黄解毒片[4]的TLC鉴别图谱(图1、2)中,与对照药材不对应的薄层斑点未能充分利用。考虑到中药新药多为独家生产,从原料来源、生产工艺、过程控制到质量标准等方面相对稳定。如以对照制剂为对照,应能比对照药材更充分地利用展开的斑点信息,较充分展现产品的质量特征,更好反映不同批次产品质量的一致性。
2.4 检视与显色
可参考文献并根据品种的实际情况针对制剂中所含不同结构类型成分的特点选择显色与检视条件。除日光或荧光下检视外,可采用针对不同结构类型成分的多种显色剂分别喷在其中几个样品展开后的斑点上(遮盖薄层板不需要显色的部分),观察其颜色改变。1次展开、多次显色,可鉴别多种不同结构类型的成分,提高检验效率,缩短试验时间。多个鉴别试验可分别从不同角度反映出制剂的整体特征。
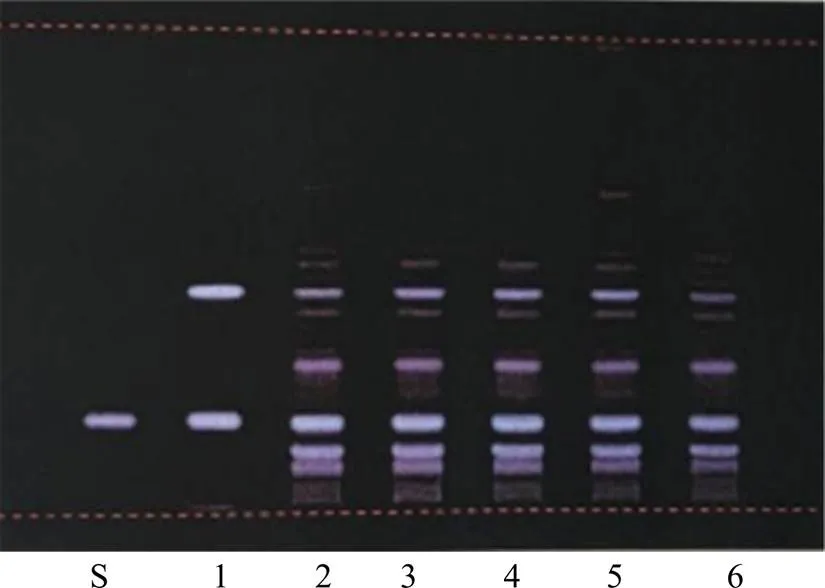
S-绿原酸对照品 1-金银花对照药材 2~6-连花清瘟胶囊样品
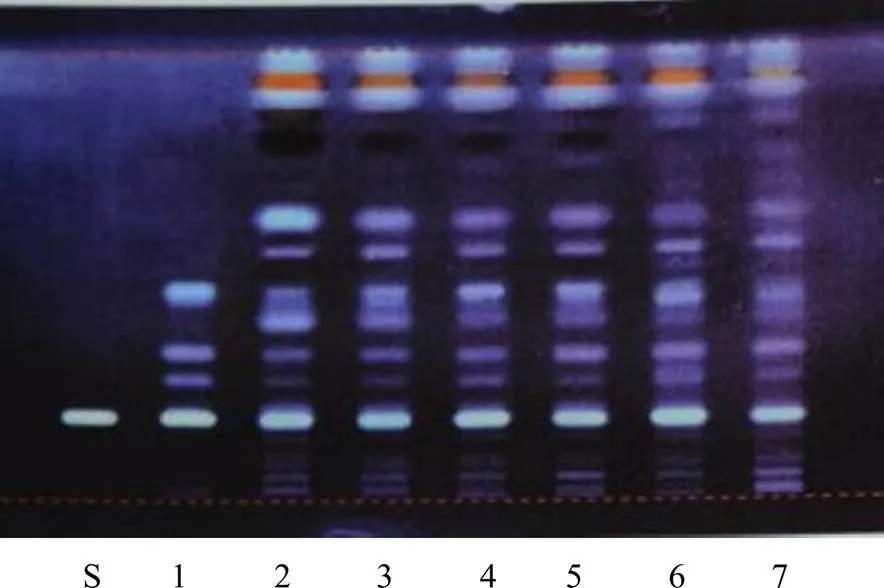
S-胆酸对照品 1-人工牛黄对照药材 2~7-牛黄解毒片样品
生物自显影技术等可将TLC成分分离的作用与中药成分药效作用机制较好地结合起来,反映中药制剂特定作用机制方面的整体质量特征,是与制剂有效性相关的检测方法。已有人将生物自显影技术用于抗菌活性成分、葡萄糖苷酶抑制剂、抗氧化剂、脂酶抑制剂、酪氨酸酶抑制剂等的筛选。相关方法也可用于中药质量标准的【鉴别】项研究。
2.5 结果的判定
以对照药材为对照进行TLC鉴别试验时,大多数情况下按“同法制成对照药材溶液”的方式制备,即采用与待检制剂相同的方法制备供试品溶液,或采用加溶媒(甲醇、乙醇或水等)简单提取的方式制备。由于对照药材的制备与制剂样品相比,缺少了饮片提取纯化制成制剂的工艺过程(或二者不同)。而提取纯化等过程对饮片进入制剂的成分有明显影响,故TLC鉴别试验时,对照药材的TLC斑点与制剂中相应药味成分的斑点常常不完全相同。
以对照制剂为对照进行TLC鉴别试验时,同样按“同法制成对照制剂溶液”的方式制备,即采用与待检制剂相同的方法制备供试品溶液。由于对照制剂的提取纯化工艺与待检中药复方制剂基本相同,除反映处方药味所含成分信息外,也反映了制备工艺的影响。因而,在二者以相同的样品预处理方法处理后,所得供试品溶液所含成分种类应基本相同。TLC鉴别时,待检制剂样品与对照制剂的斑点信息基本相同,如斑点的个数、位置(比移值)、颜色、显色后改变,以及拖尾、斑点形态等。展开后更容易判断待检样品与对照制剂薄层斑点的一致性。此外,在不同试验条件下,由不同人员操作,待检制剂与对照制剂大多也能显示出更为相近的色谱行为,可在一定程度上提高鉴别结果判断的准确性。
考虑到中药制剂所含成分的复杂性,以及TLC试验的影响因素较多等原因,待检制剂与对照制剂的薄层斑点可能仍有些差异。在对照制剂与待检中药制剂中,含量较低(尤其是在检出限附近的成分)、具有挥发性、稳定性较差等成分的TLC斑点的重现性有时可能较差。必要时,可在质量标准【鉴别】项下表述为:“在与对照制剂相应的位置显相同颜色的**个主斑点”,同时,对主斑点的个数、位置、颜色等进行描述。
2.6 方法学研究
中药复方制剂TLC整体鉴别的方法学研究与处方药味鉴别有一定差异。制剂整体鉴别一般以辅料为阴性对照,并对处方中每个处方药味与对照制剂进行平行对比。将每个处方药味按制剂的制法处理后,再按与对照制剂相同的样品制备方法制成供试品溶液。对照制剂中的TLC斑点应溯源到相应的处方药味。除处方药味的TLC鉴别特征不明显或处方用量很小等特殊情况外,每个处方药味的信息都应在制剂整体鉴别的TLC斑点中有所反映。此外,TLC条件选择时,应尽可能多地展现制剂的整体质量特征。
如果对照制剂与多个处方药味在相同的位置上的TLC斑点相同,应考察斑点中是否混杂有多个成分。可采用二维色谱、变更展开剂等方法进行分离研究。必要时,可联用表面增强拉曼光、显微红外光谱、刮下斑点进行分离和结构确证等方法,比较对照制剂中特定斑点与处方药味在相同位置斑点所含成分的一致性。尽可能避免同一个斑点中混杂多种不同成分的情况,减少干扰,提高专属性。如对照制剂与多个处方药味在相同位置出现相同成分的斑点,考虑到该斑点代表的成分也是相应制剂的组成成分,与其他斑点一起构成该制剂的整体质量特征,可认为该斑点仍有鉴别意义。如小檗碱、槲皮素、黄芩苷等可能普遍存在于多个处方药味中,在处方药味鉴别时其专属性较差,但就制剂的整体鉴别而言,同时含有3者的特点仍可作为特定中药制剂的质量特征,具有一定鉴别价值。
3 整体鉴别
TLC法作为中药鉴别的经典方法已有较长应用历史。在利用同一种展开条件同时鉴别多个处方药味方面已有不少有益的探索。赵晓春[5]用同一种展开剂,分别以荧光显色及5%香草醛硫酸溶液显色同时鉴别了罗莫丹中的元胡和白芍。付莉等[6]采用同一样品溶液,在3块薄层板上分别同时鉴别了强肝胶囊中的木香、白术、姜黄和甘草;胃康灵胶囊中的甘草、延胡索和三七;祛风止痛胶囊中的羌活、当归、僵蚕和川芎;在3块薄层板上完成了11味药材的TLC鉴别。伍柏坚等[7]在同一薄层板上同时鉴别了更年乐胶囊中的制何首乌、首乌藤、补骨脂。陈向前[8]用1种展开剂,检出知柏地黄丸中的泽泻、茯苓、山茱萸。漆立军等[9]在同一薄层系统下,以紫丁香苷、大黄素、槲皮素、人参皂苷Rb1和三七皂苷R1混合对照品溶液对照,同时鉴别了银杏活脑胶囊中的银杏提取物、刺五加、何首乌、三七。《中国药典》2020年版“牛黄解毒片”项下,以不同极性溶媒分步提取制成3种供试品溶液,用3个薄层试验鉴别了5个处方药味[10]。如以对照制剂替换上述试验的对照药材或对照品,也同样可以1次鉴别同时反映制剂中源自多个处方药味的质量信息。上述以同一种展开条件同时鉴别多个处方药味的研究为中药制剂整体鉴别奠定了良好基础。
现代高效TLC的多种固定相(如C18、二醇醚改性、丙氨基改性、丙基腈改性、非晶无定形硅胶、整体硅胶等)为中药制剂TLC鉴别的高效分离提供了更多选择;微乳TLC、胶束TLC(假相TLC)等使用表面活性剂、助溶剂等,减少有机溶剂的使用[11-15];低共熔溶剂价格低廉、环境友好。新技术、新方法的不断涌现,为中药制剂整体鉴别研究提供了有利条件。
4 2种鉴别的对比
处方药味鉴别与制剂整体鉴别在诸多方面存在差异。中药新药复方制剂质量标准【鉴别】项TLC试验按处方药味鉴别与制剂整体鉴别研究的差异见表1。

表1 中药复方制剂处方药味鉴别与制剂整体鉴别的差异
目前,中药新药复方制剂质量标准中处方药味鉴别研究的模式多是1块薄层板,展开1次,鉴别1个处方药味。鉴别次数相对较多,样品前处理方法繁琐、费时。而整体鉴别可以用较少的鉴别次数,反映源自多个处方药味的质量信息,展现中药制剂的整体质量特征。
5 结语
薄层鉴别是中药新药复方制剂质量标准【鉴别】项的重要组成部分。质量标准设置TLC鉴别的目的,一方面是检验制剂是否按规定的处方药味投料,同时也是反映制剂的整体质量特征进行真伪鉴别。
与处方药味鉴别相比,制剂整体鉴别在信息利用、结果判断、鉴别次数等方面具有一定优势。可避免以对照药材、单一化学对照品为对照时,展开的制剂斑点信息不能得到充分利用等问题;结果判断时,可在一定程度上减少制剂样品斑点与对照药材不能一一对应、判断标准不清晰等问题;由于一次鉴别试验可反映多个药味的质量信息,鉴别次数相对较少。
每种研究方法或模式都各有其优缺点和适用范围。中药制剂的整体鉴别研究也一样。由于中药复方制剂所含成分复杂,TLC试验的影响因素较多等原因,有些情况下,待检制剂与对照制剂的薄层斑点可能存在一定差异,尤其是含量较低、具有挥发性、稳定性较差成分的薄层斑点重现性有时较差。
建议在中药新药复方制剂质量标准【鉴别】项研究中,按照整体鉴别的模式开展研究,以相对较少的薄层试验次数,反映制剂的整体质量特征,进行有效鉴别。建议在中药制剂整体鉴别研究中,积极吸纳相关研究成果,完善试验方法。
综上所述,“整体鉴别”为中药新药复方制剂质量标准的鉴别研究提供了一种新模式。对于提高中药复方制剂质量标准的可控性、提高检验效率,体现中药整体质量控制理念具有积极的意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 药学名词审定委员会. 药学名词[M]. 北京: 科学出版社, 2014: 96.
[2] 中国社会科学院语言研究所词典编辑室. 现代汉语小词典[M]. 北京: 商务印书馆, 1980: 623.
[3] 聂黎行, 戴忠, 马双成. 中药对照制剂研制指导原则和技术要求 [J]. 中国中药杂志, 2017, 42(19): 3672-3675.
[4] 国家药典委员会. 中华人民共和国药典中成药薄层色谱彩色图集[M]. 北京: 中国医药科技出版社, 2019: 289, 350.
[5] 赵晓春. 摩罗丹中元胡和白芍的薄层色谱鉴别 [J]. 中成药, 1993, 15(4): 41.
[6] 付莉, 韩桂茹. 三种制剂中多味药材的同时鉴别研究 [J]. 中国药事, 2012, 26(1): 69-71.
[7] 伍柏坚, 黄晓丹, 和海龙, 等. 更年乐胶囊质量标准的改进研究 [J]. 广东药学院学报, 2013, 29(6): 625-630.
[8] 陈向前. 薄层色谱法同时鉴别知柏地黄丸中泽泻、茯苓、山茱萸 [J]. 海峡药学, 2014, 26(3): 86-87.
[9] 漆立军, 覃鸿恩, 朱利霞, 等. 基于“一体多评”法建立银杏活脑胶囊质量标准体系 [J]. 医药导报, 2017, 36(7): 777-782.
[10] 中国药典[S]. 一部. 2020: 694.
[11] 赵惠茹, 郭德喜, 李娜, 等. 槐米中黄酮类成分的微乳薄层色谱分离鉴定 [J]. 化工科技, 2016, 24(4): 27-30.
[12] 房德敏, 高颖, 严震, 等. 微乳薄层色谱在中药成分分析中的应用 [J]. 中草药, 2011, 42(9): 1852-1856.
[13] 岳春华, 郑礼涛, 郭启明, 等. 超声强化微乳提取分离姜黄中总姜黄素的研究 [J]. 中药材, 2014, 37(5): 880-883.
[14] 叶颖琳, 许烈强, 张勰, 等. 微乳TLC法分离鉴别喉痛灵片中多种有效成分 [J]. 广东药学院学报, 2015, 31(6): 763-766.
[15] 王继龙, 陈方圆, 刘晓霞, 等. 低共熔溶剂在中药领域的应用研究进展 [J]. 中草药, 2020, 51(17): 4559-4567.
Consideration of novel model of holistic identification for compound preparation of new traditional Chinese medicine
ZHOU Yue-hua1, LU Jin-cai2, ZHOU Juan3, SONG Zong-hua4
1. Center for Drug Evaluation, National Medical Products Administration, Beijing 100022, China 2. Shenyang Pharmaceutical University, Shenyang 110016, China 3. Sichuan Food and Drug Inspection and Testing Institute, Chengdu 611731, China 4. Chinese Pharmacopoeia Committee, Beijing 100061, China
The purpose of thin layer chromatography (TLC) identification in the specification of compound preparation of new traditional Chinese medicine (TCM) is to test whether the batch charging is according to the recipe, as well as to reflect the overall quality characteristics of the products for authenticity identification. Based on this, it is proposed that the TLC study on specification of TCM compound preparation can be carried out according to the novel model of “holistic identification”. The ideas and methods of TLC “holistic identification” are put forward, and the comparison and analysis of prescription medicines identification and holistic identification are carried out. The holistic identification method has the following advantages or characteristics: It can make full use of the spot information, increase the accuracy of the results, and decrease the number of identification tests. TLC “holistic identification” provides a novel model for the study of specification of TCM compound preparations, which can reflect the overall quality characteristics of TCM compound preparations.
traditional Chinese medicine compound preparation;TLC; prescription medicines identification; holistic identification; quality standard
R283.69;R288.4
A
0253 - 2670(2021)08 - 2199 - 06
10.7501/j.issn.0253-2670.2021.08.001
2020-10-16
周跃华,男,主任药师,主要从事中药新药的药学评价工作。Tel: (010)68585566-2879 E-mail: zhouyh@cde.org.cn
[责任编辑 崔艳丽]
