负载microRNA-27b-骨髓间充质干细胞来源外泌体的软骨细胞-聚乳酸羟基乙酸共聚物骨软骨复合体移植治疗软骨缺损的实验研究
2021-04-22孙晓辉赵斌刘洋崔明星
孙晓辉,赵斌,刘洋,崔明星
(新乡医学院第一附属医院,河南 卫辉 453100)
软骨损伤在骨科临床较为常见,由于软骨组织缺乏血管、神经和淋巴系统,自我修复能力非常有限[1]。目前,主要采用骨软骨移植等方法修复软骨损伤,但存在修复后软骨结构差、承重能力下降及易磨损等缺点[2]。研究表明,软骨细胞(chondrocytes,chon)与聚乳酸羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]构建的组织工程骨软骨复合体,可以促进软骨细胞分泌软骨基质,增强对软骨的保护作用,且在软骨组织中具有较好的亲和力[3]。因此,利用组织工程骨软骨复合体治疗软骨缺损具有较大的潜力和优势。骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)能够促进组织再生,且无需诱导细胞分化即可直接植入[4-5]。目前,负载BMSC的骨软骨复合体已在实验室和临床研究中用于软骨修复。然而,BMSC用于软骨修复对供体年龄有严格的要求,大龄供体的BMSC的增殖和分化能力均显著下降,导致修复效果不佳。因此,采用负载BMSC的骨软骨复合体进行软骨修复并不是最佳方法[6-7]。
研究发现,BMSC通过旁分泌效应发挥对软骨的修复作用,而外泌体(exosomes,exo)在修复过程中发挥了重要作用[8]。外泌体是细胞分泌的具有单层膜结构的囊泡,直径50~100 nm,存在于BMSC旁分泌介质中。研究表明,BMSC来源外泌体(BMSC-exo)具有促进心脏、肝脏、皮肤、软骨等组织修复的作用[6]。与植入BMSC相比,植入BMSC-exo具有无细胞、易于操作、支持多途径使用等优势。microRNA(miRNA)是一类由内源基因编码的长度为18~36 bp的非编码单链RNA分子,其在动植物中参与转录后基因的表达调控。研究表明,miRNA-27b(miR-27b)具有促进软骨细胞增殖并加速软骨细胞再生的作用[9-13],但目前仍缺乏关于负载miR-27b-BMSC来源外泌体的软骨细胞-PLGA(miR-27b-BMSC-exo-chon-PLGA)骨软骨复合体移植治疗软骨缺损的实验研究。为了进一步观察负载miR-27b-BMSC-exo-chon-PLGA骨软骨复合体移植治疗软骨缺损的效果并探究其作用机制,我们围绕miR-27b-BMSC-exo开展了相关的实验研究,现总结报告如下。
1 材料与仪器
1.1 实验材料BMSC(广州赛业生物科技有限公司),大鼠软骨细胞(美国典型培养物保藏中心),miR-27b过表达的重组腺病毒载体(上海吉凯基因科技有限公司),引物由北京天根生物化学有限公司合成,PLGA(北京奥京生物科技有限公司),Sprague-Dawley(SD)雌性大鼠(新乡医学院动物实验中心)。实验方案通过新乡医学院第一附属医院伦理委员会批准。
1.2 实验试剂醋酸双氧乙铀溶液(青岛捷世康生物科技有限公司),蛋白抽提试剂盒、化学发光试剂盒(美国赛默飞公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(北京索莱宝科技有限公司),兔抗鼠CD9、CD63、半胱氨酸天冬氨酸蛋白酶(cysteine aspartic acid specific protease,caspase)-3前体、切割-caspase-3、caspase-9前体、切割-caspase-9、基质金属蛋白酶(matrix metalloproteinase,MMP)-13、β-肌动蛋白(β-actin)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Ⅱ型胶原蛋白一抗及辣根过氧化物酶标记免疫球蛋白(immunoglobulin,Ig)G二抗、生物素标记山羊抗兔IgG二抗(美国Abcam公司),胎牛血清和RPMI-1640培养基(美国Gibco公司),白细胞介素(interleukin,IL)-1β(北京同立海源生物科技有限公司),Trizol试剂、DAB辣根过氧化物酶显色试剂盒、苏木精伊红(hematoxylin and eosin,HE)染色试剂盒、番红O-固绿染色试剂盒、阿尔新蓝苏木精/橙G(Alcian Blue Hematoxylin/Orange G,ABH/OG)染色试剂盒、抗原修复液(上海碧云天生物技术有限公司),反转录试剂盒(日本Takara公司),TaqMan miRNA分析试剂盒(哈尔滨HaiGene公司),Dil细胞膜红色荧光探针(上海源叶生物科技有限公司),Hoechst33258染色试剂(合肥Biosharp公司),噻唑蓝[生工生物工程(上海)股份有限公司],盐酸氯胺酮注射液(重庆药友制药有限责任公司,国药准字H50021106)。
1.3 实验仪器超高速离心机(德国Herolab公司),透射电子显微镜(日本电子株式会社),Mastersizer 2000激光粒度分析仪(英国马尔文仪器有限公司),Zeta电位分析仪(美国布鲁克海文仪器公司),D2500荧光显微镜(德国徕卡公司)。
2 方 法
2.1BMSC和大鼠软骨细胞的培养将BMSC和大鼠软骨细胞分别培养于含有10%胎牛血清的RPMI-1640培养基上,置于温度为37 ℃、二氧化碳浓度为5%的培养箱中。每36 h换液1次,每72 h传代1次。
2.2BMSC-exo的制备与鉴定
2.2.1BMSC-exo的制备 取4 mL培养至第2或第3代的BMSC培养液于15 mL离心管中,于4 ℃下以2000×g离心5 min后,转移上清液至新的15 mL离心管。重复该步骤,依次以3500×g离心15 min、10 000×g离心30 min、120 000×g离心140 min。最后一次离心完成后,弃去上清液,用4 mL无菌PBS将沉淀重新悬浮,用0.22 μm无菌过滤器过滤,转入5 mL离心管中,在4 ℃下以120 000×g离心70 min。离心后弃去上清液,离心管底部残留的微量沉淀即为BMSC-exo。加入100 μL的无菌PBS悬浮,放置于-80 ℃冰箱保存备用。
2.2.2BMSC-exo的鉴定 取10 μL BMSC-exo悬液,滴入载样铜网中,保留1.5 min,滴加2%醋酸双氧乙铀溶液染色1 min后,用滤纸吸干,再在室温下晾1 min。将载样铜网置于样品室,使用透射电子显微镜观察和拍照。取10 μL BMSC-exo悬液,注入Mastersizer 2000激光粒度分析仪,测定BMSC-exo的粒径。取10 μL BMSC-exo悬液,加入到Zeta电位分析仪,测定BMSC-exo的Zeta电位。
2.2.3BMSC-exo表面标记蛋白分析 分别取一定量的BMSC和BMSC-exo,使用蛋白抽提试剂盒提取总蛋白,并采用BCA法测定蛋白浓度。采用蛋白质印迹法(Western Blot)检测BMSC-exo的表面标记蛋白CD9和CD63:取BMSC蛋白和BMSC-exo蛋白进行SDS-PAGE,每个样品设置6个复孔,每孔加入的总蛋白量相同;将凝胶上的蛋白湿转到硝酸纤维素膜上,加入2%牛血清白蛋白于室温下封闭2 h,加入兔抗鼠CD9、CD63、GAPDH一抗,于4 ℃孵育过夜,抗体使用比例分别为1∶800、1∶500、1∶5000;使用TBST溶液漂洗后加入辣根过氧化物酶标记IgG二抗,抗体使用比例为1∶1 000,于室温下孵育1 h,再次用TBST溶液漂洗,根据化学发光试剂盒说明进行显色。拍照后采用Image-J图像处理软件处理图片,提取蛋白条带的灰度值,并分别以GAPDH蛋白和BMSC为基准进行2次标准化处理,计算蛋白条带的相对灰度值,比较蛋白的相对表达水平。
2.3 感染重组腺病毒的BMSC中miR-27b的表达分析取培养至第2或第3代的BMSC分为2组,分别接种在2块6孔板中,每孔细胞数量约1×105个。待每孔细胞数量达到约2×105时,更换新鲜的RPMI-1640培养基,BMSC组加入2 mL新鲜的RPMI-1640培养基,miR-27b-BMSC组加入2 mL miR-27b过表达的重组腺病毒(感染复数为100)培养液。培养24 h后,根据2.2.1的方法分别制备BMSC-exo和miR-27b-BMSC-exo。采用Trizol法分别提取BMSC、BMSC-exo、miR-27b-BMSC、miR-27b-BMSC-exo中的总RNA;根据反转录试剂盒合成cDNA;采用TaqMan MicroRNA检测试剂盒说明进行实时定量PCR(real time quantitative PCR,RT-qPCR),使用U6作为内参基因;计算CT值,并使用2-ΔΔCT计算miR-27b的相对表达量。miR-27b的正向引物:5′-CGTGGTGGCGTCAGAGGCGGTTTG-3′,反向引物:5′-CCGCCCAGCAGGGACAAAGAAC-3′;内参基因U6的正向引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′。
2.4 大鼠软骨细胞摄取miR-27-BMSC-exo的情况观察取100 μL浓度为80 μg·mL-1的miR-27b-exo,加入1 mL Dil细胞膜红色荧光探针,于4 ℃染色30 min;染色后于4 ℃下以10 000×g离心60 min,弃上清液;用PBS洗涤沉淀3次,每次洗涤后于4 ℃下以 10 000×g离心60 min,弃上清液;加入100 μL无菌PBS将沉淀悬浮以备用。取1 mL培养至第2或第3代的大鼠软骨细胞液(细胞密度约为3×105个·mL-1)接种于放置有爬片的培养皿中,培养至细胞汇合率达到80%时,加入100 μL上述miR-27b-BMSC-exo悬液,8字轨道轻轻混匀,于37 ℃下培养4 h。在培养皿中加入1 mL Hoechst33258染色液,染色5 min;吸取染色液,用PBS洗涤3次。取出爬片置于载玻片上,加盖玻片后,置于荧光显微镜下观察。
2.5 共培养后大鼠软骨细胞中miR-27b的表达分析取一定量培养至第2或第3代的大鼠软骨细胞培养液,分为2组。BMSC-exo组接种于BMSC-exo终浓度为80 μg·mL-1的RPMI-1640培养基,miR-27b-BMSC-exo组接种于miR-27b-BMSC-exo终浓度为80 μg·mL-1的RPMI-1640培养基;每组1块6孔板,每孔加入1 mL培养基和1 mL细胞密度约为3×105个·mL-1的大鼠软骨细胞培养液,置于温度为37 ℃、二氧化碳浓度为5%的培养箱中培养4 h。收集大鼠软骨细胞,按照2.3的方法进行RT-qPCR检测。
2.6 miR-27b-BMSC-exo影响大鼠软骨细胞的观察
2.6.1大鼠软骨细胞的分组处理 取一定量培养至第2或第3代的大鼠软骨细胞,分为4组。对照组于RPMI-1640培养基中培养,不进行干预,IL-1β组在IL-1β终浓度为10 ng·mL-1的RPMI-1640培养基中培养,miR-27b-BMSC-exo组在IL-1β终浓度为10 ng·mL-1、miR-27b-BMSC-exo终浓度为80 μg·mL-1的RPMI-1640培养基中培养,BMSC-exo 组在IL-1β终浓度为10 ng·mL-1、BMSC-exo终浓度为80 μg·mL-1的RPMI-1640培养基中培养;每组1块6孔板,每孔加入1 mL培养基和1 mL细胞密度约为3×105个·mL-1的大鼠软骨细胞培养液,置于温度为37 ℃、二氧化碳浓度为5%的培养箱中培养。
2.6.2大鼠软骨细胞的活力测定 分别于0 h、1 h、2 h、3 h、4 h和8 h收集一定量的各组细胞,接种到96孔板中,每组细胞接种6个复孔,每孔细胞个数约为3000个。根据噻唑蓝试剂说明,采用MTT法检测每个孔的吸光度。
2.6.3大鼠软骨细胞中软骨损伤相关蛋白的表达分析 于培养24 h后收集各组细胞,使用蛋白抽提试剂盒提取总蛋白。采用Western Blot检测caspase-3前体、切割-caspase-3、caspase-9前体、切割caspase-9、MMP-13蛋白的表达,步骤同2.2.3中Western Blot步骤,其中caspase-3前体、切割-caspase-3、caspase-9前体、切割-caspase-9等MMP-13、β-actin兔抗鼠一抗的使用比例分别为1∶500、1∶700、1∶400、1∶600、1∶500、1∶2000,辣根过氧化物酶标记IgG二抗的使用比例为1∶1 000。拍照后采用Image-J图像处理软件处理图片,提取蛋白条带的灰度值,并分别以β-actin蛋白和对照组为基准进行2次标准化处理,计算蛋白条带的相对灰度值,比较蛋白的相对表达水平。
2.7 miR-27b-BMSC-exo影响骨软骨复合体移植治疗软骨缺损的观察
2.7.1骨软骨复合体的制备 将直径3.5 mm、高 3.0 mm、孔隙率91%~96%的圆柱体PLGA支架经多聚赖氨酸浸泡12 h,再用500 mg·L-1的环氧乙烷在55 ℃灭菌12 h,然后在无菌室静置5 d,使用无菌PBS漂洗,干燥后保存于干燥器中以备用。取一定量培养至第2或第3代的大鼠软骨细胞培养液,分为3组,分别接种于RPMI-1640培养基、BMSC-exo终浓度为80 μg·mL-1的RPMI-1640培养基、miR-27b-BMSC-exo终浓度为80 μg·mL-1的RPMI-1640培养基进行培养,制备chon、BMSC-exo-chon、miR-27b-BMSC-exo-chon的细胞培养液。将PLGA支架放置于培养皿中,用PBS湿润后,分别加入1 mL细胞密度约为5×104个·mL-1的chon、BMSC-exo-chon、miR-27b-exo-chon的细胞培养液,于温度为37 ℃、二氧化碳浓度为5%的培养箱中培养。检测细胞密度,待细胞密度达到1.5×104个·mm-3,将骨软骨复合体置于4 ℃下保存。
2.7.2软骨缺损SD大鼠模型的建立 将18只8周龄SD雌性大鼠适应性喂养1周后,采用腹腔注射盐酸氯胺酮注射液进行麻醉,盐酸氯胺酮的用量为80 mg·kg-1。于SD大鼠左后肢膝关节取髌骨内侧纵形切口,使髌骨侧方脱位,显露膝关节;使用直径4.0 mm的空心钻在股骨远端滑车沟槽制造直径4.5 mm、深度1 mm的软骨缺损,建立软骨缺损SD大鼠模型。
2.7.3骨软骨复合体植入软骨缺损SD大鼠 采用随机数字表将18只软骨缺损SD大鼠随机分为3组,对照组植入chon-PLGA骨软骨复合体,miR-27b-BMSC-exo组植入miR-27b-BMSC-exo-chon-PLGA骨软骨复合体,BMSC-exo组植入BMSC-exo-chon-PLGA骨软骨复合体。将骨软骨复合体填塞于骨缺损处,使关节创面平滑,恢复脱位的髌骨,逐层缝合切口,加压包扎。
2.7.4SD大鼠软骨修复观察 SD大鼠术后饲养12周,采取脊椎脱臼法处死。切取股骨远端,暴露软骨创面进行观察。取含有创面的骨组织制备石蜡切片,在切片后分别采用HE、番红O-固绿、ABH/OG试剂盒进行染色,于显微镜下观察。
2.7.5SD大鼠软骨组织中软骨损伤修复标志蛋白的表达分析 取切片后的石蜡切片,加入抗原修复液进行抗原修复。加入兔抗鼠的Ⅱ型胶原蛋白、MMP-13一抗孵育20 min,抗体使用比例分别为1∶600、1∶800,用PBS洗涤3次,加入生物素标记山羊抗兔IgG二抗孵育2 h,抗体使用比例为1∶2000。根据DAB辣根过氧化物酶显色试剂盒说明进行显色。显色后用蒸馏水冲洗,再使用苏木精复染,于显微镜下观察,拍照后采用Image-Pro plus 6.0图像分析软件处理,并比较软骨损伤修复标志蛋白的表达阳性率。
2.7.6SD大鼠软骨组织中软骨损伤相关蛋白的表达分析 取SD大鼠含创面的新鲜软骨组织,磨成匀浆后,使用蛋白抽提试剂盒提取总蛋白。采用Western Blot检测caspase-3前体、切割-caspase-3、caspase-9前体、切割-caspase-9、MMP-13蛋白的表达,步骤同2.2.3 Western Blot,兔抗鼠 caspase-3 前体、切割-caspase-3、caspase-9前体、切割-caspase-9、MMP-13、β-actin一抗和辣根过氧化物酶标记山羊抗兔IgG二抗的使用比例与2.6.3相同。采用Image-J图像处理软件处理图片,提取蛋白条带的灰度值,并以β-actin蛋白为基准进行标准化处理,计算蛋白条带的相对灰度值,比较蛋白的相对表达水平。
2.8 数据统计采用GraphPad Prism 5.0进行实验数据的统计分析。CD9和CD63蛋白表达的相对灰度值、miR-27b相对表达量的组间比较采用t检验;大鼠软骨细胞活力的比较采用重复测量资料的方差分析;软骨损伤相关蛋白表达的相对灰度值、软骨损伤修复标志蛋白表达阳性率的组间总体比较均采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结 果
3.1 BMSC-exo的鉴定结果BMSC-exo为圆盘形囊泡状膜结构(图1),粒径92~115 nm,数量占比最高的BMSC-exo的粒径为106 nm(图2);BMSC-exo的Zeta电位为(-22.13±2.1)mV。BMSC-exo表面标记物CD9和CD63在BMSC-exo组的表达量显著高于BMSC组,差异有统计学意义(图3、表1)。
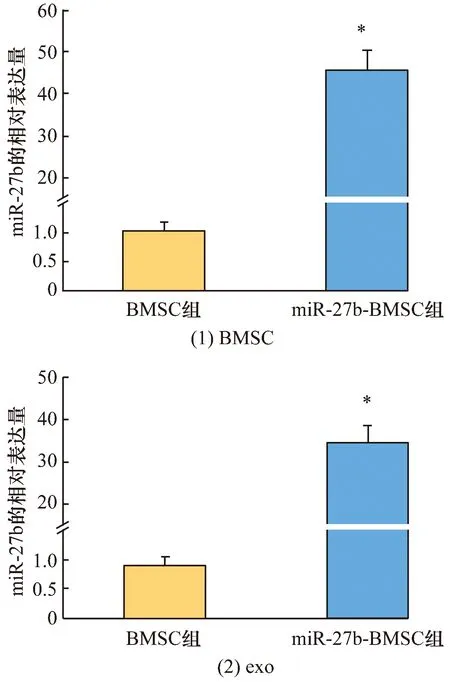
3.2 miR-27b表达的检测结果miR-27b在miR-27b-BMSC组BMSC中的表达量高于BMSC组(相对表达量:46.785±8.153,1.000±0.280,t=13.748,P=0.000),miR-27b在miR-27b-BMSC组exo中的表达量高于BMSC组(相对表达量:34.825±8.612,1.000±0.325,t=9.621,P=0.000)。见图4。
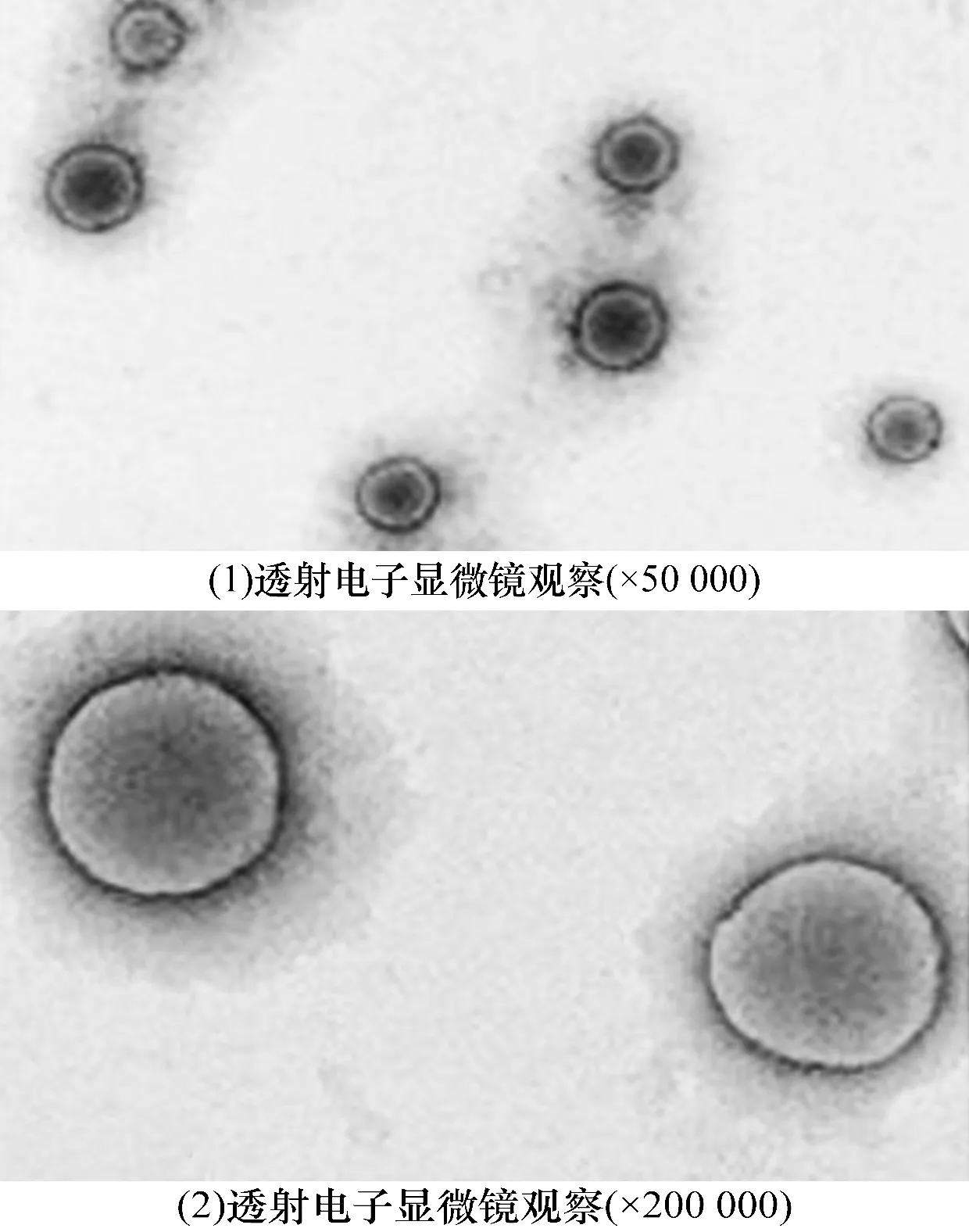
BMSC:骨髓间充质干细胞;exo:外泌体。
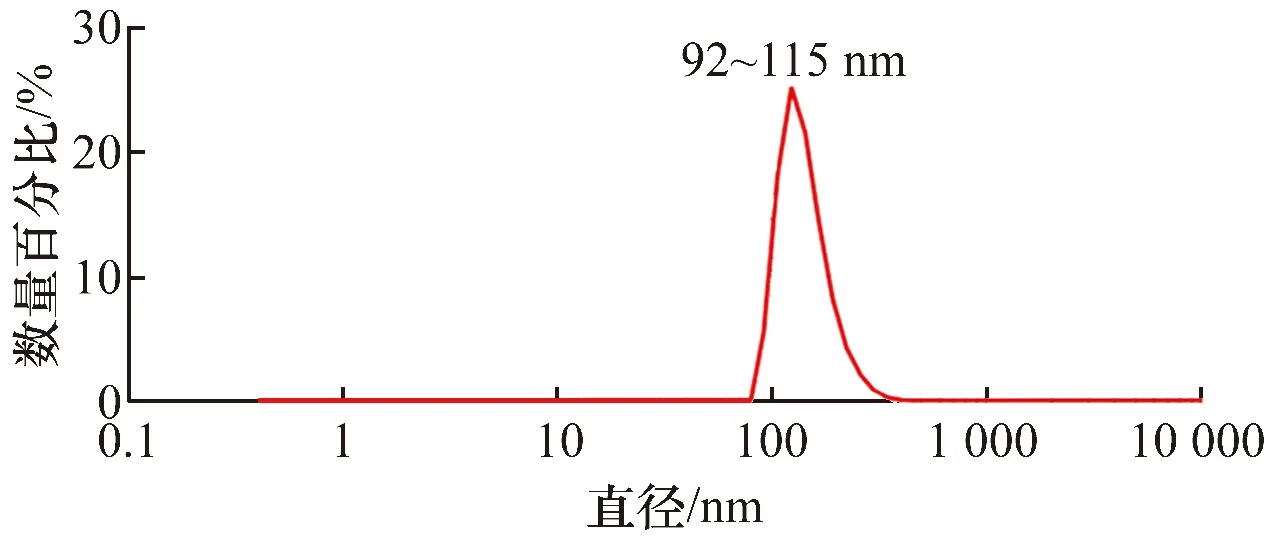
BMSC:骨髓间充质干细胞;exo:外泌体。
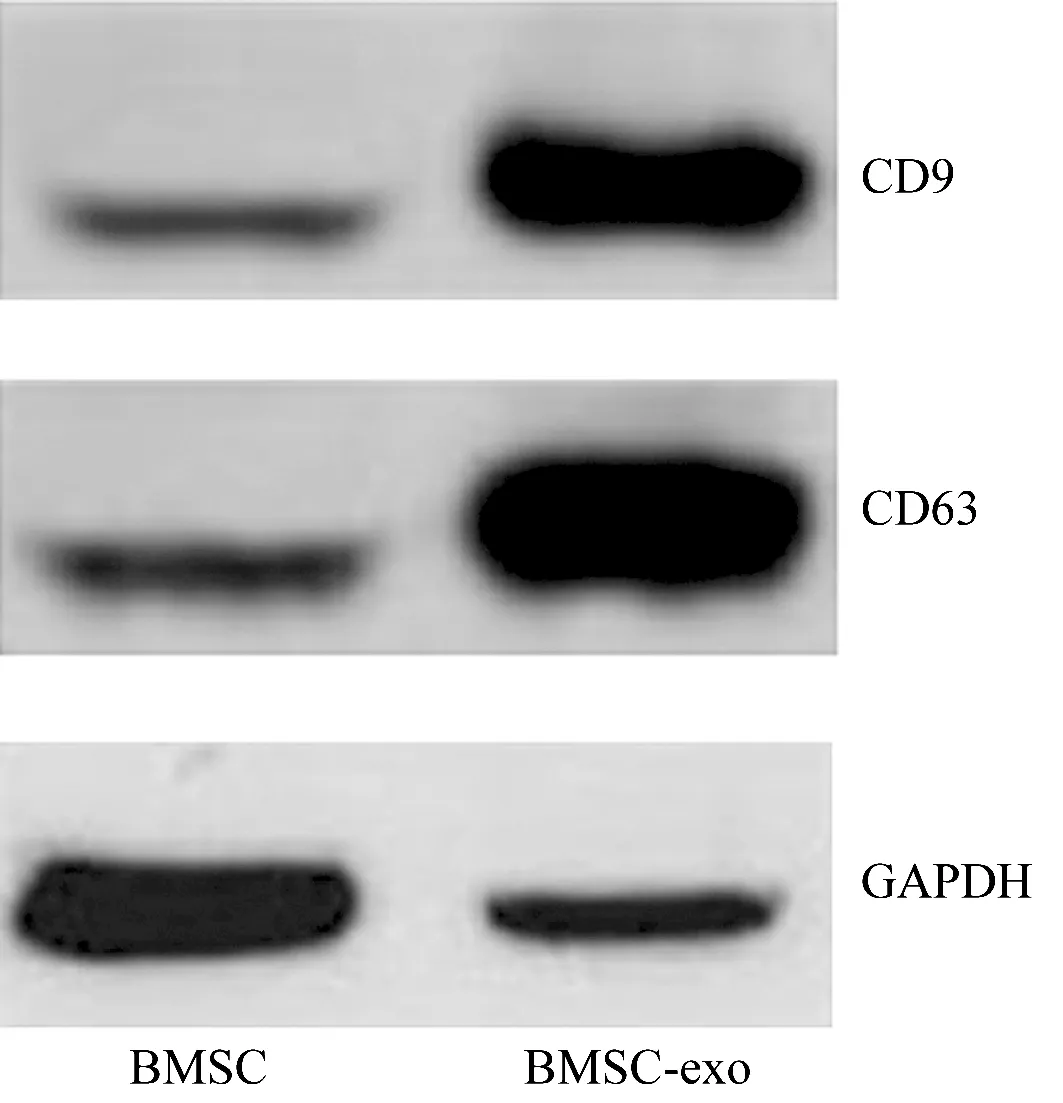
BMSC:骨髓间充质干细胞;exo:外泌体;GAPDH:甘油醛-3-磷酸脱氢酶,为内参蛋白。
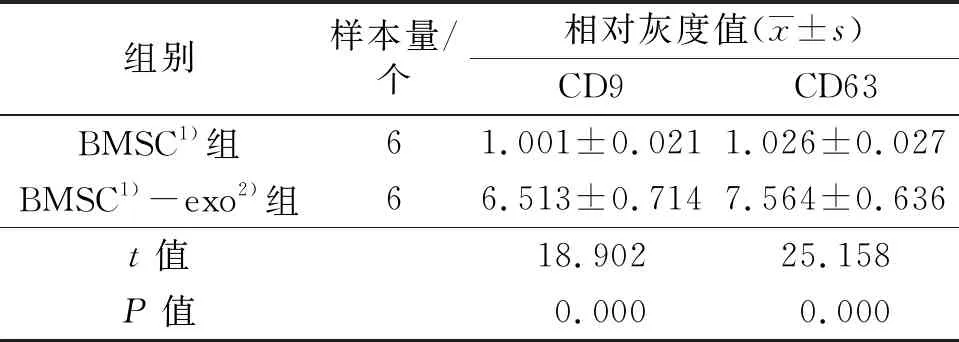
表1 BMSC和BMSC-exo表面标记蛋白的相对表达量
3.3 大鼠软骨细胞对miR-27b-BMSC-exo的摄取情况大鼠软骨细胞和miR-27b-BMSC-exo共培养4 h,miR-27b-BMSC-exo被大鼠软骨细胞摄取(图5)。
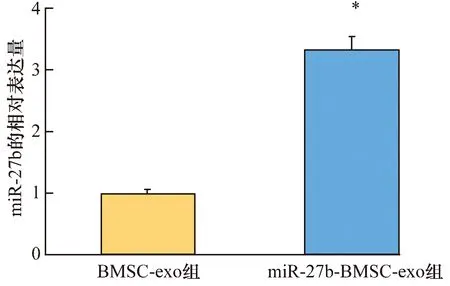
3.4 共培养后大鼠软骨细胞中miR-27b表达的检测结果miR-27b 在miR-27b-BMSC-exo组大鼠软骨细胞中的表达量高于BMSC-exo组(相对表达量:3.315±0.523,1.000±0.244,t=9.826,P=0.000)。见图6。
3.5 miR-27b-BMSC-exo对大鼠软骨细胞的影响
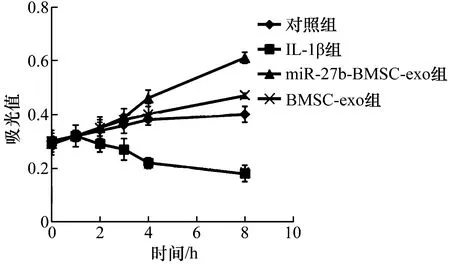
3.5.1大鼠软骨细胞活力的测定结果 时间因素与分组因素存在交互效应。4组大鼠软骨细胞活力总体比较,差异有统计学意义,即存在分组效应。培养前及培养1 h、2 h,大鼠软骨细胞活力的组间差异无统计学意义;培养3 h、4 h、8 h,大鼠软骨细胞活力的组间差异有统计学意义,IL-1β组的大鼠软骨细胞活力小于对照组、miR-27b-BMSC-exo组、BMSC-exo组(3 h:P=0.002,P=0.011,P=0.026;4 h:P=0.002,P=0.002,P=0.006;8 h:P=0.004,P=0.004,P=0.011),miR-27b-BMSC-exo组的大鼠软骨细胞活力大于对照组和BMSC-exo组(3 h:P=0.019,P=0.023;4 h:P=0.015,P=0.002;8 h:P=0.003,P=0.029)。不同时间点大鼠软骨细胞活力总体比较,差异无统计学意义,即不存在时间效应。见图7、表2。
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。

miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。
IL:白细胞介素;miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。
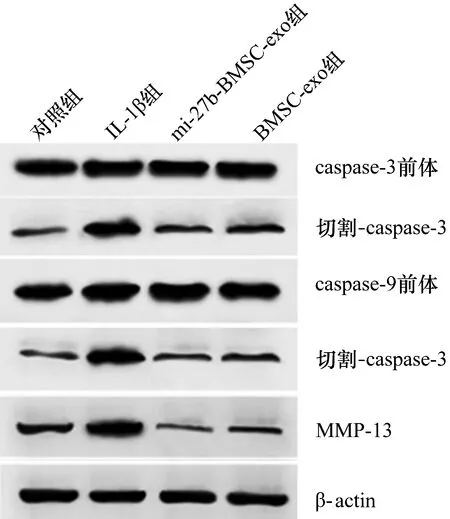
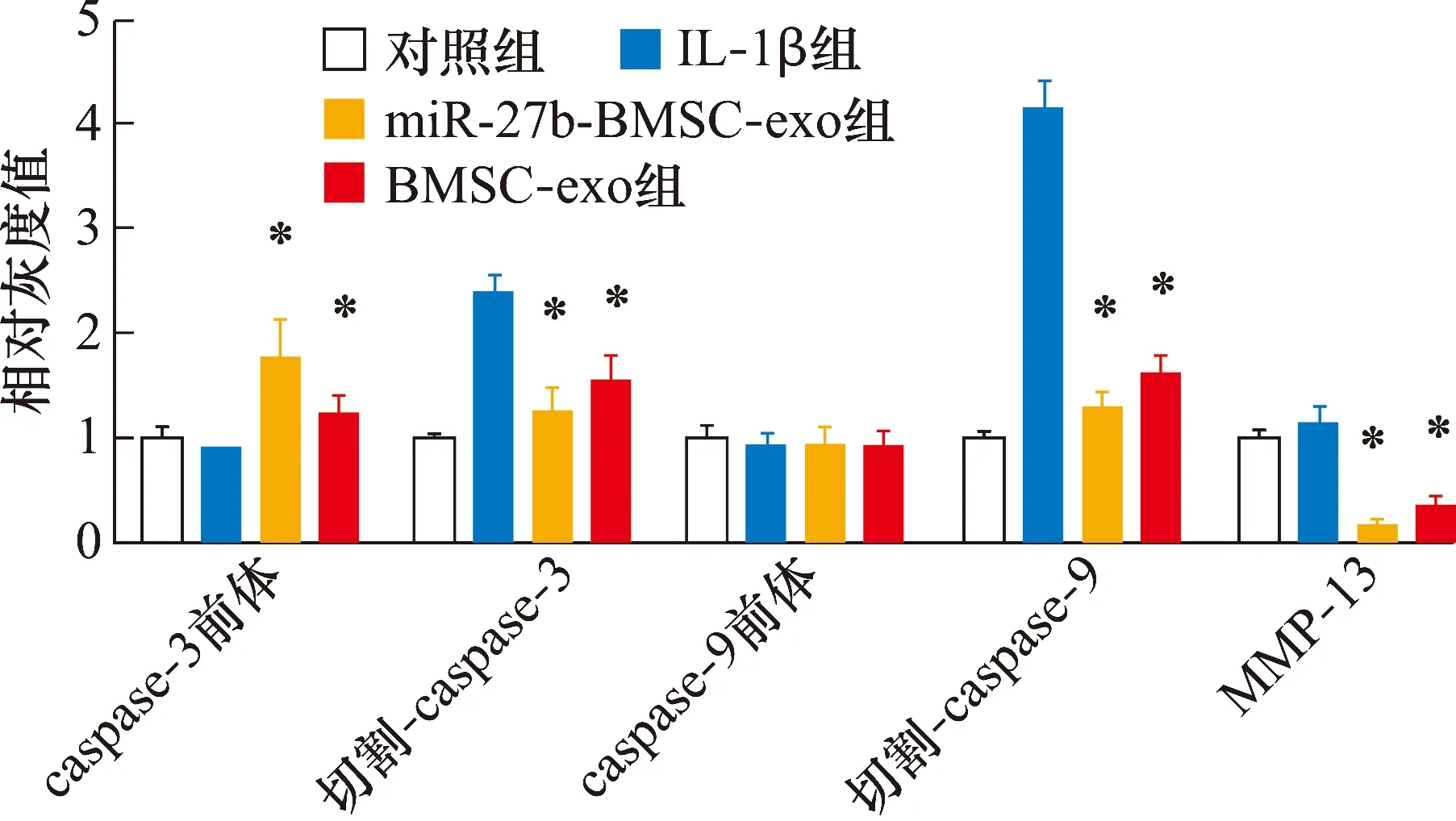
3.5.2大鼠软骨细胞中软骨损伤相关蛋白表达的检测结果 切割-caspase-3、切割-caspase-9和MMP-13的表达量组间比较,差异有统计学意义。IL-1β组大鼠软骨细胞切割-caspase-3、切割-caspase-9和MMP-13的表达量高于对照组、miR-27b-BMSC-exo组、BMSC-exo组(切割-caspase-3:P=0.025,P=0.020,P=0.006;切割-caspase-9:P=0.011,P=0.008,P=0.036;MMP-13:P=0.034,P=0.003,P=0.009); miR-27b-BMSC-exo组大鼠软骨细胞中切割-caspase-3、切割-caspase-9和MMP-13的表达量低于BMSC-exo组(P=0.023,P=0.010,P=0.007)。见图8、图9、表3。
IL:白细胞介素;miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体;caspase:半胱氨酸天冬氨酸蛋白酶;MMP:基质金属蛋白酶;β-actin:β肌动蛋白。
IL:白细胞介素;miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体;caspase:半胱氨酸天冬氨酸蛋白酶;MMP:基质金属蛋白酶。
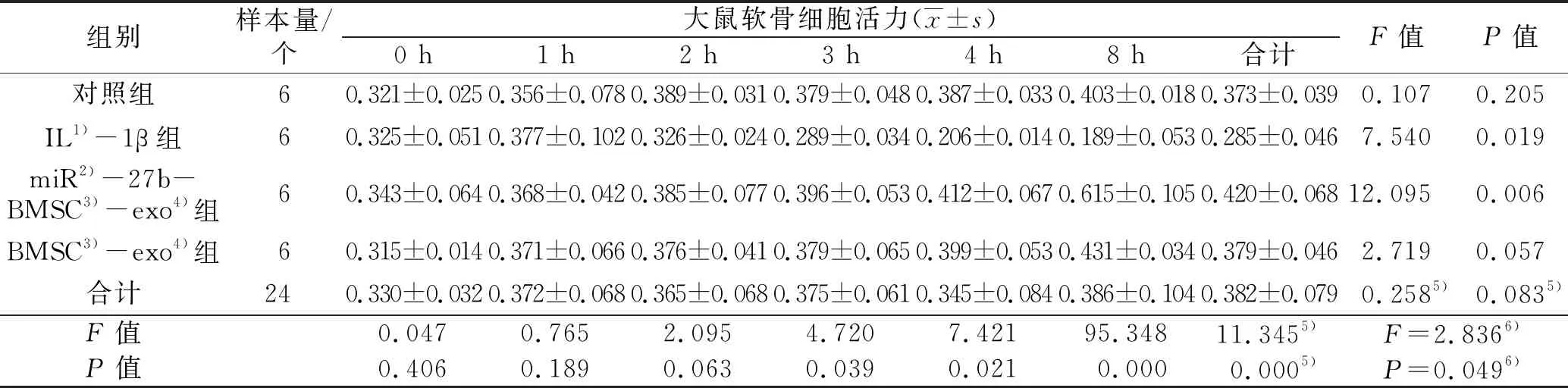
表2 4种不同因素干预后不同时间点4组大鼠软骨细胞的活力
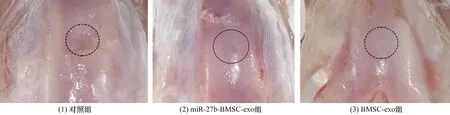
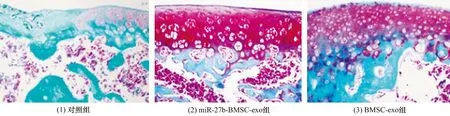
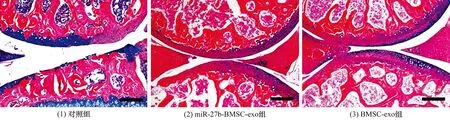
3.6SD大鼠软骨缺损修复效果直视下观察,miR-27b-BMSC-exo组SD大鼠软骨损伤修复效果优于对照组和BMSC-exo组(图10)。病理染色结果显示,对照组软骨层较薄,边缘不规则,软骨下骨和软骨无界限;miR-27b-BMSC-exo组和BMSC-exo组软骨层较厚,边缘光滑,软骨下骨和软骨界限清晰,且miR-27b-BMSC-exo组透明软骨修复效果优于BMSC-exo组(图11至图13)。
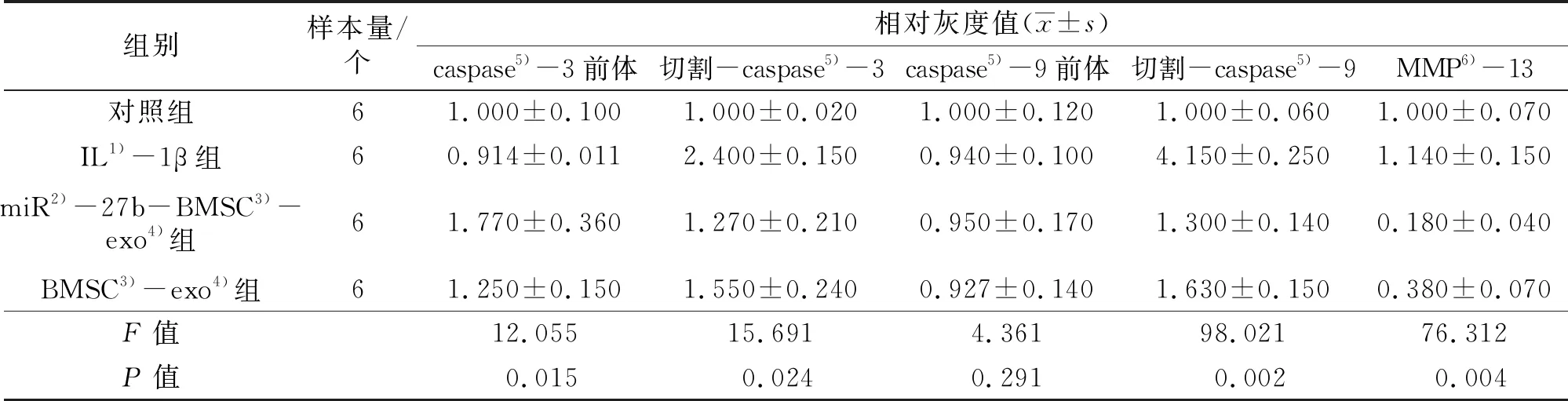
表3 4种不同因素干预24 h后4组大鼠软骨细胞中软骨损伤相关蛋白的相对表达量
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。
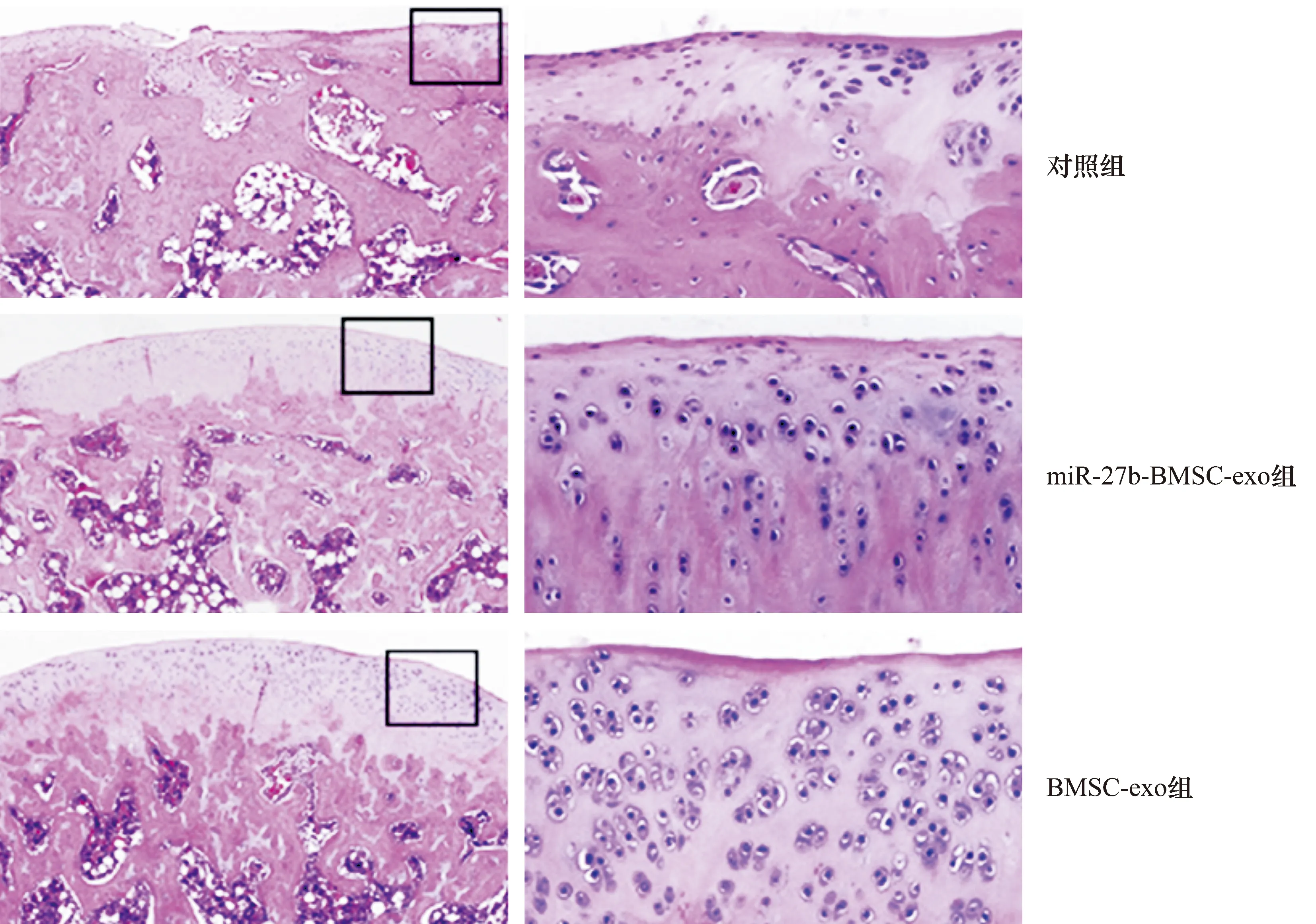
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体;左侧图放大40倍;右侧图放大200倍。
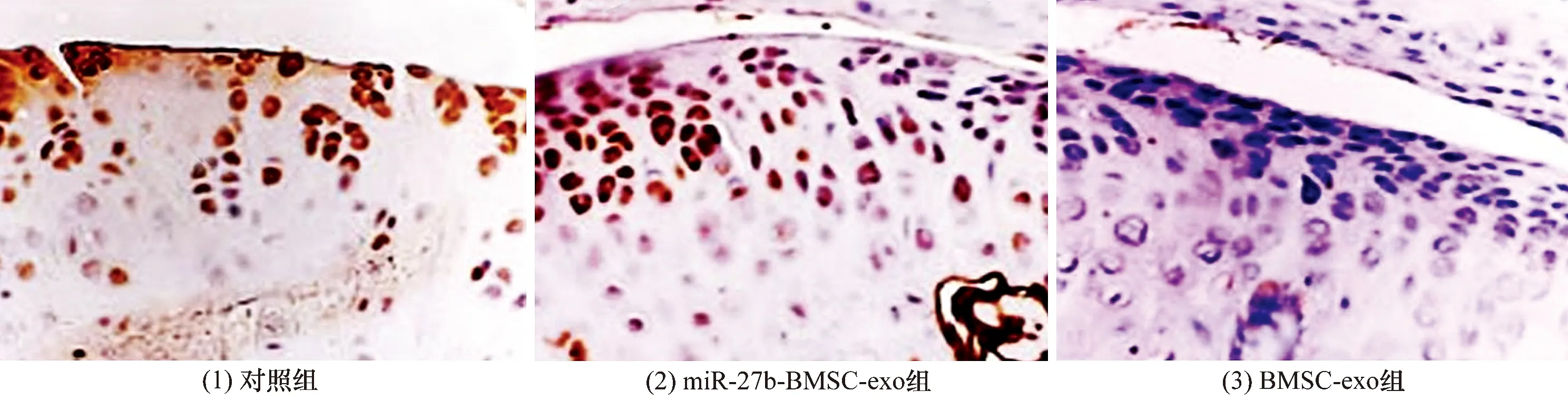
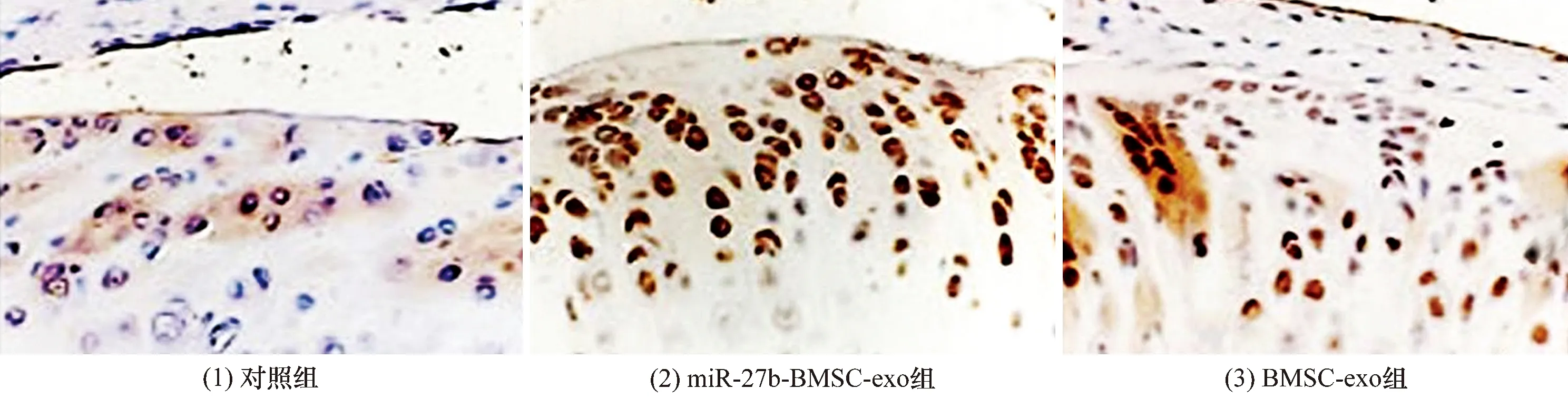
3.7SD大鼠软骨组织中软骨损伤修复标志蛋白表达的检测结果免疫组织化学染色显示,对照组和BMSC-exo组SD大鼠软骨组织中MMP-13高表达,miR-27b-BMSC-exo组SD大鼠软骨组织中MMP-13低表达(图14);对照组SD大鼠软骨组织中Ⅱ型胶原蛋白低表达,BMSC-exo组和miR-27b-BMSC-exo组SD大鼠软骨组织中Ⅱ型胶原蛋白高表达(图15)。MMP-13、Ⅱ型胶原蛋白的表达阳性率的组间比较,差异有统计学意义,miR-27b-BMSC-exo组SD大鼠软骨组织Ⅱ型胶原蛋白表达量高于对照组和BMSC-exo组(P=0.005,P=0.012),MMP-13的表达量低于对照组和BMSC-exo组(P=0.029,P=0.014)。见表4。
3.8SD大鼠软骨组织中软骨损伤相关蛋白表达的检测结果切割-caspase-3、切割-caspase-9和MMP-13的表达量组间比较,差异有统计学意义。miR-27b-BMSC-exo组切割-caspase-3、切割-caspase-9和MMP-13的表达量均低于对照组和BMSC-exo组(切割-caspase-3:P=0.003,P=0.006;切割-caspase-9:P=0.001,P=0.019;MMP-13:P=0.007,P=0.008)。见图16、图17、表5。
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体;MMP:基质金属蛋白酶。
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体。
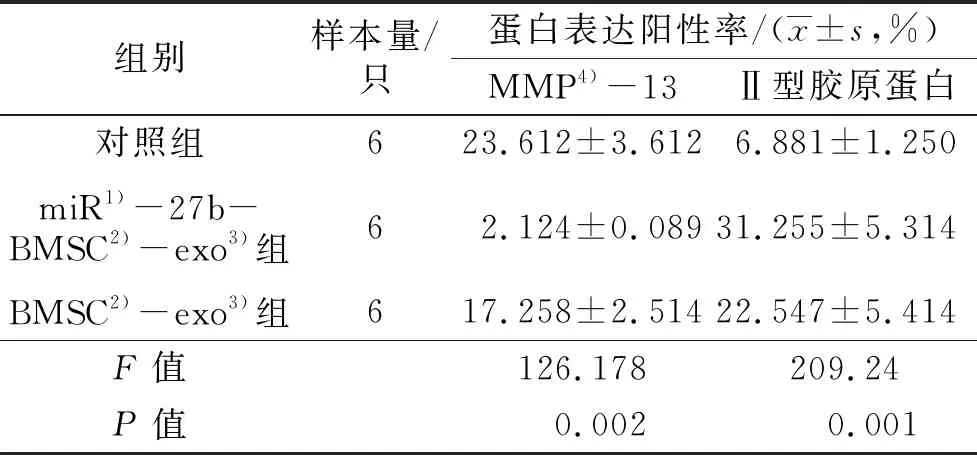
表4 骨软骨复合体移植后12周3组SD大鼠软骨组织中MMP-13和Ⅱ型胶原蛋白的表达阳性率

miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体;β-Actin:β肌动蛋白;caspase:半胱氨酸天冬氨酸蛋白酶;MMP:基质金属蛋白酶。
4 讨 论
BMSC的外泌体所含成分较多,主要包括miRNA、mRNA、蛋白质等,这些成分在细胞通信中发挥重要作用[14]。miRNA种类繁多,主要参与转录后基因的表达调控,但大多数miRNA的生理功能尚不清楚。Zhou等[15]研究表明,miR-27b能够显著降低大鼠软骨细胞中促凋亡蛋白caspase-3的表达、提高抗凋亡蛋白Bcl-2的表达,从而抑制大鼠软骨细胞的凋亡。苏永蔚等[16]研究发现,在软骨细胞炎症模型大鼠的关节腔内注射miR-27b-BMSC-exo,能够减缓关节软骨退行性病变,具有明显的抗炎作用。我们通过实验证明了miR-27b能够在BMSC以及BMSC-exo中高表达,且大鼠软骨细胞能够摄取miR-27b-BMSC-exo;而在大鼠软骨细胞摄取miR-27b-BMSC-exo后,能够在大鼠软骨细胞中检测到miR-27b过表达,为进一步观察miR-27b-BMSC-exo-chon-PLGA骨软骨复合体移植治疗软骨缺损的效果并探究其作用机制奠定了基础。
Caspase是一类天冬氨酸特异性半胱氨酸蛋白酶,包括caspase-3,caspase-6,caspase-7,caspase-8、caspase-9等,其中caspase-8、caspase-9是细胞凋亡的启动者,而caspase-3、caspase-6、caspase-7是细胞凋亡的执行者[17]。Choi等[18]研究发现,caspase-3在骨缺损模型中高表达。Ren等[19]研究发现,caspase-9的表达与大鼠软骨细胞凋亡以及软骨损伤的发展密切相关。Jiang等[20]研究发现,抑制caspase-9的激活可以显著降低高糖诱导的软骨终板细胞凋亡。我们给予大鼠软骨细胞炎症刺激后,切割-caspase-3、切割-caspase-9的表达量显著增高,而加入miR-27b-BMSC-exo能够显著降低切割-caspase-3和切割-caspase-9的表达水平,且在软骨缺损模型SD大鼠的软骨组织中也表现出相同的结果。Zhou等[15]研究发现,miR-27b能够抑制大鼠软骨细胞中的caspase-3和caspase-9的表达,与本研究结果一致。因此,miR-27b-BMSC-exo促进软骨细胞修复可能与其抑制caspase-3、caspase-9的表达有关,在大鼠软骨细胞损伤过程中发挥了抑制软骨细胞凋亡的作用。
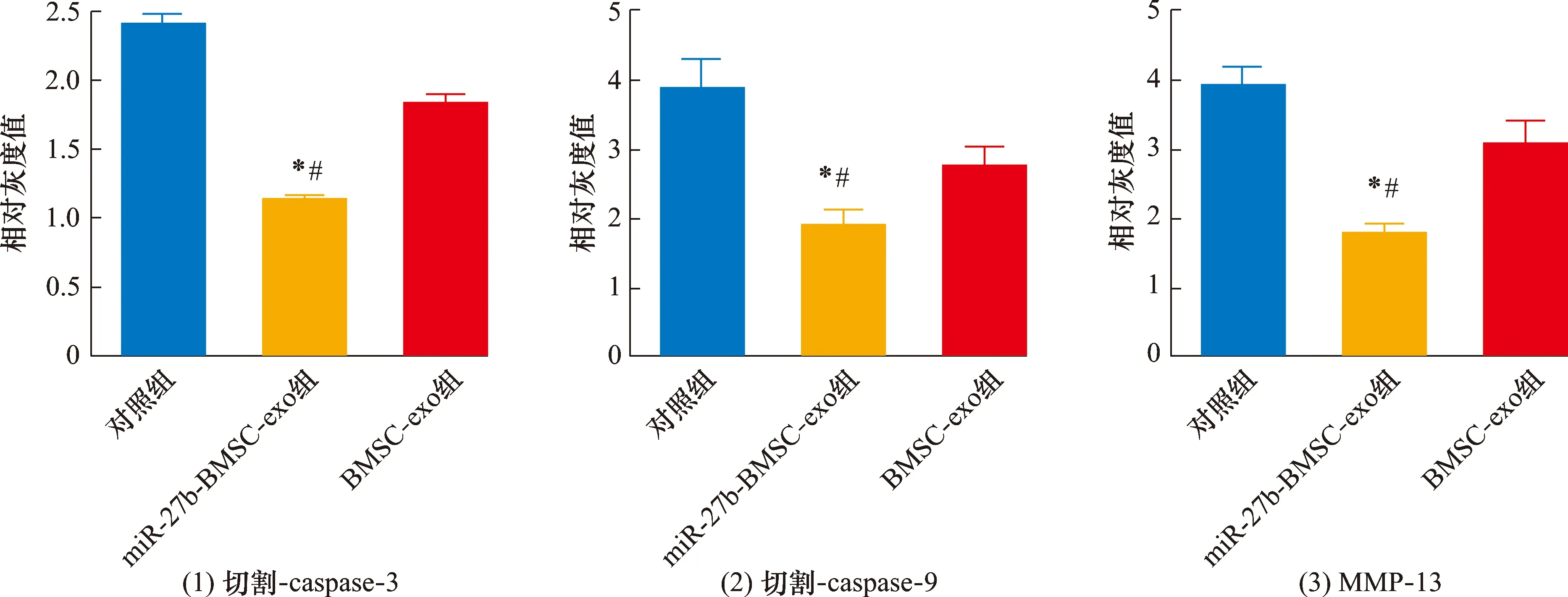
miR:microRNA;BMSC:骨髓间充质干细胞;exo:外泌体;caspase:半胱氨酸天冬氨酸蛋白酶;MMP:基质金属蛋白酶。
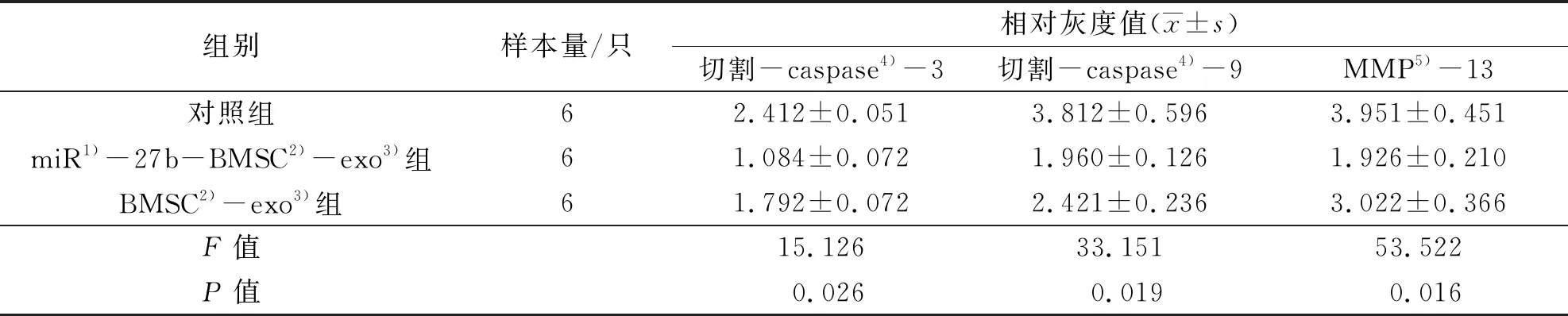
表5 骨软骨复合体移植后12周SD大鼠软骨组织中软骨损伤相关蛋白的表达结果
MMP家族是组织修复和重塑的重要调节酶。在关节中,MMP的过度表达会导致软骨基质的降解以及软骨细胞的凋亡,最终导致软骨的破坏,引起关节病变。Ⅱ型胶原蛋白占关节软骨基质胶原蛋白的90%~95%。研究表明,MMP-13对Ⅱ型胶原蛋白的降解作用最强,且Ⅱ型胶原蛋白亦被MMP-13优先降解[21-22]。MMP-13是与软骨退行性病变的发病机制密切相关的一种金属蛋白酶[23-24]。Piecha等[25]报道了一种强效的选择性MMP-13抑制剂,能够显著抑制人类骨关节炎中的软骨降解。因此,抑制MMP-13的表达是抑制软骨基质降解、促进软骨缺损修复的重要方法。Akhtar等[9]研究发现,大鼠软骨细胞被IL-1β刺激后,miR-27b的表达急剧下调,MMP-13的表达显著增加,而过量表达miR-27b的大鼠软骨细胞中,MMP-13的表达被显著抑制。Xu等[26]研究发现,在小鼠关节软骨中过表达miR-27b可以抑制Ⅹ型胶原蛋白和MMP-13的表达,并促进Ⅱ型胶原蛋白mRNA和蛋白水平上调。我们的早期实验也证实了miR-27b能够抑制大鼠软骨细胞中MMP-13的表达,而本研究采用miRNA-27b-BMSC-exo-chon-PLGA骨软骨复合体植入软骨缺损的SD大鼠,结果显示SD大鼠骨软骨移植修复软骨缺损的效果显著提高,而软骨损伤相关蛋白的检测结果也显示MMP-13的表达显著下降,提示其作用机制可能与miR-27b抑制MMP-13的表达,进而抑制软骨基质降解、促进软骨缺损修复有密切关系。
本研究结果表明,miRNA-27b-BMSC-exo-chon-PLGA骨软骨复合体移植治疗软骨缺损,能够显著提高治疗效果,其作用机制可能与抑制caspase-3、caspase-9以及MMP-13的表达、促进Ⅱ型胶原蛋白的表达有关,但具体的作用机制仍需进一步深入研究。
