翻转磷脂膜界面的氢键网络结构分子动力学研究*
2021-04-22黎维新潘记四曾宪彪唐国宁
黎维新,潘记四,曾宪彪,唐国宁
(1.广西科技师范学院机械与电气工程学院,广西 来宾 546100;2.广西师范大学物理科学与技术学院,广西 桂林 541004)
1 引言
众所周知,作为生物膜的骨架——磷脂双层膜的稳定性和流动性是一个疏水效应的结果,即磷脂分子为了尽量避免非极性的碳氢链暴露水中[1-3]。生物膜和其关联的界面水分子是有机体的关键成分,这是因为膜界面水分子的动态性质和氢键结构不仅反映了水分子与膜各种成分的相互作用,而且直接影响其机制,反过来调控生物膜的功能活性[4-5],所以生物膜的结构和功能与其水合水分子性质有很大关系。磷脂分子种类很多,主要结构多数是由亲水的头部基团和疏水的碳氢链组成,其中最常见的亲水头部基团是甘油-3-磷酸胆碱的磷脂分子(简称PC)[6]。磷脂分子头部有不同的带电基团与水分子的氢键作用,使得水分子就像被磷脂分子绑定了[7]。研究报道PC 磷脂分子的头部基团周围的水分子主要是与磷酸基团形成强氢键,而胆碱基团的周围存在6-10 个水分子相互作用形成笼型结构[7-9]。分子动力学研究表明磷脂分子的氧原子可以和1-3 个水分子形成氢键。PC 磷脂分子的不同氧原子与周围水分子形成的氢键数存在差异,这与它的氧原子在磷脂膜界面内的位置有关,靠近膜外面的氧原子氢键的数更多一些,氢键寿命短,远离膜界面的氧原子氢键寿命要更长,而且膜内的水分子间的氢键比膜外的体相水分子间的氢键寿命也更长[8,9]。还有,一个水分子存在同时和两个磷脂分子形成氢键的现象,也可能有一个水分子和同一磷脂分子的两个氧原子形成氢键的情况[9],被称为“氢键水桥”,氢键水桥使膜界面形成了一个庞大的氢键网络结构[9]。磷脂分子和水分子氢键作用与膜界面水分子的结构动态性质息息相关。膜界面水分子扩散增强被认为是打破了连接两个磷脂分子间的部分氢键水桥的原因[10]。实验证明膜界面水分子取向表现出一定的有序性,这被认为与磷脂不同的亲水基团形成氢键的水分子有关联[11-12]。不同磷脂分子种类和不同头部基团使膜界面性质也不一样,膜界面的氢键结构性质也有很大差异。最近Perttu E K 团队通过转换自然存在的PC 膜头部基团的磷酸基团和胆碱基团的位置,人工合成了一种新的磷脂分子——翻转磷脂(简称PCE)[13]。实验和分子模拟研究发现[13-16]:翻转磷脂膜有与相应的PC 膜一样的相转变温度,更大的磷脂分子平均面积,更高的小分子渗透率和更慢的头部转动相关函数,同时翻转磷脂氢键数发生变化,其磷酸基团的氢键数有所增加。显然,要理解生物膜的结构和功能,需要研究生物膜和界面水分子的相互作用,即要研究水分子与构成表面的生物分子相互作用。作为生物膜的主要成分,磷脂分子与膜界面水分子的氢键作用是膜界面相互作用的重要形式,这就需要我们进一步去认识磷脂分子的基团位置交换对膜界面氢键性质的影响。而氢键网络是磷脂膜与水分子氢键作用的重要特征,基团位置交换对膜界面氢键网络的结构和动力学的研究还没有报道。为此,我们利用分子动力学模拟研究了自然存在的DOPC 膜和相应的翻转磷脂膜DOPCE 膜系统的氢键行为的差异,以探究翻转磷脂分子头部基团位置变化对膜界面氢键网络的结构和动力学影响。
2 系统参数和计算方法
2.1 模拟参数设置
由72 个DOPC 分子组成的磷脂膜系统和由72 个DOPCE 分子组成的磷脂膜系统被运用分子动力学方法进行了研究,每个膜系统的磷脂分子与水分子的比例为1:32。两种磷脂分子结构如图1(a)和(b)所示,从图1 可以,两种膜差别在于交换了磷酸集团和胆碱集团位置。分子模拟的具体参数设置如下:系统经过平衡模拟后,再在NPT 系综跑了100ns 模拟进行数据的采集和分析。温度设置为303 K,使用Berendsen[17]热浴控制,温度耦合时间取0.1ps。系统压强设置为1bar,耦合时间为2.0ps。范德瓦尔斯相互作用选取1.2nm 的截断半径,长程静电作用计算使用的是PME 算法[18],1.2nm 截断半径。水分子力场参数选用SPC/E 水模型[19],磷脂膜力场来自经典磷脂膜Berger 力场[20]和Gromacs 参数[21]结合,系统的模拟运行都是在Gromacs4.5 下进行[20]。
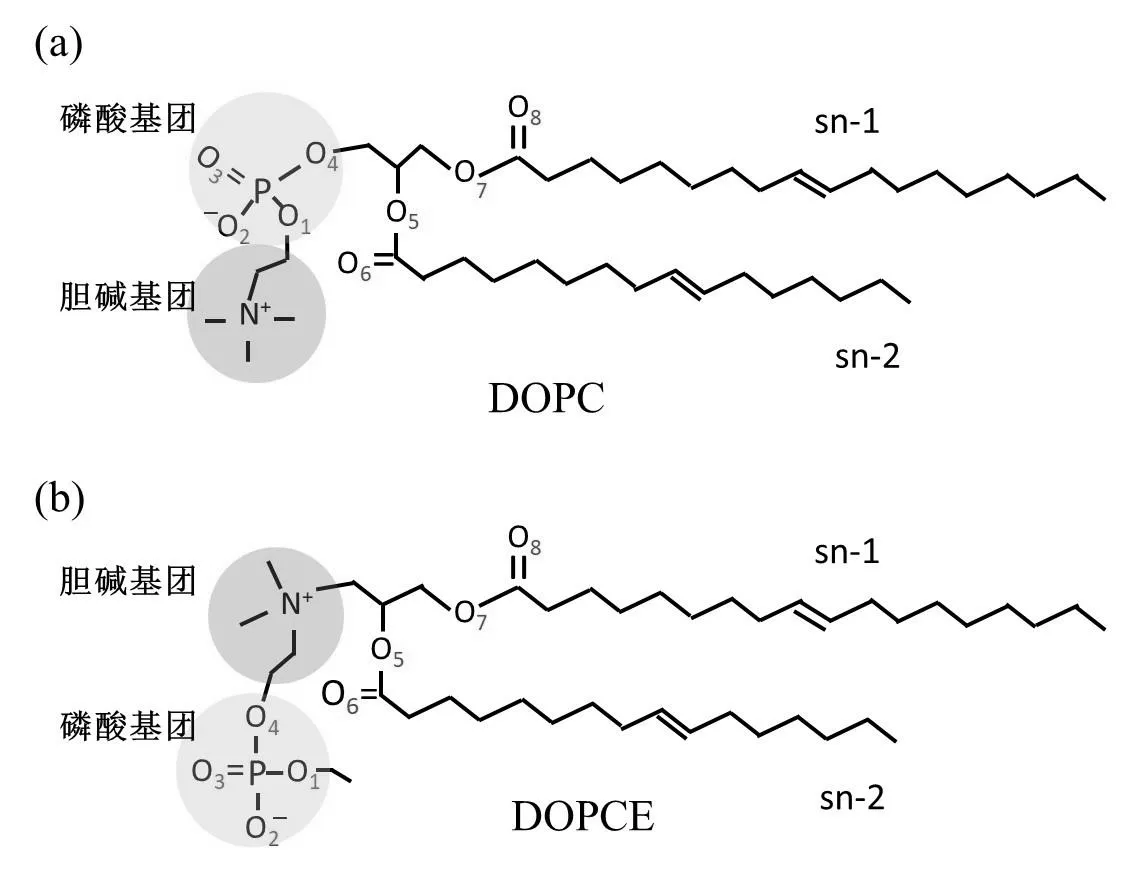
图1 DOPC 和DOPCE 磷脂分子结构图,图中用黄色标示磷酸基团,浅绿色标示了胆碱基团,红色数字表示了磷脂分子的8 个不同的氧原子。
2.2 氢键定义
氢键定义是采用的是Luzar 几何定义[22],该方法在分子动力学模拟研究中被广泛应用于氢键计算。具体定义如下:如图2 所示,设水分子氧原子与磷脂分子的氧原子距离为ROO,θ为ROO方向和水分子中氧原子和与磷脂氧原子形成氢键的氢原子的O-H 方向的夹角,当满足ROO<3.5 Å 且θ<30。,认为该水分子与磷脂氧原子形成了氢键。其中3.5 Å是膜系统的磷脂的氧原子关于水分子氧原子的径向分布函数曲线的第一极小值位置。
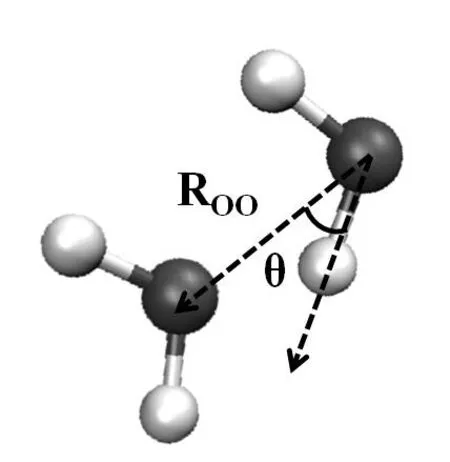
图2 氢键的几何定义示意图。图中红色的是氧原子,白色的是氢原子。
2.3 氢键相关函数
磷脂分子与水分子间的氢键相关函数可以用来表征氢键动态性,可以反映经过时间t后氢键还继续存在的概率大小。氢键相关时间函数C(t)定义如下[22]:

式中h(t)是水分子的存在函数,对于一个水分子与磷脂某个氧原子形成氢键开始计时为t0,此时氢键存在函数h(t0)取值1,经过时间t时,该氢键依然存在时h(t+t0)值为1,否则h(t+t0)值为0,其中<…>表示对所有的同类型的磷脂氧原子的与水分子氢键求平均。
3 结果与讨论
首先关注磷脂分子的氧原子形成的氢键情况。表1显示了DOPC和DOPCE磷脂分子的8个氧原子形成的平均氢键数。从表1可以看到,在DOPC磷脂分子中,磷酸基团的O2和O3在8个氧原子形成的氢键数是最多。O6的氢键数跟O2和O3的氢键数相当。还有O1和O8氢键数为0.44和0.55,也有相对可观的氢键数。而O4、O5和O7形成氢键数很少。至于DOPCE磷脂分子,O2和O3形成的氢键数也是最多的。但是O6形成的氢键数仅有DOPC磷脂分子的一半,存在明显差异。它的O1得氢键数却是DOPC磷脂分子一倍,这也是两膜系统氢键又一明显差异。至于O8,两种磷脂分子的氢键数相差并不明显。O1、O2、O3、O4是磷脂分子的磷酸基团中的4个氧原子,这里还注意到DOPC的磷酸基团的平均氢键数共为3.4,DOPCE的磷酸基团平均氢键数总共为4.26,表明DOPCE磷脂分子磷酸基团形成氢键数增多。而考虑整个分子形成氢键数情况,DOPC的氢键数为5.59,DOPCE的氢键数为5.47,DOPC磷脂分子形成的氢键数要比DOPCE的多一些。这表明由于磷酸基团和胆碱基团的位置互换,使DOPCE磷脂分子的磷酸基团更靠近膜外水分子,基团的氧原子形成氢键的机会增多,靠近疏水端的碳氧双键的氧原子氢键数减少了。

表1 DOPC 和DOPCE 磷脂分子的8 个氧原子的平均氢键数
磷脂分子的氧原子形成的平均氢键数仅是显示了哪些氧原子比较容易形成氢键,但是不能清晰地说明膜界面氢键网络的变化。本文统计了两个膜系统的磷脂分子间的氢键水桥和磷脂分子内的氢键水桥情况。图3(a)和(b)给出了磷脂分子内的两氧原子与同一个水分子形成氢键和磷脂分子间通过同一个水分子形成氢键连接在一起的情况,一个水分子与两个磷脂氧原子形成的氢键在这被称为“氢键水桥”。通过计算得到两膜系统的氢键水桥数据情况如下:整个DOPC系统中得到磷脂分子间的氢键水桥平均数目为65.69个,而DOPCE膜系统为30.73个;DOPC膜系统中同一个磷脂分子内的氢键水桥平均数是9.5个,而DOPCE膜系统的是23.39个。可见,基团位置的交换使DOPCE膜磷脂分子间的氢键水桥数减少了,增加了分子内氢键水桥数,表明DOPCE膜的氢键网络发生了明显的变化。

图3 (a)是DOPCE磷脂分子内的氢键水桥。(b)是DOPCE磷脂分子间的氢键水桥,图中黑色箭头标示了水分子的位置,红色虚线表示形成了氢键。图中红色的是氧原子,白色的是氢原子,蓝色的是氮原子,棕褐色的是磷原子,蓝绿色的是碳原子。
氢键水桥连接方式主要有三种:磷酸氧原子—水分子—磷酸氧原子(简写磷酸—磷酸);磷酸氧原子—水分子—碳氧双键氧原子(简写磷酸—C=O);碳氧双键氧原子—水分子—碳氧双键氧原子(简写C=O—C=O)。为了更加细致分析两个膜系统的膜界面的氢键网络结构的变化,本文详细计算了两个膜系统的氢键水桥连接方式比例,结果如图4和图5所示。从图4可以看出DOPC的磷脂分子内氢键水桥情况为:磷酸—磷酸为27.75%,C=O—C=O为36.99%,磷酸—C=O为35.26%。DOPCE的磷脂分子内氢键水桥情况为:磷酸—磷酸为59.51%,C=O—C=O为11.01%,磷酸—C=O为29.48%。通过比较可以发现,DOPCE的磷脂分子内的磷酸基团形成氢键水桥占比明显变大,C=O—C=O间的氢键水桥占比明显变小,而磷酸—C=O间的氢键水桥占比变化不大。至于磷脂分子间的氢键水桥,从图5可以看出磷脂分子间的氢键水桥情况,DOPC:磷酸—磷酸为26.34%,C=O—C=O为7.38%,磷酸—C=O为66.28%;DOPCE:磷酸—磷酸为12.34%,C=O—C=O为0.34%,磷酸—C=O为87.32%。从图5可以看出DOPC和DOPCE膜系统的磷脂分子间的连接主要都是通过磷酸与C=O间的氢键水桥连接。虽然两个膜系统的的磷酸基团氧原子形成氢键数最多,但是分子间的磷酸与C=O更易形成氢键水桥。DOPCE膜系统中分子间的C=O—C=O的氢键水桥几乎不存在,这也是翻转磷脂膜的一个明显变化。实验和理论表明翻转磷脂分子的头部基团的转动变慢,而DOPCE磷脂分子内的氢键水桥增加必然会约束磷脂头部的转动,这可能是翻转磷脂膜头部的转动变慢的另一原因。

图4 DOPC 和DOPCE 磷脂分子内氢键水桥类型占比

图5 DOPC 和DOPCE 磷脂分子间氢键水桥类型占比
为了研究磷脂分子与水分子间氢键的动态性质,本文计算了磷脂分子氧原子氢键相关函数,氢键相关函数可以反映经过时间t后磷脂氧原子还和原来的水分子形成的氢键存在的概率大小,通过比较氢键相关函数曲线的衰减还可以比较磷脂分子不同氧原子的氢键寿命的大小。这里仅对表1所示形成氢键数较多的五个氧原子(O1、O2、O3、O6、O8)的氢键相关函数进行计算,另外三个氧原子形成氢键很少,这里不做考虑。如图6所示是DOPC磷脂分子各个氧原子氢键相关函数曲线。从图可以看出DOPC磷脂分子各氧原子衰减快慢顺序为:O6>O8>O2>O3>O1。它呈现规律是靠近疏水碳氢尾链的O6和O8的氢键相关函数衰减慢,而靠近水相的磷酸氧原子的氢键相关函数则衰减要快一些。磷酸基团裸露的氧原子O2和O3比O1要慢一些。这些也关于其他类型的PC磷脂分子结果一致[8]。图7表示DOPCE磷脂分子氧原子氢键相关函数曲线,可以看见DOPCE磷脂分子中的氧原子氢键相关函数衰减快慢顺序为:O6>O1>O2>O8>O3。在DOPCE磷脂分子中靠近疏水的碳氢尾链O6依然衰减的最慢,紧接却是O1,这是与DOPC膜非常不一样的。至于O8,它比磷酸氧原子衰减要快一些,这也是与DOPC磷脂分子不一样的地方。所以相比DOPC,由于胆碱基团和磷酸基团的位置交换DOPCE磷脂分子的氧原子氢键动态性表现很大差异。特别注意到DOPCE的O1的氢键数和衰减都有明显变化,其中原因还是未知。
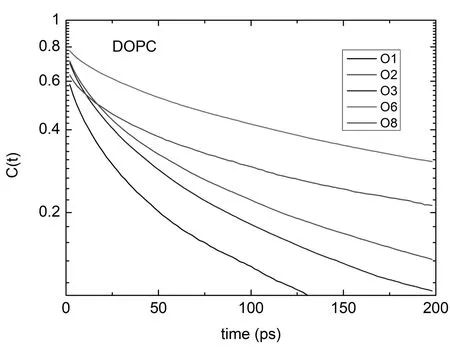
图6 DOPC 磷脂分子氧原子氢键相关函数纵坐标为以10 为底的对数坐标

图7 DOPCE 磷脂分子氧原子氢键相关函数纵坐标为以10 为底的对数坐标
4 结论
本文利用分子动力学模拟方法研究了自然存在的DOPC 膜和人工合成的DOPCE 膜界面的氢键网络结构和动态性质。发现和DOPC 膜相比,由于磷脂分子的磷酸基团和胆碱基团的位置交换,DOPCE 膜界面氢键网络表现很大差异。主要有:
(1)磷脂分子的氧原子氢键数存在差异,主要是DOPCE 磷脂分子的磷酸基团氢键数有所增加,其中O1 的氢键数增加明显,膜界面内部的O6 氢键数减少了一半。
(2)磷脂分子间氢键水桥数目和分子内氢键水桥存在差异,磷脂分子的磷酸基团和胆碱基团的位置交换导致DOPCE 磷脂分子间氢键水桥数目是减少,而其分子内氢键水桥数目是增加了,同时DOPCE 磷脂分子间氢键水桥数目和分子内氢键水桥连接形式占比也发生了变化。由于磷脂分子之间氢键对主要是磷酸基团与C=O 基团的间的连接,这会对磷脂分子头部转动进行约束,我们认为这可能是翻转磷脂膜头部基团转动变慢的原因之一。
(3)氢键相关函数存在差异,最显著的是DOPCE 磷脂分子的O1 氢键相关函数衰减变慢。
磷脂分子的磷酸基团和胆碱基团的位置交换使磷脂膜界面氢键结构的变化,其导致的膜功能变化仍需要未来理论和实验进一步探究。
