牡蛎中产广谱细菌素芽孢杆菌的筛选及鉴定
2021-04-22陈渊戈陶乐仁
王 伟,陈渊戈,迟 海*,陶乐仁
(1 中国水产科学研究院东海水产研究所 上海200090 2 上海理工大学医疗器械与食品学院 上海200093)
食源性致病菌的污染和增殖是严重威胁食品安全和公共健康的因素之一,成为人们关注的热点问题[1-2]。根据世界卫生组织最新的统计数据,世界上每年有近十分之一的人因食品污染而患病,近42 万人死于食源性疾病[3]。食品添加剂作为延长食品货架期的一种手段,可以抑制食源性致病菌的生长,然而食品添加剂潜在危害及添加剂量成为消费者担忧的问题[4]。同时,抗生素作为主要抑制食源性疾病的源头药物,其长期滥用导致食源性致病菌的耐药性问题愈发严重[5]。鉴于此,研究人员不断寻找天然的防腐剂以及不易产生耐药性的天然抗菌物质作为食品添加剂及抗生素的替代品。
细菌素是细菌核糖体内合成的一类具有抑菌活性的多肽或蛋白类物质,主要对亲缘关系较近的微生物有一定的抑制作用[6]。细菌素具有高效、无毒、稳定性强、无残留以及不易产生抗药性等优点,被普遍认为是抗生素及化学添加剂的替代物之一[7-8]。目前真正用于商业化的乳酸菌细菌素仅有乳酸链球菌素(nisin)和片球菌素(pediocin PA-1)[9]。造成这种现象的原因主要是乳酸菌细菌素的性质(如有些乳酸菌细菌素抑菌谱窄、pH 敏感性及热稳定性差)和分离纯化方法等诸多因素限制了乳酸菌细菌素的获取及其工业化生产[10-11]。筛选具有广谱抑菌作用,pH 耐受范围广,热稳定性好的新型细菌素对食品安全具有重要意义。
芽孢杆菌(Bacillus sp.)作为动植物和微生态的优势菌,不仅种类繁多、稳定性强,而且广泛存在于自然界中[12-13]。由芽孢杆菌中地衣芽孢杆菌(B.licheniformis)、枯草芽孢杆菌(B.subtilis)、凝结芽孢杆菌(B.coagulans)等产生的细菌素也逐步被关注和发现[14-21]。本研究从福建霞浦海域的牡蛎中分离出不同的细菌,并以常见的食源性致病菌:金黄色葡萄球菌(Staphylococcus aureus)、蜡样芽孢杆菌(B.cereus)、副溶血性弧菌(Vibrio parahemolyticus)等为指示菌,系统筛选具有广谱抑菌作用的产细菌素的细菌。其中分离出具有广谱抑菌活性的14 株细菌经16s rDNA 基因鉴定为芽孢杆菌。这些芽孢杆菌所产的细菌素主要是由核糖体合成,并具有热稳定性和酶敏感性等特点。结合Tricine-SDS-PAGE 电泳试验结果及LC-MS/MS鉴定,潜在细菌素的分子质量范围及对应的氨基酸序列均显示上述广谱细菌素可能未被发现。本研究发现的新型广谱细菌素期望为细菌素的开发利用及其在食品安全领域的应用提供基础数据。
1 材料与方法
1.1 样品
牡蛎产自福建霞浦海域,样品放置于-18 ℃运至实验室备用。
1.2 试验设备与试剂
1.2.1 试验设备 低温恒温培养箱 (MIR-153),日本三洋(SANYO)电机公司;立式压力蒸汽灭菌器(YXQ-LS-50 SII),上海博迅实业有限公司医疗设备厂;水平电泳槽及成像系统,美国Bio-rad公司;超净工作台(SEX-TJ),上海整新电子设备;天平YP200N,上海菁海仪器有限公司;PCR 仪(2720 Thermal Cycler),美国Thermo 公司;样品处理仪(MP Fastprep-24),美国MP 公司。
1.2.2 主要试剂 琼脂粉,上海蓝季生物科技有限公司;甘油、琼脂糖,均购于国药;基因组DNA提 取试剂盒、DNA Maker、4s Green 无毒核酸染料、PCR 引物,上海生工生物技术有限公司;Taq酶、ddH2O,上海拜力生物科技有限公司;脑心浸出液(Brain Heart Infusion,BHI)培养基、乳酸菌培养基(MRS),英国OXIOD 公司。
1.2.3 指示菌株 本次试验的指示菌株均由中国水产科学研究院东海水产研究所保存,所需的指示菌及培养条件等见表1。
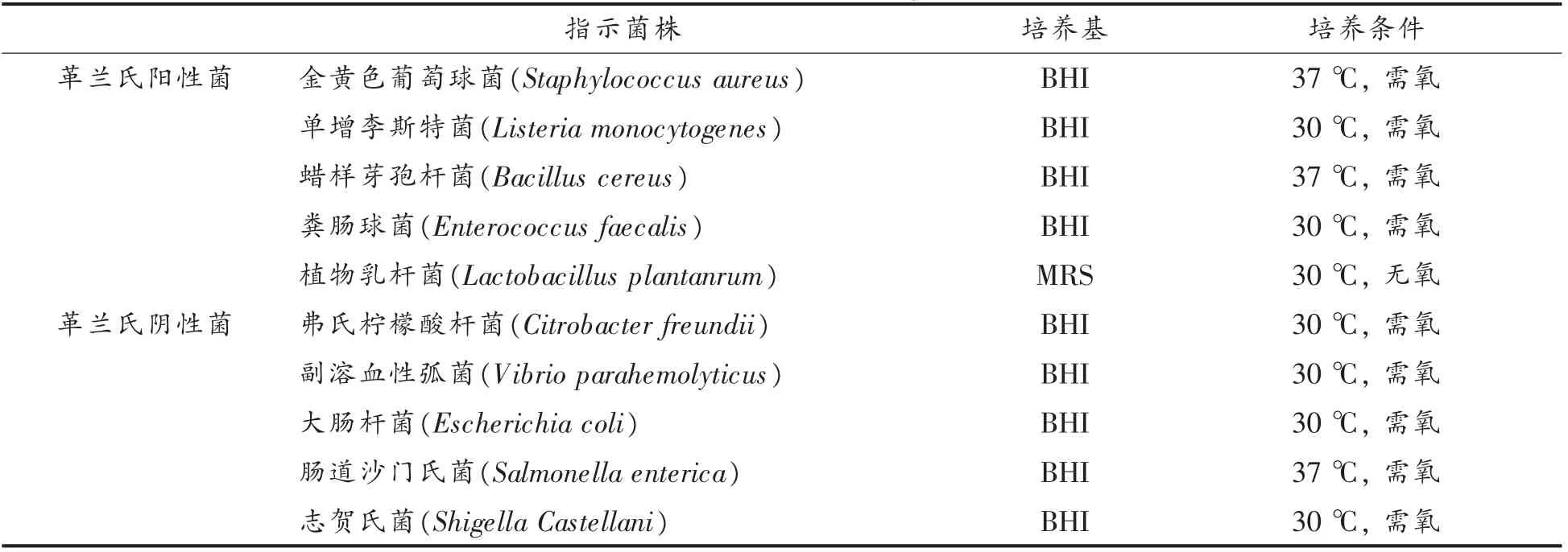
表1 指示菌株及其培养条件Table 1 Bacterial strains and their growth conditions
1.3 试验方法
1.3.1 样品处理 无菌条件下,称取10 g 牡蛎肉剪碎研磨,添加到装有90 mL 生理盐水的样品处理袋中,将样品在处理器中均质混匀2 min,用生理盐水梯度稀释至10-4备用。
1.3.2 菌株分离与培养 采用稀释涂布平板法对细菌进行单菌落分离。分别从10-3、10-4两个稀释度的稀释液中吸取100 μL 样品液于BHI 培养基上,均匀涂布后置于30 ℃条件下过夜培养。长出菌落后,无菌条件下挑选单菌落,接种于5 mL BHI 液体培养基中,置于30 ℃条件下过夜培养。
1.3.3 产细菌素菌株的筛选
1.3.3.1 初筛 采用琼脂点种法进行细菌素初筛试验[14]。将100 μL 过夜培养的指示菌添加到5 mL BHI 培养基(含0.8%的琼脂粉)中,倒入BHI培养基(含2.5%的琼脂粉)上,均匀平铺。待其冷却凝固并且干燥后,吸取2 μL 指标菌进行点样,置于30 ℃条件下过夜培养。培养结束后,在培养基上出现明亮抑菌圈的则认为有抑菌活性,能抑制相应的指示菌。对有抑菌活性的菌株在体积分数13%的甘油中保存,置于-20 ℃保存备用。
1.3.3.2 细菌素对热和酶的稳定性测试
1)细菌素的热稳定性试验:将过夜培养的指标菌液在10 000 r/min 条件下离心5 min。将上清液在沸水中放置15 min,然后冰上冷却5 min。吸取3 μL 加热后的上清液,进行琼脂点种法进行抑菌,未经热处理的上清液作为对照。
2)细菌素对酶的稳定性测试:将指标菌过夜培养,吸取2 μL 菌液,采用琼脂点种法进行抑菌试验;在点过指标菌位置的边缘,点上1 μL 质量浓度为20 μg/mL 的蛋白酶K,30 ℃条件下过夜培养。未经蛋白酶K 处理的菌液作为对照。
1.3.4 产细菌素菌株的分类鉴定
1.3.4.1 形态特征 参照文献[22]进行菌株形态特征鉴定。将菌株接种于BHI 平板,37 ℃过夜培养,观察各个平板菌落形态,采用革兰氏染色法观察细菌形态。
1.3.4.2 菌株基因组DNA 提取,PCR 扩增和菌株鉴定 对具有抑菌效果的指标菌,按生工Ezup 柱式细菌基因组DNA 抽提试剂盒(上海生工)提供的使用方法提取其DNA。以指示菌基因组DNA作为PCR 扩增的模板,采用通用引物15F 和12R(表2)进行PCR 扩增[23]。PCR 反应体系(50 μL):Taq PCR Master Mix(2x,blue dye)(上海生工)25 μL,上游引物 (10 μmol/L)2 μL,下游引物(10 μmol/L)2 μL,基因组DNA 模板2 μL,双蒸水19 μL。扩增反应条件为:94 ℃预变性4 min;进入PCR 循环阶段后,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30 个循环;72 ℃延伸10 min,4℃保存。PCR 产物经1.5%的琼脂糖凝胶电泳后在UV 灯下观察到扩增条带后将未纯化的PCR 产物送至生工生物工程(上海)股份有限公司进行菌种鉴定。测序结果所得的基因序列通过在NCBI 的Blast 检索系统数据库中进行BLAST 序列比对。
1.3.5 重复片段基因指纹分析 (Repetitive-element genomic PCR fingerprinting,rep-PCR)以细菌基因组DNA 为模板,参考Silva 等[24]的方法,利用设计的BOX 引物[25](引物序列见表2)进行rep-PCR 扩增。待扩增完成后,将PCR 产物进行1.5%的琼脂糖凝胶电泳并在UV 灯下观察电泳结果。
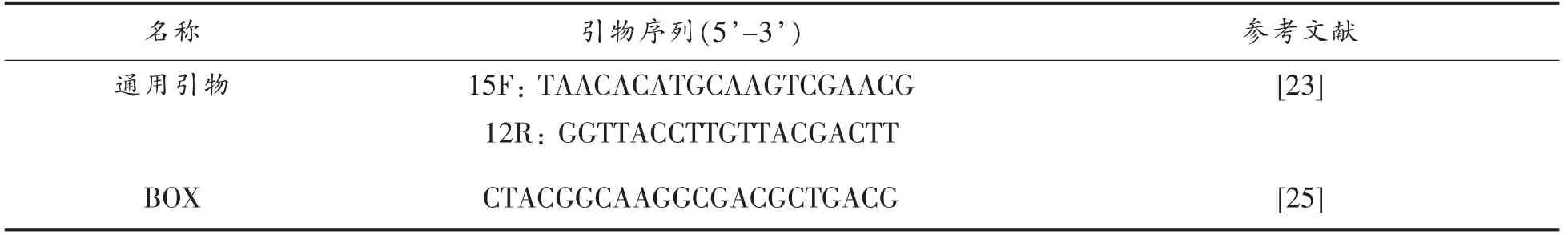
表2 PCR 扩增引物序列信息Table 2 Primer sequence information of PCR amplifications
1.3.6 系统发育树 将校正并拼接后的序列在Gen Bank (http://www.ncbi.nlm.nih.gov/blast)中进行同源序列的搜索,由rep-PCR 得到的大致条带情况,从差异估计出发,采用层次UPGMA 法(Unweighted Pair-Group Mean Average),根据供试菌株的rep-PCR 扩增条带的大小,采用二进制方法,生成系统发育树。
1.3.7 质粒提取 将产细菌素芽孢杆菌菌株过夜培养,利用质粒提取试剂盒(OMEGA bio-tek,上海),根据试剂盒上的介绍对过夜培养的产细菌素芽孢杆菌菌株进行质粒提取。将提取好的质粒DNA 在1.5%的琼脂糖凝胶下进行电泳并在UV灯下观察电泳结果。
1.3.8 细菌素粗提
1.3.8.1 硫酸铵盐析沉淀法 按1%接种量将过夜培养好的产细菌素芽孢杆菌接种到250 mL 的BHI 液体培养基中,置于30 ℃培养至少12 h。将上述过夜培养好的菌液于4 ℃,10 000 r/min 离心条件下离心25 min,在上清液中添加45%的饱和硫酸铵搅拌溶解,置于4 ℃过夜。将过夜的溶液在10 000 r/min 条件下离心30 min,将沉淀溶解于5 mL 磷酸盐缓冲液PBS(pH 6.86)中,即得到细菌素粗提物。
1.3.8.2 凝胶过滤层析 以Sephadex G-25 为凝胶填料,超纯水进行预洗脱后再用PBS 洗脱柱子,细菌素粗提物5 mL 上样,流速0.5 mL/min,先使用PBS 进行洗脱,之后用0.2,0.5 mol/L 的氯化钠(NaCl)依次进行洗脱,收集洗脱液。分别对收集的洗脱液进行抑菌试验(吸取2 μL 粗提物抑制蜡样芽孢杆菌),将有抑菌效果的洗脱液进行冻干浓缩后复溶于pH 6.86 的PBS 中置于-20 ℃备用。
1.3.9 三羟甲基甘氨酸-SDS-PAGE 电泳(Tricine-SDS-PAGE)参 考Schägger 等[26]的 方法,将冻干浓缩好的细菌素粗提纯物质在Tricine-SDS-PAGE 进行电泳。其中胶质量分数分别为夹层胶10%,浓缩胶4%,分离胶16.5%。采用分子质量3.3~20.1 ku 的肽Marker(Solarbio)作为标准对照。电泳结束后使用考马斯亮蓝G 250 进行染色脱色,将电泳胶在Bio-rad 成像系统下记录结果。
1.3.10 液相色谱-串联质谱联用 将产细菌素芽孢杆菌菌株在30 ℃条件下过夜培养,将培养好的菌液在10 000 r/min 条件下离心30 min,取上清液加热15 min 处理后,参考Sun 等[27]的方法,将上清液通过液相色谱-串联质谱联用 (Liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析蛋白质分子质量。利用现有蛋白质组学信息库(Omicsbean)对获得的蛋白质进行对比分析。
2 结果与讨论
2.1 产细菌素菌株的筛选及鉴定
从牡蛎中初步筛选出的对常见食源性致病菌有抑菌活性的菌株有14 株 (命名为O、S、18、19、26、27、4、6、4-1、F1、F2、F4、Y1、Y2)。这些细菌在平板上具有典型的芽孢杆菌形态,即菌体扁平、粗糙不透明、边缘不整齐、微黄色,且革兰氏染色后结果均呈阳性。这14 株菌对常见致病菌的抑菌谱见表3。其中O、18、19、26、27、4-1、F1、F2、F4、Y1、Y2 等菌株具有广谱抑菌性,不仅对金黄色葡萄球菌(S.aureus)、蜡样芽孢杆菌(Bacillus cereus)、植物乳杆菌(L.plantanrum)等革兰氏阳性菌具有较好的抑菌效果,而且对弗氏柠檬酸杆菌 (C.freundii)、副溶血性弧菌(V.parahemolyticus)、大肠杆菌(E.coli)、肠道沙门氏菌(S.enterica)、福氏志贺氏菌(Shigella flexneri)等革兰氏阴性菌也具有很好的抑制作用。另外,由表3还可以看出,菌株18、19、26、27 具有相似的抑菌谱,菌株F1、F2、F4、Y1、Y2 等抑菌能力也十分相似。

表3 14 株芽孢杆菌菌株的抑菌谱Table 3 Antibacterial spectrum of 14 strains of Bacillus
将具有抑菌活性的细菌送检测序,其测序结果经过在NCBI 上进行Blast 序列比对,发现这14株指标菌株与芽孢杆菌属同源性最高,均高达99%以上,可初步判断其均属于芽孢杆菌属。其中,O 为解淀粉芽孢杆菌 (B.amyloliquefaciens),18、19、26、27 以及F1、F2、F4、Y1 和Y2 等菌株均为枯草芽孢杆菌 (B.subtilis),4、6、S 分别为短小芽孢杆菌(B.pumilus)、厦门芽孢杆菌(B.xiamenensis)、蜡样芽孢杆菌(B.cereus),4-1 为死亡谷芽孢杆菌(B.vallismortis)。
2.2 细菌素对热和酶的稳定性测试
细菌生长过程中产生的抑菌物质除了细菌素外,还可以代谢产生有机酸、抗生素和H2O2等其它具有抑菌活性的物质。为了排除其它干扰因素,通过加热处理和酶处理方式确定抑菌物质为细菌素。筛选出的14 株菌在加热后保持较好的抑菌活性。此外,经过蛋白酶K 处理的平板点菌处抑菌圈不完整,这一结果说明抑菌活性物质是热稳定性强的细菌素。
2.3 重复片段基因指纹分析(rep-PCR)和系统发育树构建
为了确定同一种属的细菌基因型是否一致,本试验通过利用特殊设计的引物即BOX 引物对抑菌谱相似且鉴定结果相似的菌株的DNA 进行rep-PCR 扩增,确定其相应的基因图谱,以便进一步对细菌进行区分。Rep-PCR 扩增产物经琼脂糖凝胶电泳后的结果如图1。结果显示,18、26、27 的扩增产物基因图谱基本一致,即重复片段基本一致,可以初步判断为一种菌;F1、F2、F4、Y1、Y2 等菌株的基因图谱也呈现出一致性,可判断为同一种菌;4-1 与F1、F2、F4、Y1、Y2 的rep-PCR 扩增产物在<1.0 kb 相似,但在>1.0 kb 处条带略有不同,初步判断是同属但不同种的菌;O、S、4、6、4-1的条带各不相同,可以判断为同一种属的不同菌。
根据rep-PCR 扩增条带结果,采用二进制方法,利用UPGMA 软件构建得到相应的系统发育树(如图2)。结果显示菌株Y1、F4、Y2、F2、F1 的同源性较高,另外,菌株18、26、27 位于一个分支簇,该结果与rep-PCR 结果一致。鉴于rep-PCR基因指纹图谱和系统发育树的结果,结合芽孢杆菌抑菌谱范围,可以初步判断O、19、F 和4-1 与其它细菌不同,因此后续将选用这4 株产细菌素芽孢杆菌用于进一步试验。
2.4 质粒提取
细菌素是通过核糖体合成产生的抑菌物质。通常情况下细菌素通过在染色体上编码产生,也可以通过质粒产生,也有一些细菌素的合成是受染色体和质粒的双重调控产生[28-31]。为了确定上述细菌素产生的位置,本试验通过提取质粒中DNA,初步判断编码细菌素的基因是否位于质粒,以便于进一步对编码细菌素的基因序列或者结构分析提供依据。结果发现,这4 株细菌未发现质粒。这一结果说明这些芽孢杆菌主要是通过染色体上的编码基因产生细菌素。
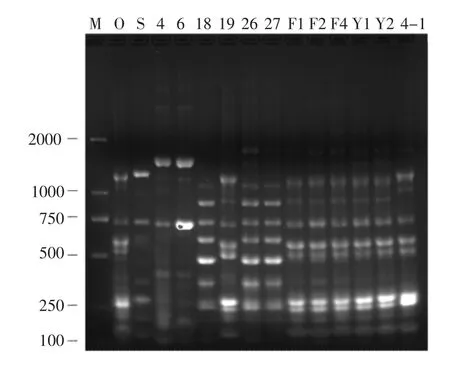
图1 Rep-PCR 扩增产物经1.5%琼脂糖凝胶电泳结果Fig.1 Rep-PCR amplification products via 1.5%agarose gel electrophoresis

图2 基于rep-PCR 图谱构建的系统发育树Fig.2 Phylogenetic tree based on rep-PCR mapping results
2.5 细菌素粗提
硫酸铵提取得到的细菌素粗提物对蜡样芽孢杆菌有明显的抑菌效果。用PBS 和0.2 mol/L NaCl溶液洗脱经硫酸铵得到的细菌素粗提物并分别收集其洗脱液然后冻干。经抑菌试验发现经过PBS和0.2 mol/L NaCl 洗脱的组分可以较好地抑制蜡样芽孢杆菌(图3)。
2.6 三羟甲基甘氨酸-SDS-PAGE 电泳结果
图4是产细菌素芽孢杆菌的Tricine-SDSPAGE 电泳结果。由于Tricine-SDS-PAGE 电泳可以较好地分离<30 ku 的蛋白,因此选用3.3~20.1 ku 的标准蛋白做对照。与Marker 条带对比可知菌株O 在14.4 ku 左右时有一条较为明显的条带。菌株19 在8 ku 和18 ku 处有明显的蛋白条带。菌株F 则在8 ku 处、14.4 ku 左右均出现明显的条带。菌株4-1 在14.4 ku 左右时有一条蛋白条带。4 株芽孢杆菌的Tricine-SDS-PAGE 电泳结果可以初步判断出其所产细菌素的分子质量均小于20 ku。该结果也表明这些菌株所产细菌素可能为热稳定性较好的II 类小分子蛋白。
2.7 LC-MS/MS 鉴定结果
表4为产细菌素芽孢杆菌的LC-MS/MS 鉴定结果。结合Tricine-SDS-PAGE 电泳试验结果可以初步判断菌株O 所产细菌素可能为13 ku 大小的含有DUF1093 结构域的蛋白质、13.506 ku 大小的YlbF 家族监管蛋白及18.877 ku 的1 型谷氨酰胺转移酶;菌株19 产生的细菌素可能为8.969 ku 的假设蛋白CXF51_07005、16.871 ku 大小的SPBc2原噬菌体衍生的蛋白质YolA 以及18.001 ku 大小的假设蛋白BEST7613_2224;菌株F 所产细菌素可能为分子质量大小为8.089 ku 的假设蛋白C1T28_21195、13.011 ku 大小的降解酶(加氧酶)、15.786 ku 大小的holin 家族蛋白质以及分子质量为17.082 ku 的SMI1/KNR4 家族蛋白;菌株4-1产生的细菌素可能对应为9.439 ku 的小分子质量的酸溶性孢子蛋白Tlp 或是分子质量为22.529 ku 的3-己酮糖-6-磷酸合成酶。目前的结果与蛋白数据库内已编号的蛋白比较,没有完全一致的蛋白相匹配,表明本研究中发现的细菌素不排除为新型细菌素的可能。细菌素进一步纯化,氨基酸序列比对和产细菌素的细菌全基因组序列进行测序分析,从而准确判断这4 株芽孢杆菌所产细菌素是否为新型细菌素。

图3 细菌素粗提物对蜡样芽孢杆菌2805 的抑菌作用Fig.3 The antibacterial effect of the initial extract of bacteriocin on strain B.cereus 2805

图4 三羟甲基甘氨酸-SDS-PAGE 电泳结果Fig.4 Results of Tricine-SDS-PAGE electrophoresis

表4 产细菌素芽孢杆菌菌株的LC-MS/MS 鉴定结果Table 4 Identification results of LC-MS/MS of bacteriocin producting from Bacillus sp.
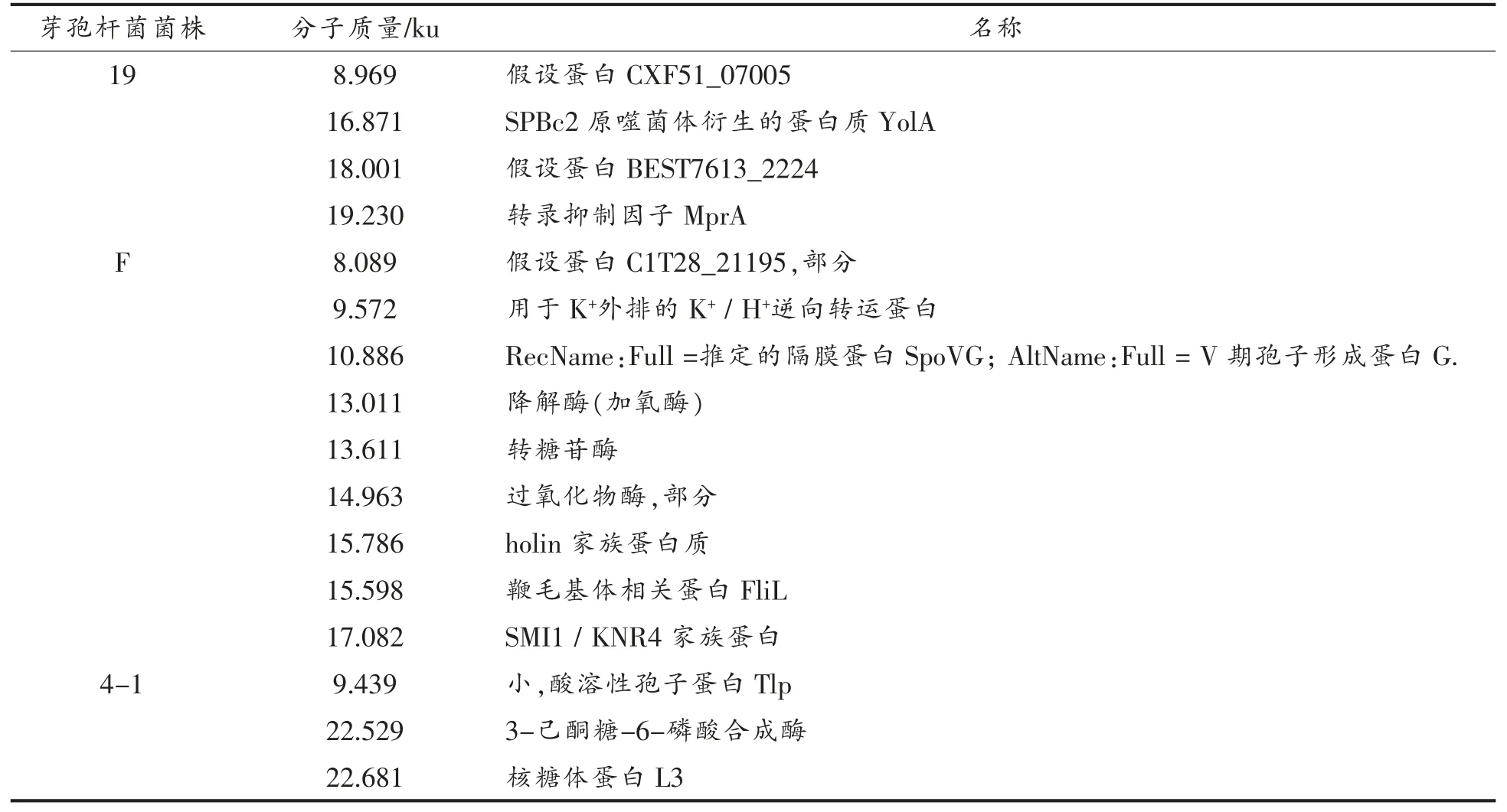
(续表4)
3 结论
本研究从福建牡蛎中分离筛选出14 株对常见致病菌有抑菌活性的芽孢杆菌菌株,通过抑菌试验发现这些芽孢杆菌对金黄色葡萄球菌、蜡样芽孢杆菌、植物乳杆菌等革兰氏阳性菌及弗氏柠檬酸杆菌、副溶血性弧菌、大肠杆菌、肠道沙门氏菌、志贺氏菌等革兰氏阴性菌均有一定的抑菌作用。同时,这些芽孢杆菌产的细菌素具有热稳定性强、易被蛋白酶分解和由核糖体编码合成产生细菌素等典型细菌素特征。根据14 株菌的抑菌谱范围和rep-PCR 结果,初步判断4 种菌株可能不同于其它芽孢杆菌。因此,选取这4 株菌O(解淀粉芽孢杆菌),4-1(死亡谷芽孢杆菌),19 和F(枯草芽孢杆菌)进行下一步试验。通过Tricine-SDSPAGE 电泳试验,这4 株芽孢杆菌产的细菌素分子质量均不大于20 ku。说明上述4 株细菌可能产II 类乳酸菌细菌素。利用LC-MS/MS 鉴定并比对现有蛋白质数据库,结果显示这4 株芽孢杆菌所产细菌素未在现有数据库中发现,细菌素进一步纯化,氨基酸序列比对和产细菌素的细菌全基因组序列进行测序分析仍需在未来试验中进行,从而准确确定这4 株芽孢杆菌的细菌素性质。
