miRNA-125a靶向调控Bcl-2对癫痫大鼠神经元凋亡的影响
2021-04-22裴静陈明高华白杨王萍
裴 静 陈 明 高 华 白 杨 王 萍
(新疆医科大学第五附属医院神经内科,乌鲁木齐 830000)
癫痫是一种临床上表现为反复性、刻板性、暂时性及发作性的脑部疾病。由于感觉、意识、精神、运动、行为等发生了功能性障碍,给患者带来沉重的心理及生理负担[1-2]。microRNAs(miRNAs)是一组不具有编码功能的小分子RNA,通过调控转录后水平的基因表达参与细胞调控,有研究表明其可能涉及癫痫发生发展的过程[3]。miRNA-125a可在多种疾病中发挥重要作用,如癌症、心血管疾病和自身免疫性疾病等,并通过调节凋亡相关基因对细胞增殖和凋亡产生重要影响[4-6]。因此,本研究探讨miRNA-125a对癫痫大鼠神经元凋亡的影响,为临床治疗癫痫提供新的思路及理论依据。
1 材料与方法
1.1 实验动物及分组
选择清洁级SD雄性大鼠32只,8~12周,体质量200~240 g,购自中国科学院昆明动物研究所,实验动物生产许可证号:SCXK(滇)K2016-0001。将32只大鼠随机分为4组,正常对照组(A组)、癫痫组(B组)、miRNA-125a antagomir control组(C组)、miRNA-125a antagomir组(D组)。
1.2 实验主要试剂
miRNA-125a antagomir、antagomir NC(广州锐博生物科技有限公司);TUNEL原位凋亡检测试剂盒、DAB显色试剂盒(上海碧云天生物科技有限公司);荧光素酶检测试剂盒(Promega);Trizol(Invitrogen);miR-125a、U6、Bcl-2、GAPDH qPCR上下游引物[生工生物工程(上海)股份有限公司];Bcl-2兔单克隆抗体、β-actin兔单克隆抗体、山羊抗兔二抗(Santa)。
1.3 建立动物模型
采用经典的氯化锂-匹罗卡品注射法[7]:腹腔注射127 mg/kg的氯化锂,12 h后腹腔注射10 mg/kg溴化甲基阿托品,30 min后再次腹腔注射100 mg/kg的匹罗卡品。经典癫痫发作标准分为6级:0级:实验大鼠无任何异常反应;Ⅰ级:大鼠出现面部节律性抽动;Ⅱ级:大鼠出现甩尾或是点头行动;Ⅲ级:大鼠某一肢体出现抽动动作;Ⅳ级:大鼠躯体僵直或是四肢抽动;V级:大鼠完全僵直,并出现阵挛。大鼠癫痫发作在Ⅳ级以上且发作解除后状态良好,则癫痫大鼠模型建立成功。正常对照组:采用等量生理盐水代替氯化锂-匹罗卡品,其他处理方式与癫痫组相同;癫痫组:选择建模成功的大鼠侧脑室注射生理盐水;miRNA-125a antagomir组:选择建模成功的大鼠侧脑室注射miRNA-125a antagomir,转染终浓度为50 nmol/L;miRNA-125a antagomir NC组:选择建模成功的大鼠侧脑室注射miRNA-125a antagomir NC,转染终浓度为50 nmol/L;其中,antagomir NC是含miRNA成熟体的双链无功能基因序列并不表达基因功能,miRNA-125a antagomir是根据miRNA-125a成熟体设计并针对提高体内稳定性而经过特殊化学修饰的miRNA拮抗剂,发挥抑制miRNA作用。各组处理7 d后麻醉解剖大鼠。
取出大鼠脑后沿矢状缝将脑组织一分为二。其中一侧脑组织置于预冷的4% 多聚甲醛中固定,常规切片后用于HE染色及海马神经元凋亡细胞检测;另一侧脑组织保存于-80 ℃,用于总RNA和蛋白提取。
1.4 观察指标
1.4.1qRT-PCR检测各组大鼠脑组织miRNA-125a表达水平:取脑组织于液氮中研磨,加入1 mL Trizol提取总RNA。采用逆转录试剂盒将总RNA逆转录成cDNA,取1 μL cDNA作为模板进行qRT-PCR扩增。反应条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃、30 s,共40个循环,最后72 ℃延伸10 min。每个样本重复检测3次,每组基因的相对表达量按公式(2-△△Ct法)计算。引物设计见表1。

表1 qRT-PCR扩增引物序列Table 1 Pimer sequences of qRT-PCR
1.4.2HE检测各组大鼠脑海马组织病理形态学改变:处死大鼠取脑分离海马组织用0.9%生理盐水漂洗、滤纸吸干,放入4% 多聚甲醛固定48 h,然后进行脱水、石蜡包埋、切片。病理切片厚度为4 μm。将病理切片放置于65 ℃烘箱2 h后,依次放入二甲苯10 min、无水乙醇、95%乙醇、90%乙醇、85%乙醇、75%乙醇、50%乙醇各5 min。苏木素-伊红染色。中性树脂封片,镜下观察脑海马组织CA-1区形态及病理改变。
1.4.3TUNEL法检测脑海马神经元细胞凋亡数:将脑海马组织切片后,采用抗原修复脱蜡,PBST洗涤3次。根据TUNEL试剂盒操作说明进行操作。用蛋白酶K(20 mg/mL)消化,滴加平衡缓冲液,孵育30 min,弃去缓冲液,滴加TdT缓冲液孵育,再孵育于TUNEL反应液中。用0.01 mol/L的PBS进行漂洗后滴加碱性磷酸酶,再用PBS漂洗。最后置于碱性磷酸酶显色底物(NBT/BCIP)溶液中,避光显色后在荧光显微镜下进行观察,正常细胞核为蓝色,凋亡细胞核为棕黄色,于高倍镜下随机计数10个视野,计算凋亡细胞数。
1.4.4Western blot和qRT-PCR法检测各组大鼠脑组织中Bcl-2的表达水平:取脑组织加入预冷的RIPA裂解液,冰浴放置30 min,提取总蛋白并进行定量。进行10% SDS-PAGE电泳,将蛋白条带转移至PVDF膜上,分别加入含有Bcl-2抗体(1∶1 500稀释)的脱脂牛奶中4 ℃过夜。洗膜后,加入二抗(1∶5 000稀释)室温孵育1 h,洗膜,取适量ECL试剂显影5 min,采用凝胶成像数码分析系统进行定量分析。
1.4.5荧光素酶活性检测miRNA-125a与Bcl-2的靶向关系:为进一步确定miRNA-125a与Bcl-2靶向关系,将Bcl-2的3′-UTR序列及突变后的3′-UTR序列克隆到野生型Bcl-2-3′UTR(Wt)和突变型Bcl-2-3′UTR(Mut)。将该载体和miRNA-125a模拟物共转染N1E-115细胞,常规培养48 h后使用荧光素酶活性检测试剂盒检测荧光值。
1.5 统计方法

2 结 果
2.1 各组大鼠行为学观察结果
造模后,各组均未出现大鼠死亡,B组、C组和D组大鼠均出现全身强直抖动,继而出现反复前肢痉挛、跌倒、翻转等,继而进入癫痫状态。7 d后,B组和C组大鼠出现癫痫自发发作,进食明显减少,毛发无光泽,而D组大鼠发作次数明显减少,进食情况及毛发均较B组和C组良好。A组大鼠一切表现正常。
2.2 各组大鼠脑组织miRNA-125a表达水平
qRT-PCR结果显示,与A组(0.52±0.11)相比,B组(1.36±0.10)和C组(1.39±0.08)大鼠脑组织miRNA-125a表达升高,差异具有统计学意义(P<0.05);D组miRNA-125a表达(1.13±0.09)与C组相比降低(P<0.05)。见图1。

图1 各组大鼠脑组织miRNA-125a表达水平注:与A组相比,*P<0.05;与C组相比,#P<0.05Fig.1 Expression level of miRNA-125a inbrain tissue of rats in each groupNote:Compared with group A, *P<0.05;Compared with group C, #P<0.05
2.3 各组大鼠脑海马组织病理形态学
A组大鼠海马CA-1区细胞排列整齐,细胞形态结构及层次清晰完整,核仁明显,间质无水肿;B组大鼠海马CA-1区可见坏死灶,细胞排列紊乱,细胞核固缩,核仁消失,细胞间隙增宽出现水肿;D组大鼠海马CA-1区水肿现象明显减轻,海马细胞排列紊乱现象有所改善。见图2。
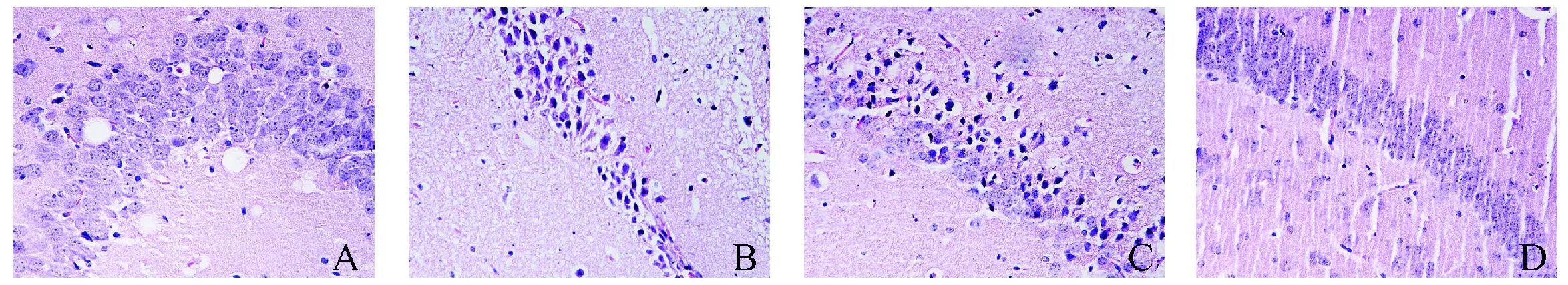
图2 各组大鼠脑海马组织病理形态学(HE,×200)Fig.2 Pathomorphology of hippocampus in each group (HE,×200)
2.4 各组大鼠脑海马神经元细胞凋亡数
光镜下正常细胞核为蓝色,凋亡细胞核为棕黄色。TUNEL结果显示,B组(37.12±4.63)、C组(34.60±3.53)和D组(13.14±1.72)大鼠脑海马CA-1区神经元细胞凋亡数明显高于A组(4.06±0.55),差异具有统计学意义(P<0.05);与C组相比,D组大鼠脑海马CA-1区神经元细胞凋亡数降低,差异均具有统计学意义(P<0.05)。见图3。

图3 各组大鼠脑海马神经元细胞凋亡数(TUNEL,×200)Fig.3 Apoptosis of hippocampal neurons in each group (TUNEL,×200)
2.5 各组大鼠脑组织中Bcl-2的表达水平
Western blot结果显示,与A组相比,B组和C组大鼠脑组织Bcl-2蛋白表达降低,差异具有统计学意义(P<0.05);D组Bcl-2表达与C组相比增加(P<0.05)。qRT-PCR结果显示,与A组(4.08±0.19)相比,B组(2.35±0.16)和C组(2.30±0.13)大鼠脑组织Bcl-2 mRNA表达降低,差异具有统计学意义(P<0.05);D组(3.31±0.19)与B组和C组相比增加(P<0.05)。见图4。
2.6 miRNA-125a与Bcl-2的靶向关系
荧光素酶报告基因实验结果显示,miRNA-125a与Bcl-2基因3′-UTR存在互补结合位点,miRNA-125a和Bcl-2能够靶向结合。转染野生型Bcl-2基因表达载体Wt-3′-UTR后再转染miRNA-125a抑制剂的荧光素酶活性显著升高(P<0.05);而转染突变型Bcl-2基因表达载体Mut-3′-UTR再转染miRNA-125a抑制剂的荧光素酶活性差异无统计学意义。见图5。
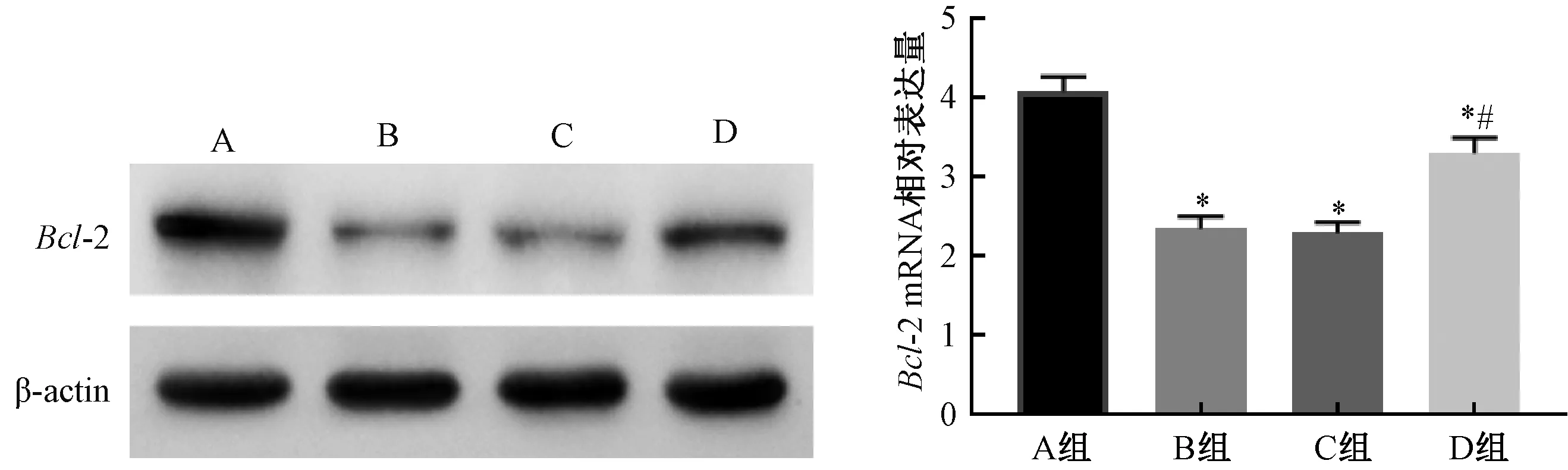
图4 各组大鼠脑组织Bcl-2蛋白和mRNA表达水平注:与A组相比,*P<0.05;与C组相比,#P<0.05Fig.4 Expression levels of Bcl-2 protein and mRNA in brain tissue of rats in each groupNote:Compared with group A, *P<0.05; Compared with group C, #P<0.05
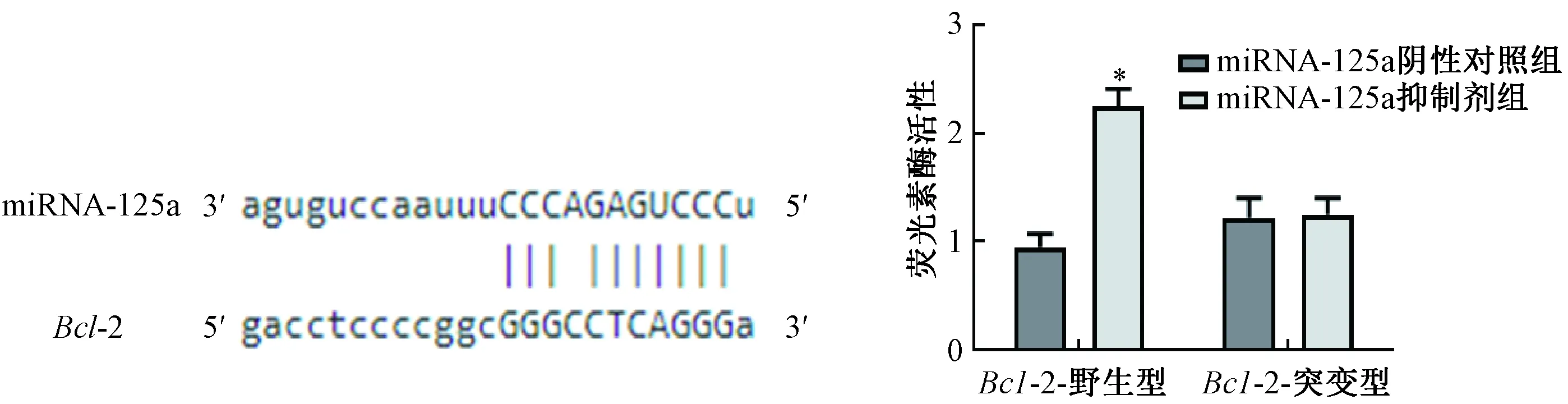
图5 荧光素酶报告基因实验(n=3)注:与miRNA-125a阴性对照组相比,*P<0.05Fig.5 Luciferase reporter gene experiment (n=3)Note:Compared with miRNA-125a negative control group, *P<0.05
3 讨论
癫痫是一种慢性神经系统疾病,其发病机制非常复杂且影响因素较多。miRNA-125a在细胞的分化、增殖、凋亡及新生组织的发育中有重要的调节作用[8]。miRNA-125家族的促进细胞凋亡的作用通常是通过其抑制相应的抗凋亡蛋白的表达而完成[9]。有研究发现,miR-125a在肿瘤干细胞中显著上调,p53的mRNA和蛋白水平下调。p53基因转染明显降低了TW01和CSCs的细胞活力,并在G0/G1期终止细胞周期[10]。本研究采用经典的氯化锂-匹罗卡品注射法建立癫痫大鼠模型,结果发现与正常对照组相比,模型组大鼠脑组织miRNA-125a的表达水平显著升高;HE结果发现海马细胞排列整齐,细胞形态结构及层次清晰完整,核仁明显,间质无水肿;模型组可见坏死灶,细胞排列紊乱,细胞核固缩,核仁消失,细胞间隙增宽出现水肿,抑制miRNA-125a的表达后,大鼠脑组织水肿现象明显减轻,海马细胞排列紊乱现象有所改善。提示癫痫模型大鼠脑组织损伤可能与miRNA-125a表达水平升高有关。
目前认为癫痫与神经元死亡、神经元再生、神经胶质细胞再生等有关[11]。田茸等[12]发现,反复的癫痫发作可导致大脑海马神经元凋亡,形成异常兴奋性突触环路,最终促进难治性颞叶癫痫形成。神经元凋亡过程受多种基因的调控,其中Bcl-2是与细胞凋亡密切相关的基因。Bcl-2主要参与细胞的内源性凋亡途径完成对细胞凋亡的调控,是已经被证实的抑制凋亡基因[13]。姚宝珍等[3]发现,miRNA-34a在癫痫模型中表达上调,且在急性期促进Notch1的表达,导致神经元凋亡及神经胶质增多,从而促进癫痫的发生发展。金绍静等[14]发现,癫痫大鼠海马组织中Bcl-2表达水平降低,且CA1区神经元凋亡率增加。本研究TUNEL结果显示,正常对照组海马神经元细胞排列规则,神经元胞核形态正常;模型组海马神经元细胞排列紊乱,神经元胞膜破裂,细胞脱落形成空泡,且脑海马神经元凋亡细胞数明显升高;此外,模型组大鼠脑组织Bcl-2表达水平与正常对照组相比明显降低,抑制miRNA-125a表达后,Bcl-2表达水平升高,神经元排列较规则,神经元凋亡细胞数降低,提示癫痫引起的脑损伤可能与海马神经元损伤及神经元细胞凋亡有关,抑制miRNA-125a可抑制神经元细胞凋亡,对神经元起到保护作用。
近年来研究发现,miRNA参与机体的生长、发育、分化及凋亡等生理过程的调控主要取决于其下游靶点[15]。本研究通过生物信息学进一步探讨miRNA-125a与Bcl-2之间的靶向关系,结果发现抑制miRNA-125a后,Bcl-2的表达水平显著升高,且miRNA-125a与Bcl-2基因3′-UTR存在互补结合位点,miRNA-125a和Bcl-2能够靶向结合。提示Bcl-2是miRNA-125a的下游靶基因。
综上所述,癫痫模型大鼠脑组织miRNA-125a可通过调控Bcl-2表达,进一步导致脑海马神经元损伤及大量神经元细胞凋亡;抑制miRNA-125a的表达水平可改善癫痫大鼠神经元损伤。
