微萃取器在多粘菌素B萃取工艺中的应用
2021-04-22程曜峰张丽娟葛鹍鹏鞠加学
程曜峰,张丽娟,张 炜,葛鹍鹏*,鞠加学*
(1.华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心,河北省工业微生物代谢工程技术研究中心,石家庄 050015; 2.华北制药集团华胜有限责任公司,石家庄 050015)
多粘菌素B是一种多肽类多组分抗生素,对绝大多数革兰氏阴性菌有较好的抗菌活性,如铜绿假单胞杆菌、大肠埃希菌、肺炎克雷伯杆菌、鲍曼不动杆菌及沙门氏菌属等[1]。多粘菌素B内部结构中的脂肪链是由10个氨基酸组成的7个多肽相互形成的,其相对分子质量为1 301.56,分子式为C56H96N16O13·2H2SO4[2]。多粘菌素B中B1和B2是其主要成分,还含有 B3、B1-I等结构相近的成分。通过微生物发酵生产多粘菌素B,提取纯化方法有溶媒萃取法、吸附法、离子交换法、沉淀法和泡沫分离法等[3]。目前,生产上大多采用溶媒萃取法提纯多粘菌素B,采用正丁醇在碱性条件下将多粘菌素B转入有机溶剂相中[4]。传统萃取工艺是在搅拌釜进行的,其工艺过程为:在搅拌釜内加入一定量的正丁醇,再加入多粘菌素B粗提液进行萃取,搅拌2 h后停搅拌进行分相;水相按照相应比例加入正丁醇再重复萃取3次;多次萃取得到的正丁醇相合并后进入下工序;传统的机械搅拌釜萃取工艺的总萃取率在75%~78%。传统萃取工艺溶剂消耗较高,未萃取出来的部分多粘菌素B作为COD(化学需氧量)排放,加重了环保处理负担。
微化工技术起始于上世纪末微控流技术[5],相比于传统的反应器其优势明显,因此,微化工技术的出现引起了学术界和产业界等相关领域极大的关注。国内微化工技术起步较晚,国内各专业相关人士近十多年时间才开始研究并应用,目前,在高校和科研机构开展研究较多。在化工过程、化学合成、制药工业、生物化学过程和分析等领域,微化工技术是发展最快和具有创造性的技术之一[6]。微化工技术主要是通过微反应器、微萃取器、微混合器、微换热器及微化学分析装置等微型化装置来实现的,微反应器内部微通道的特征尺寸一般在数十到几百微米之间[7]。微反应器的比表面积可以达到10 000~50 000 m2/m3,而传统的搅拌反应器设备的比表面积最多到1 000 m2/m3[8]。研究结果表明,应用微反应器可以有效强化传递或混合控制的化工过程,具有混合快、比表面积大、绿色安全、体积小、过程可连续和无放大效应等特点,可用于绿色化工艺开发[9]。微反应器在萃取方面也有较广泛的用途,李韡等采用煤油-水-苯甲酸为模型体研究了微通道内液-液两相流传质特性[10];荀涛等使用双T型微通道,以磷酸三丁酯(TBP) 的环己烷溶液-乙酸水溶液为萃取体系,研究了不同条件对流型及传质的影响[11];陈娅君等以硫酸铜溶液为水相,以DZ988N萃取剂为有机相,开展了相关的微通道液液萃取实验研究和数值模拟[12]。多粘菌素B相对分子质量较大,分子结构较复杂,粗提液中含有色素和杂蛋白等杂质,在萃取时不易从相界面穿过,因此需要较大的传质系数。与传统搅拌釜萃取相比,微反应器的尺寸属于微尺度范畴,所产生的直接优势就是扩散时间短,混合过程快,微反应器内传质推动力会随之增加,从而扩大了单位面积和单位体积的扩散通量,这对于萃取过程非常有利。作者利用微化工技术设计了一种连续萃取工艺,采用微萃取器对多粘菌素B进行萃取工艺改进,提高萃取率和效率,同时减少溶剂消耗。
1 实验部分
1.1 实验试剂与仪器
多粘菌素B粗提液,华北制药集团华胜有限责任公司;正丁醇,分析纯,天津科密欧化学试剂有限公司;其它试剂均为国产化学纯。
高效液相色谱仪(SPD-M20A型紫外检测器,LC-20AT泵,SIL-20A自动进样器,CTO-10AS柱温箱,日本Shimadzu公司)。平流泵(2PB-8008Ⅳ),北京星达科技发展有限公司。pH计,FiveEasy,Mettler Toledo。
1.2 微萃取器
实验用微萃取器由0.5~1.0 mm深的流动相微通道和微米级微孔分散膜模块组成,每个微萃取器设有流动相进口、分散相进口、萃取混合液微通道出口,内部结构如图1所示。流动相与分散相形成错流模式在微通道里混合。
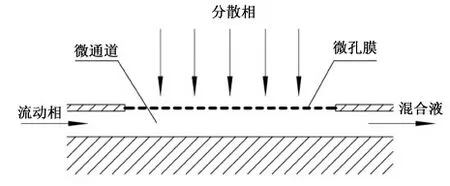
图1 微萃取器结构示意图Fig.1 Schematic diagram of the microextractor structure
1.3 实验流程
本实验流程如图2所示。多粘菌素B粗提液由平流泵3输送至微萃取器1流动相入口,正丁醇由平流泵5经过流量计输送至微萃取器1分散相入口,被微孔膜分散成微小液滴进入流动相通道与多粘菌素B粗提液进行错流混合,萃取。混合萃取后物料从出口出来后通过连接管从分相器中部位置进入,进行分相。通过调整微萃取器与分相器之间连接管的长度可以进行不同萃取停留时间的考察实验。后面串联的几级萃取器进、出料方式与第1级相同。通过对分散相溶剂流量的控制调整各级微萃取器的萃取比R(即正丁醇与粗提液的体积比)。各分相器分相后的溶剂相作为萃取液与后面的合并收集,废液在最后1级分相后排出。本装置可进行单级萃取或多级错流萃取。实验装置操作简单,快捷,稳定性好。每组实验进行完后,收集物料并计量水相(废水)和溶剂相(萃取液)物料体积,取样进行高效液相色谱检测,计算萃取率等相关数据。
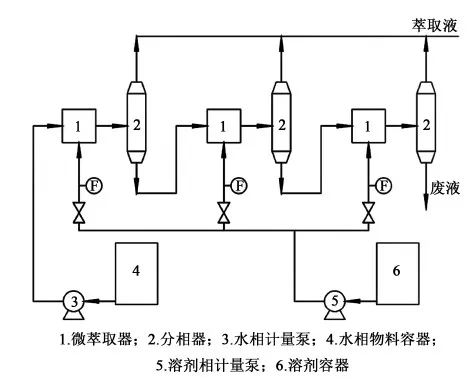
图2 多级微萃取器流程示意图Fig.2 Schematic diagram of the multi-stage microextractor process
1.4 萃取率
实验中萃取性能用萃取效率E如式(1)表示:
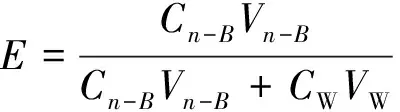
(1)
式(1)中,Cn-B为正丁醇萃取液中多粘菌素B浓度,CW为废水中多粘菌素B浓度,Vn-B为丁醇萃取液体积,VW为废水体积。Cn-B和CW均为实验后取相应样品进行高效液相检测得到的结果。Vn-B和VW为实验结束后用量筒计量相应物料得到的体积。在多级萃取实验中,各级出口收集的物料合并混合均匀后进行计量体积和取样。
2 结果与讨论
2.1 釜式萃取工艺萃取时间对萃取率的影响
实验采取单级釜式萃取:在常温下以正丁醇为萃取剂,将正丁醇与多粘菌素B粗提液按照萃取比R=1进行搅拌混合,机械搅拌一定时间后,将正丁醇-粗提液混合液置于分液漏斗中静置1 h后,待出现清晰相界面后进行分液。上层为萃取液,下层为废水,计量并取样分析萃取液和废水浓度。以不同的搅拌混合时间重复以上过程。釜式单级萃取时不同搅拌混合时间的萃取率见图3。
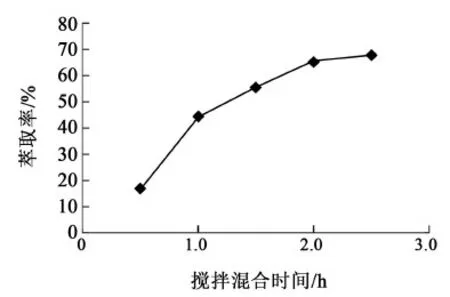
图3 搅拌混合时间对萃取率的影响Fig.3 Effect of mixing time on extraction rate
由图3可见,随着搅拌混合时间的增加,多粘菌素B在正丁醇中的萃取率随之缓慢增大,说明多粘菌素B从水相通过相界面转移到正丁醇相速度较慢,萃取过程受到传质速率影响比较大,对于釜式萃取工艺,需要延长两相接触时间来获得高萃取率。
2.2 微萃取器分散孔径的确定
溶剂相与水相的接触面积是决定传质速率的关键因素之一。用微萃取器中的微孔结构将正丁醇分割成为微米级的液滴进入流动相微通道,分散到多粘菌素B粗提液的流动相中进行混合、传质。两相的接触效果与正丁醇的液滴大小有直接关系。试验选择工业上常用的1、5、10、20、50和100 μm几种微孔介质作为分散结构进行单级微萃取实验,筛选适合的微萃取器分散孔径。流动相通道采用深0.5 mm、宽1.0 mm的微通道。取多粘菌素B粗提液按照工艺要求的范围调节好pH值,取萃取比R=0.5进行实验,两相分别经过水相计量泵、溶剂相计量泵进入单级微萃取器,流出后进行分相,观察并记录乳化层厚度和分相时间,根据两相体积和多粘菌素B的浓度计算萃取率。在上述相同条件下,分散相采用不同微孔尺寸进行萃取实验,结果表明,10、20和50 μm微孔对应的萃取率和乳化情况较接近,如表1所示。
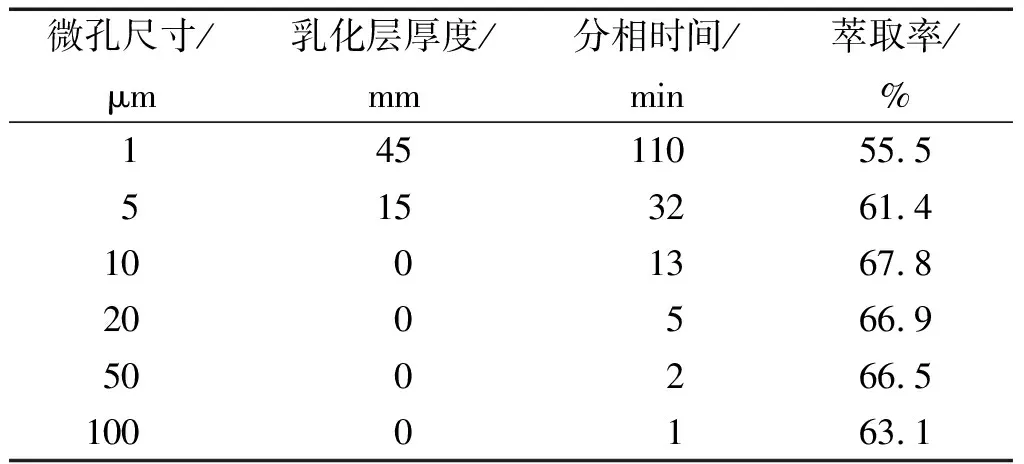
表1 不同微孔尺寸下的萃取率和乳化情况Table 1 Extraction rate and emulsification at different micropore sizes
数据显示,1和5 μm微孔对应的萃取后溶液出现了不同程度的乳化现象,而且长时间静置分相仍不彻底,导致萃取率偏低;微孔100 μm对应的萃取率偏低,说明随着分散液滴的尺寸增大,传质效果受到影响。综合萃取率、分相时间以及易工业化放大等因素,选择50 μm微孔作为微萃取器的分散相内构件进行后续实验。
2.3 停留时间对微萃取器萃取率的影响
从2.1实验可知,两相接触时间对萃取率有较明显的影响,对于釜式萃取工艺和微萃取器萃取工艺,两相接触时间均是萃取率的主要影响因素之一。实验取内径1.5 mm管作为微萃取器与分相器的连接管,在流动相流量50 mL·min-1,萃取比R=0.5的条件下,通过调整连接管长进行停留时间的影响实验。图4所示为萃取率与停留时间的关系图。

图4 停留时间对萃取率的影响Fig.4 Effect of residence time on extraction rate
由图4可知,当停留时间达到12 s以上时,萃取率增长缓慢,也就是说该萃取体系在12 s已达到平衡。与釜式萃取设备达到萃取平衡所需的时间相比,微萃取器效率显著。
2.4 分散相线速度对萃取率的影响
从图1微萃取器内部结构可知,分散相从微孔沿垂直于流动相流动方向错流进入微通道与流动相混合。周月等研究表明,在微孔分散反应器中,流动相流体相同表观速度下,随着分散相流体表观速度的增加,截面上的传质界面面积逐渐提高,传质系数也相应提高[13]。对于本实验的微萃取体系,以多粘菌素B粗提液作为流动相以2.0 m·s-1的线速度进入微萃取器,在萃取比R=0.6、停留时间12 s的条件下,通过改变微孔膜面积,使正丁醇作为分散相以不同的线速度穿过微孔膜进行实验。图5所示为萃取率和分散相压差(分散相入口与分相器之间的压力差)与分散相穿过微孔膜线速度的关系。
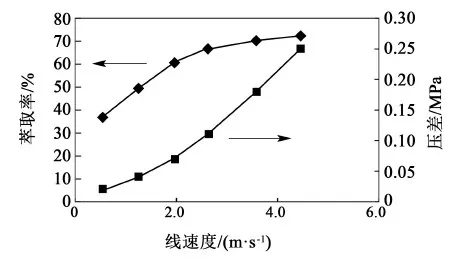
图5 萃取率和分散相压差随分散相线速度的变化Fig.5 Effect of extraction rate and dispersion phase pressure on dispersion phase velocity
由图5可知,随着分散相线速度提高,萃取率增长迅速,线速度达到3.0 m·s-1后萃取率E增长趋缓。分散相压差与线速度成正比例增长,微孔膜面积的减小使分散相穿过膜的阻力加大。为了获取较高的萃取率和较小的分散相压差,分散相线速度选择3.0~3.5 m·s-1较为适合。
2.5 流动相线速度对萃取率的影响
液液两相在微通道内一般有弹状流、滴状流、并行流、环形流等几种流型[14],不同的流型传质效果不同,流型主要取决于两相流量比和流速。刘妍等研究表明,在相同停留时间下,微通道内流速增大,萃取率随之增大[15]。本实验在3.0 m·s-1的分散相穿膜线速度、萃取比R=0.6及停留时间12 s的条件下,通过改变微萃取器通道尺寸和流动相流量调整不同的流动相流速进行萃取实验。实验结果表明,流体在通道中的线速度对萃取率E有明显影响,如图6所示。

图6 通道内流动相线速度与萃取率的变化曲线Fig.6 Variation curve of linear velocity of the mobile phase in the channel versus extraction rate
从图6可以看出,流动相在微萃取器通道内线速度在2.0 m·s-1以下时,萃取率变化较大;达到2.0 m·s-1以上时,有明显的拐点,随着线速度进一步增大,萃取率提高幅度趋缓。因此,采用流动相线速度2.5~4.0 m·s-1的范围能得到较高的萃取率,动力消耗也较为合理。
2.6 多级错流萃取两相比例的确定
多级错流微萃取工艺每级都是加入新溶剂,使水相中的溶质萃取较彻底。李硕等研究表明,多级错流萃取中溶质萃取率随着萃取级数的增大而增大;当萃取级数相同时,萃取比越大,萃取率越高[16]。但萃取比越大,消耗溶剂量越大。本实验取多粘菌素B粗提液1.0 L,正丁醇分别按照不同萃取比R加入,在3 m·s-1的分散相穿膜线速度、3.3 m·s-1的流动相线流速和停留时间12 s以上的条件下进行萃取实验。实验结果显示,多级微萃取器错流萃取效果明显优于传统搅拌釜,如表2所示。

表2 多级串联微萃取与搅拌法萃取率、溶剂消耗对比Table 2 Comparison of extraction rate and solvent consumption between multi-stage microextraction and stirring method
由表2数据可以看出,传统搅拌法在多次萃取、溶剂加量多的情况下,萃取率E仍然处于较低水平;每次萃取结束都要单独进行静置分相才能进行下一次,操作时间长。多级串联微萃取器萃取率和效率优势明显,溶剂使用量也较釜式萃取工艺明显减少。综合以上数据,三级微萃取器串联,正丁醇分次加入的萃取比R为0.6、0.2和0.1时总萃取率和效率俱佳。
3 结论
利用微型化技术替代传统搅拌釜方法进行多粘菌素B萃取,通过对多级串联微萃取器萃取方法中关键工艺参数的优化,取得了较好的实验结果。1)微萃取器的分散膜微孔大小对传质效果和乳化现象有直接影响。2)微萃取工艺在短停留时间内可以达到萃取平衡,效率明显优于釜式萃取工艺。3)分散相和流动相流速对两相之间传质影响较大,在一定范围内,流速越大,传质效果越好。4)微萃取器串联级数和每级溶剂加量比例对萃取率有一定影响,选用三级串联的微萃取器系统较适合该体系。多级错流微萃取工艺在萃取率、生产效率、溶剂使用量比釜式搅拌萃取工艺具有明显优势,并且用时短,重复性、稳定性、耐用性良好,且操作简单,可实现连续运行,适用于多粘菌素B等多肽类抗生素的溶剂萃取,解决了传统搅拌釜萃取工艺萃取率低、用时长、溶剂消耗多、COD排放较多等问题,为实现多肽类抗生素原料药萃取绿色生产开拓了新思路。
