特殊形貌光催化剂的研究进展
2021-04-22鲍二蓬张硕卿邹吉军
鲍二蓬,张硕卿,邹吉军,徐 强
(天津大学化工学院,天津 300072)
能源危机和环境污染问题已成为人类社会发展所面临的2个重大挑战[1]。相对于已得到广泛应用的化石能源,太阳能具有分布广泛、清洁和廉价等优点,具有巨大的开发潜力[2]。因此,如何高效利用太阳能已成为当今能源领域的一个研究热点,受到了全社会的广泛关注[3-4]。在众多的太阳能转化技术中,将太阳能转化为化学能的光催化技术是一种非常有效的太阳能转化方式,已经受到了世界各国的广泛关注[5]。光催化就是价带中的电子吸收足够的光能后,跃迁到导带,在价带留下空穴,产生具有氧化-还原能力的光生电子-空穴对,然后生成具有极强活性的自由基基团的过程[6]。这些光生载流子与吸附在光催化剂表面的吸附物种所发生的加合、取代、电子转移等一系列化学反应则被称为光催化反应,如光催化制氢[7]、光降解有机污染物[8]、光催化合成氨及光催化还原CO2等[9]。近年来,虽然光催化技术得到了长足的发展,但其依然存在着光能利用率较低、光生电子-空穴对复合率高等问题亟待解决。想要解决目前光催化剂所存在的问题,需要理性地设计催化剂结构,探索其制备工艺。
光催化反应一般包括以下4个基元步骤:1)光照射在光催化剂上时,光催化剂吸收光能(光子的能量大于等于光催化剂的带隙值hν≥Eg)[10];2)光生电子由价带跃迁到导带中,形成光生电子-空穴对;3)光生电子-空穴对迁移到光催化剂表面上或直接发生复合;4)光生电子-空穴对迁移到反应物处,电子和空穴分别驱动还原和氧化反应(工作原理见图1所示)[11]。目前,光催化技术普遍存在的技术瓶颈包括以下3个方面:1)光生电子-空穴对的复合率较高;2)光能利用率较低;3)光催化剂表面上有效反应活性位点的数量偏少。上述3个方面的问题均与光催化剂的性能密切相关。为了提高光催化剂的性能,各国科学家开发了许多技术加以改进。这些技术主要包括掺杂[12]、金属负载[13]、形成异质结[14]、制备成特殊形貌光催化剂[15-16]、降低光催化剂颜色[17]等,如表1所示。这些改进措施均能从不同方面改善光催化剂的催化性能。

表1 光催化剂的改进方法Table 1 The improved synthesis methods of photocatalysts
在上述几种性能改进措施中,将光催化剂制备成特殊形貌是一种很有效的方法。这种方法不仅可以节省光催化剂的用料,而且还能大幅度提高其光催化性能。光催化剂的特殊形貌主要包括一维(纳米线、纳米棒、纳米管)、二维(纳米片)、三维(核壳结构)等结构类型。相对于传统的颗粒型光催化剂,这些具有特殊形貌的光催化剂不仅可以增加反应活性位点,而且还可以加快光生载流子的迁移速度,促进光生电子-空穴对的分离,因此有效地提高了光催化反应的活性。在实际应用中,如果将这些具有特殊形貌的光催化剂与助催化剂相结合组成一种异质结,因为主催化剂性能提高,还可以进一步提升其复合光催化性能。当然,这些特殊形貌光催化剂的制备方法明显不同于传统的光催化剂,需要设计全新的合成路线。为了阐明不同形貌光催化剂的设计思路,本论文总结了具有不同形貌光催化剂的制备方法,比较了不同形貌光催化剂的光催化性能,展望了特殊形貌光催化剂未来的研究方向。

图1 光催化反应机理示意图Fig.1 Schematic of photocatalytic reaction mechanism
1 不同形貌光催化剂的合成工艺及其性能
不同形貌光催化剂的制备方法与合成策略是不相同的。即使同一种形貌的光催化剂也会有不同的制备方法。因此,在保持催化性能良好的前提下,选择一种过程简单的制备工艺,不仅可以有效地降低光催化剂的制备成本,而且也利于其产业化的进程。目前研究比较广泛的特殊形貌光催化剂,包括有一维(纳米线、纳米棒、纳米管)、二维(纳米片)及三维(核壳结构)等类型。下面对这几种特殊形貌的光催化剂的制备方法及其催化性能,分别加以介绍。
1.1 一维形貌的光催化剂
一维形貌的光催化剂材料能够为光生电子-空穴对提供快速转移的通道,大幅度地减小由于纳米颗粒之电子跃迁而产生的电荷损失。一维纳米光催化剂材料主要包括纳米线、纳米棒、纳米管等。
1.1.1 纳米线
纳米线(纳米纤维)型光催化剂是一类具有一维线型结构的光催化剂。与传统的颗粒型纳米光催化剂相比,纳米线型的光催化剂具有比表面积大[18]、易于传输光生载流子、化学稳定性好[19]等优点。其主要的制备方法包括水热-煅烧法[20-21]、化学沉淀法[22]和溶剂热法[14]等。
Kim等[22]利用化学沉淀法制备了Cu2O纳米线作为光催化剂进行光还原CO2。图2和图3分别显示了Cu2O纳米线的合成工艺流程和Cu2O纳米线光还原CO2的性能。从图3a)中可以发现,在可见光照射下,利用化学沉淀法制备的Cu2O纳米线光还原出的CO(CO2的还原产物)析出速率为0.64 μmol·g-1·h-1,比Cu2O网状光催化剂光还原出的CO析出速率高出约1倍。这个结果表明,Cu2O纳米线可以有效地提高CO2的光还原效率,同时其在400~600 nm处的光吸收强度得到明显增加。这是由于Cu2O纳米线提高了催化剂的比表面积,进而提高了光能利用率。从图3b)中可以看出,3种线状结构的纳米光催化剂(Cu2O、Cu2O/C及C/Cu2O/BiVO4)的光还原性能,明显优于3种网状结构的纳米光催化剂。这个结果也说明,将线状的纳米光催化材料与其它光催化剂进行复合,将进一步提高其光催化性能。由于具有纳米线形貌的光催化剂,具有较大的长径比,可以延长光生载流子的扩散路径,从而抑制了光生电子-空穴对的复合速率,提高了其光催化性能[14]。
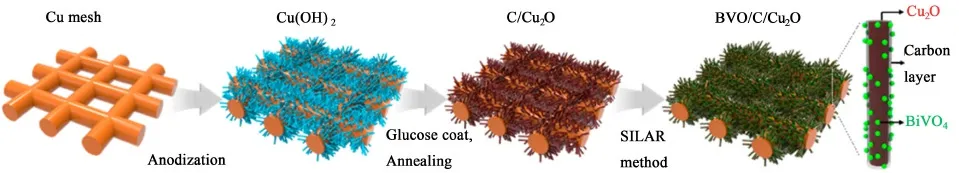
图2 化学沉淀法制备Cu2O纳米线的合成工艺流程图[22]Fig.2 Synthetic preparing process of Cu2O nanowires by chemical precipitation method[22]

图3 a)不同光催化剂光催化还原CO2的性能比较、b)不同光催化剂的结构对光催化还原CO2活性的影响(内插图:网状Cu2O和Cu2O纳米线的SEM照片)[22]Fig.3 a) Comparison of photocatalytic reduction of CO2 with different photocatalysts; b) Structural effects on the photocatalytic reduction activity of CO2 (Inset: SEM images of reticulated Cu2O and Cu2O nanowires)[22]
1.1.2 纳米棒
除了纳米线外,形貌相似的纳米棒状光催化剂也已经被广泛地加以研究。相对于纳米线型光催化剂,纳米棒状光催化剂的长径比更小,一般均小于20。纳米棒状光催化剂的合成方法包括水热-煅烧法[23]和水热法[24]等。
Yu等[24]利用水热法成功地制备了Ta2O5纳米棒作为析氢光催化剂。图4和图5分别显示了Ta2O5纳米棒的合成工艺流程及其催化析氢性能。从图5a)中可以发现,Ta2O5-220(水热温度为220 ℃时制备的Ta2O5纳米棒)在紫外光区的光催化析氢速率达到10.17×103μmol·g-1·h-1,远远高于商品化Ta2O5光催化剂(纳米颗粒)的析氢速率(2.6×103μmol·g-1·h-1)。而在可见光区,当光照射波长λ>320 nm时,Ta2O5-220光催化剂的析氢速率(356.68 μmol·g-1·h-1)是商品化Ta2O5析氢速率的7倍以上。这个结果表明Ta2O5-220具有良好的光催化性能。由于Ta2O5-220的带隙值较低(2.75 eV),远远低于商品化Ta2O5光催化剂的带隙值(3.88 eV)。另外,Ta2O5-220光催化剂具有介孔结构,其比表面积高达237.89 m2·g-1,是商品化Ta2O5光催化剂的103.43倍(2.3 m2·g-1),这些结构特征均提高了Ta2O5-220的光能利用率。从图5b)中可以发现,经历3个循环周期(6 h)后,Ta2O5-220光催化剂的析氢速率基本上保持稳定,表明其纳米棒状结构具有良好的结构稳定性。纳米棒状光催化剂性能提升的原因可以归因于纳米棒形貌延长了光生载流子的扩散路径,抑制了光生电子-空穴对的复合速率[17]。

图4 水热法制备Ta2O5纳米棒的合成工艺流程[24]Fig.4 Synthetic preparing process of Ta2O5 nanorods by the hydrothermal method[24]
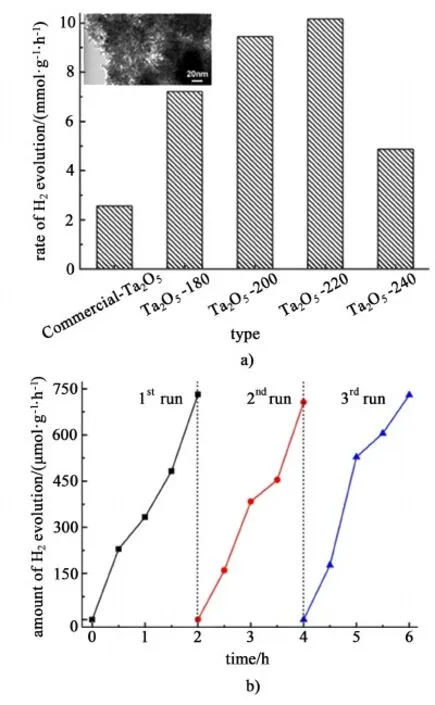
图5 不同光催化剂的光催化析氢速率 a) (插图:Ta2O5-220的TEM照片)、Ta2O5-220光催化剂在模拟阳光照射下的循环稳定性 b)[24]Fig.5 a) Photocatalytic hydrogen evolution rates of different photocatalysts (Inset: TEM image of Ta2O5-220); b) Cyclic stability of Ta2O5-220 photocatalyst under the simulated sunlight[24]
1.1.3 纳米管
除了纳米线和纳米棒外,纳米管状光催化剂也是一种催化剂,具有较高的比表面积和良好的光催化性能。纳米管状光催化剂的制备方法主要包括煅烧法[25]、水热-煅烧法[26]及阳极氧化-煅烧法[27]等。
Fu等[25]利用煅烧法成功地制备了一种氧掺杂的纳米管形状的g-C3N4(OCN-Tube)光催化剂来还原CO2。图6和图7分别显示了OCN-Tube光催化剂的合成工艺流程图,比较了管状和块状2种g-C3N4光催化剂还原CO2的性能。从图7a)中可以发现,OCN-Tube荧光发射峰的强度远远低于块状g-C3N4,表明OCN-Tube光催化产生的光生电子-空穴对的复合速率得到了明显的抑制。相对于块状的g-C3N4,OCN-Tube光催化剂的比表面积得到了明显的增大,其比表面积(36 m2·g-1)约为块状g-C3N4的4倍,因此有利于产生更多的光生载流子。此外,OCN-Tube表面上的CO2吸附量为0.045 mmol·g-1,约为块状g-C3N4吸附量的2.3倍。而CO2的吸附量的提高,也可以促进光还原CO2反应的进行。通过比较其反应产物CH3OH的生成速率可以发现,OCN-Tube光催化产物的生成速率为0.880 μmol·g-1·h-1,是块状g-C3N4光催化剂(0.176 μmol·g-1·h-1)的5倍[图7b)]。经过3次循环后,OCN-Tube的光还原速率基本上能够保持稳定。具有纳米管状的光催化剂可以为光生载流子提供沿管壁方向的扩散路径,从而大幅度地减少了由于纳米颗粒之间的电子跳跃而引起的电荷损失,进而抑制了光生电子-空穴对的复合速率,因此提高了光催化性能[28]。
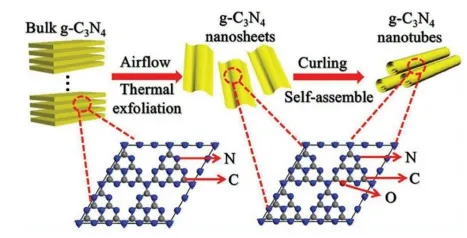
图6 煅烧法制备OCN-Tube的合成工艺流程[25]Fig.6 Synthetic preparing process of OCN-Tube by the calcining method[25]
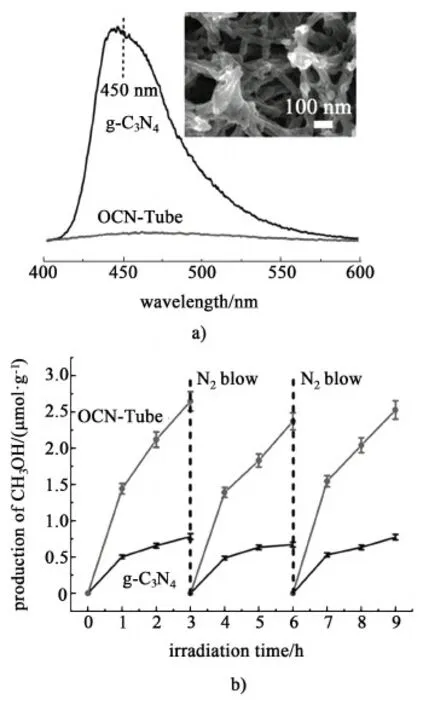
图7 a) OCN-Tube和块状g-C3N4的光致发光光谱 (内插图:OCN-Tube的FESEM照片)、b)利用OCN-Tube和块状g-C3N4光催化产生的CH3OH的生成速率[25]Fig.7 a) Photoluminescence spectra of OCN-Tube and bulk g-C3N4 (Inset: FESEM image of OCN-Tube); b) Generation rate of CH3OH produced by OCN-Tube and bulk g-C3N4[25]
1.2 二维纳米光催化剂
相对于一维纳米光催化剂材料,二维纳米光催化剂材料增大了比表面积,能够提供更多的有效反应活性位点;另外其受光面积也相对较大,因此在提高光的利用率方面有明显的优势。纳米片是一种常见的二维纳米光催化剂材料。
将光催化剂材料制备成纳米片状也是一种增大比表面积、提高反应活性位点的有效途径。此外,纳米片状光催化剂还具有抑制量子点团聚、增强光能利用率的作用[29]。纳米片状光催化剂的制备方法包括水热法[30]、煅烧法[31]和煅烧-超声法[29]等。
Lei等[30]利用水热法成功地制备了一种超薄型MnO2纳米片(U-MnO2),用于室温下从碱性甲醛溶液中光催化析出H2。图8和图9分别显示了U-MnO2光催化剂的合成工艺流程,并比较了MnO2和U-MnO2光催化剂的析氢性能。U-MnO2光催化剂的厚度只有1~2层,而MnO2的厚度有7层左右。水热的作用主要是将MnO2剥离为更薄的纳米片。U-MnO2的比表面积为234.1 m2·g-1,比剥离前的MnO2的比表面积(101.3 m2·g-1)高出约2.3倍。从图9a)中可以看出,MnO2的氢析出速率为20.4 μmol·h-1,而U-MnO2的氢析出速率为112 μmol·h-1,是MnO2析氢速率的5.5倍左右。从图9b)中可以发现,MnO2和U-MnO2的表观活化能分别为36.4和26.1 kJ·mol-1,表明H2更容易在U-MnO2表面上产生。U-MnO2光催化性能提升的主要原因包括以下方面:首先,U-MnO2纳米片上含有大量的氧空位,可以与氧气耦合,有利于甲醛C—H键的断裂以及·OOH产生,这有利于氢气的析出;其次,U-MnO2具有较大的比表面积;可以降低析氢反应活化能。相对于块状光催化剂,纳米片状的光催化剂具有更大的比表面积和较多的活性位点,可以产生更多的光生载流子,因此能够显著地提升光催化性能[30]。

图8 水热法制备U-MnO2的合成工艺流程(内插图:U-MnO2的TEM照片)[30]Fig.8 Synthetic preparing process of the hydrothermal method for U-MnO2 nanosheets(Inset: TEM image of U-MnO2)[30]

图9 a)MnO2和U-MnO2样品的析氢性能 (内插图:U-MnO2的HRTEM照片)、b)MnO2和U-MnO2的表观活化能 (内插图: U-MnO2产生氢气机理图)[30]Fig.9 a) Hydrogen evolution performance of MnO2 and U-MnO2 samples (Inset: HRTEM photograph of U-MnO2); b)Apparent activation energy of MnO2 and U-MnO2(Inset: U-MnO2 hydrogen generation mechanism diagram)[30]
1.3 三维纳米光催化剂
相对于二维纳米光催化剂材料,三维纳米光催化剂材料可以进一步扩大比表面积,因为二维纳米片之间常会存在堆叠问题,而三维纳米光催化剂材料可以通过开放框架的多重反射最大程度地利用入射光,并为光生电子-空穴对提供快速传输途径。核壳结构微球是一种常见的三维纳米光催化剂材料。
核壳结构一般是由外壳和内核所构成的,当然空心结构也可以看作是一种特殊的核壳结构。相对于其它形貌的光催化剂,核壳结构的光催化剂具有一种独特的优势,即可以大幅度提高光能的利用率。具有核壳结构的光催化剂的制备原理主要是基于柯肯达尔效应(Kirkendall effect)、奥斯瓦尔德熟化(Ostwald ripening)[32]和逐层沉积[33-35]等3种不同的机制。图10显示了6种不同形态的核壳结构光催化剂[11],依次为:单核单壳、单核多壳、多核单壳、多核多壳、空心单壳及空心多壳。一般而言,外壳的数目越多,光能的利用率也越高。核壳结构光催化剂的制备方法包括水热和溶剂热法[36-39]、硬模板法[40-43]、软模板法[35, 44-45]及以上各种方法的组合[46-47]等。
Ding等[48]利用水热法分别制备了具有空心结构和单核单壳结构的三元硫化物微球作为析氢光催化剂。图11显示了具有空心结构和单核单壳结构的三元硫化物微球的合成工艺流程。图12a)显示了具有4种不同形貌的光催化剂[单核单壳(CYS),小单核单壳(CSYS),空心球(CHS)、实心(CSS)]与硫化镉光催化剂的析氢性能,从图12a)中可以发现,CYS样品的析氢能力最强,其析氢速率为762.3 μmol·g-1·h-1,约为CSS的9.7倍(78.3 μmol·g-1·h-1)。而CHS样品的析氢速率为142.4 μmol·g-1·h-1,约为CSS光催化剂的1.8倍。相比于实心结构的光催化剂,具有核壳结构的光催化剂的析氢性能得到了明显提升。从图12b)中可以看出,CYS经历5次循环后(每次连续析氢5 h),其光析氢性能依旧保持稳定,表明这种光催化剂具有良好的结构稳定性。核壳结构不仅具有多孔和表面积大的优点,而且入射的光线在核壳之间的空腔中可以产生多次反射,使得光能可以重复利用,从而大幅度地增强了的光收集能力,使光能利用率得到大幅度的提高[39]。

图10 不同类别的核壳结构[11]Fig.10 Different types of core-shell structures[11]

图11 利用水热法制备空心和核壳结构的三元硫化物微球的合成工艺流程 (内插图:CdIn2S4的空心球和核壳状球的SEM照片)[48]Fig.11 Synthetic preparing process of hollow and core-shell ternary sulfide microspheres by hydrothermal method (Inset: SEM images of hollow and core-shell spheres of CdIn2S4)[48]
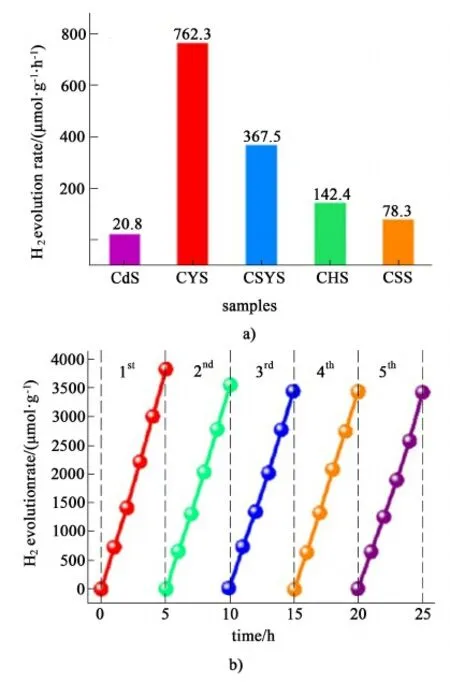
图12 a)不同CdIn2S4样品的氢析出速率、b)CYS光催化剂的循环稳定性[48]Fig.12 a) Hydrogen evolution rate of different CdIn2S4samples; b) Cyclic stability of CYS photocatalyst[48]
1.4 其他形貌
除了上述几种形貌的光催化剂外,还存在着一些其他特殊形貌的光催化剂,比如Fe2O3-TiO2微哑铃形复合光催化剂[49]、海胆状ZnIn2S4-Au-TiO2复
合光催化剂[50]、花状GO/g-C3N4/MoS2复合光催化剂[51]等。常用的制备方法有:化学沉淀-溶剂热法[50]、煅烧法[52-53]、水热-煅烧法[54]等
Zeng等[55]利用水热-煅烧法制备了不同形貌的g-C3N4用于光催化析氢反应。图13分别显示了多孔状g-C3N4(PCN)、海胆状g-C3N4(CNSC)、块状g-C3N4(BCN)、氧掺杂块状g-C3N4(OBCN)的合成工艺流程。图14分别显示了不同形貌光催化剂的紫外可见吸收光谱及其光电流-时间响应曲线。从图14a)中可以发现,PCN和CNSC的带隙值均小于块状g-C3N4的带隙值,即前2者的光能利用率更高[50]。在CNSC上光沉积Pt,可见光照射下(λ≥420 nm),3%Pt/CNSC催化剂(质量分数)析出的H2和O2速率为41.5和20.3 μmol·g-1·h-1,是2%Pt/BCN光催化剂(质量分数)析出H2速率的30倍。这是由于Pt原子加入后与CNSC形成肖特基势垒,从而抑制了光生电子-空穴对的复合速率。从图14b)中可以看出,CNSC光催化剂的光电流值是BCN光催化剂的4倍左右,而PCN光催化剂的光电流值是BCN光催化剂的2倍左右。上述结果说明CNSC和PCN的光生电子-空穴对的分离效率比BCN的更高。这主要归因于多孔状和海胆状g-C3N4可以有效地促进光生电子-空穴对的分离,同时也可以暴露出更多的反应活性位点[50]。

图13 水热-煅烧法制备海胆状g-C3N4和氧掺杂块状g-C3N4的合成工艺流程[55]Fig.13 Synthetic preparing process of sea-urchin-shaped g-C3N4 and oxygen-doped bulk g-C3N4 by the hydrothermal-calcination method[55]

图14 不同形貌光催化剂的紫外-可见吸收光谱 a) (内插图:不同样品带隙值和样品照片)、不同形貌光催化剂的光电)、b)不同形貌光催化剂的光电流-时间曲线 (内插图:CNSC海胆状g-C3N4的TEM照片)[55]Fig.14 a) UV-visible absorption spectra of photocatalysts with different morphologies (Inset: Band gap values and photos of different samples); b) Photocurrent-time curves of photocatalysts with different morphologies (Inset: TEM image of sea-urchin-shaped g-C3N4)[55]
2 展望和总结
本论文列举了具有不同形貌特征的光催化剂,如一维(纳米线、纳米棒、纳米管)、二维(纳米片)、三维(核壳结构)等材料的制备方法及其光催化性能。通过比较可以发现,水热法适用于制备多种形貌的光催化剂(纳米棒、核壳结构光催化剂、纳米片等),也更加有利于光催化剂的实际生产。相对于传统颗粒状光催化剂而言,这些特殊形貌的光催化剂的催化性能均得到了明显的提升,其中具有核壳结构的光催化剂的提升幅度最大。相对于传统颗粒状光催化剂,具有特殊形貌光催化剂具有更大的比表面积和更长的光生载流子迁移路径,从而为其提供更多的反应活性位点和更高的光生电子-空穴分离效率。
目前,特殊形貌的光催化剂的开发已成为光化学领域的研究热点,特殊形貌光催化剂的未来发展方向,主要包括以下2个方面:
1) 探索单原子、量子点或者纳米团簇与特殊形貌光催化剂的复合制备工艺,以获得更好的光催化性能;
2) 开发新型特殊形貌光催化剂,拓宽其光谱吸收范围,特别是研制能够捕获近红外光的光催化剂。
