金催化丙炔酸盐与3,5-二甲基异恶唑[4+1]环化反应的理论研究*
2021-04-22孙佳颖郁章玉
孙佳颖, 郁章玉②, 刘 涛②
(①曲阜师范大学化学与化工学院,273165;②济宁学院化学与化工系,273155,山东省曲阜市)
异恶唑是一种重要的五元芳族杂环化合物,具有生物活性和药理特性,被广泛用来止痛、抗炎和抗菌[1-3].异恶唑类化合物除了具有芳族体系的典型特性外,还具有弱的N—O键,在某些反应条件,特别是在还原或碱性条件下,N—O键容易发生断裂[4],从而生成双官能化的化合物,比如1,3-二羰基、烯氨基酮、γ-氨基醇、α,β-不饱和肟、β-羟基腈和β-羟基酮化合物等.异恶唑可以对金活化的炔烃进行亲核攻击,进一步实现炔烃和含有N—O键的底物的环化反应,成为构建高功能含氮氧杂环的有效途径,引起了科学家广泛的研究兴趣[5-10].
Liu等人研究了一系列包括炔酰胺/丙酸盐和异恶唑衍生物的环化反应[11].如图1a所示,丙炔酸盐R1与3,5-二甲基异恶唑R2会发生环化反应生成产物2,4-二羰基吡咯.反应中3,5-二甲基异恶唑会进攻丙炔酸盐不同位点的碳原子,C1原子或C2原子,从而得到不同的产物(如图1b所示),但该选择性产生的本质原因Liu等人并没有探讨.本文中,我们将通过理论计算,详细研究该反应机理,并揭示选择性产生的根源.
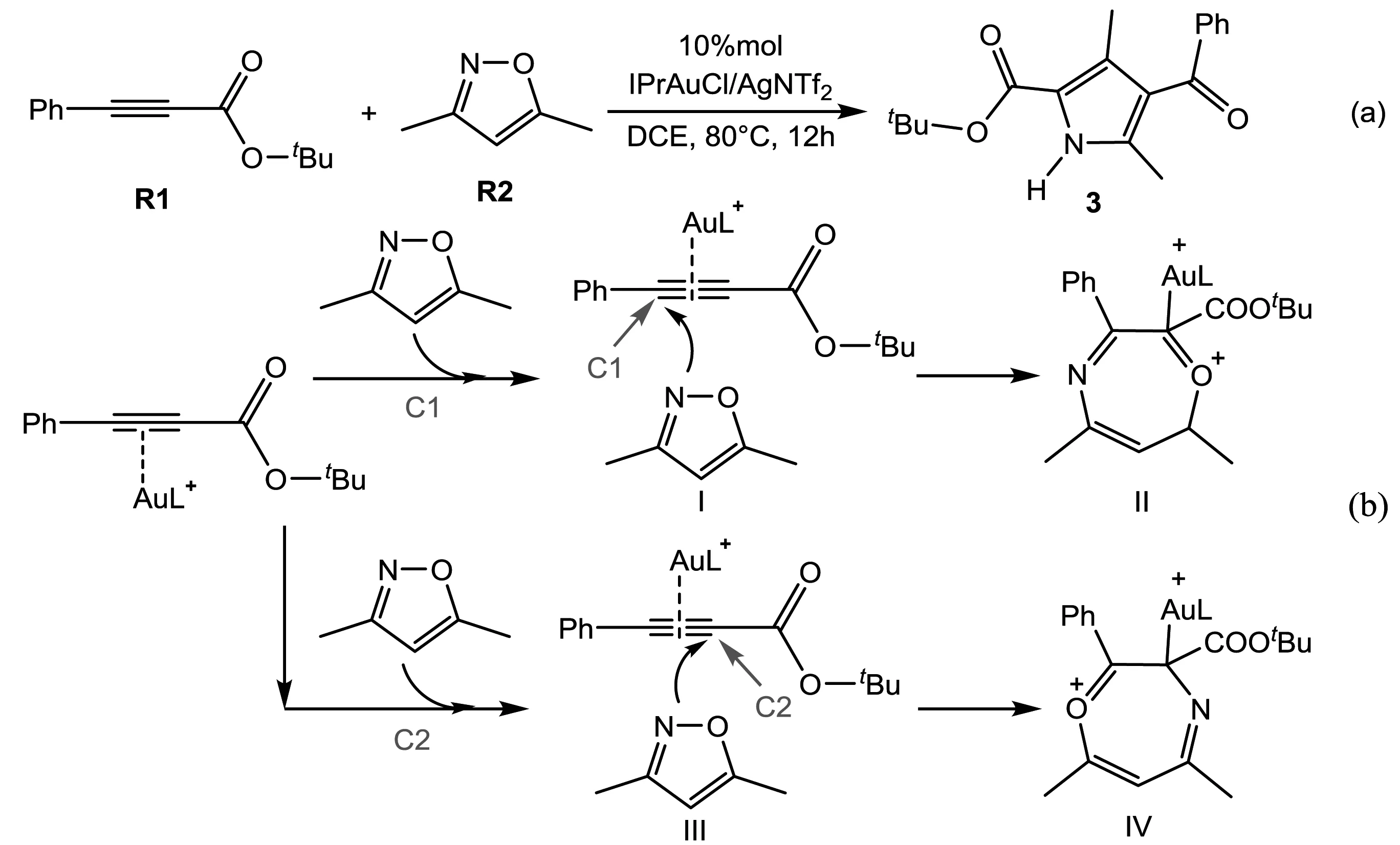
图1 金催化丙炔酸盐与3,5-二甲基异恶唑的环化反应
1 计算方法
所有结构都是在气相中在B3LYP[12-13]/BSI水平上进行优化的,其中BSI表示Au原子采用LanL2DZ[14-15]基组,其它原子采用6-31G(d,p)基组.频率也是在同一水平上进行计算的.如有必要,采用内禀反应坐标(IRC)[16]计算以确定过渡态前后所连的中间体.文中的计算使用的是高斯09软件[17].为了模拟溶剂效应,在气相优化构型基础上进一步采用SMD[18-19]溶剂化模型在二氯乙烷溶剂中进行了单点计算.计算水平是M06/BSII[20],其中Au原子采用SDD[21]基组,其它原子采用6-311++G(d,p)基组.在所有的势能面中给出的能量是相对吉布斯自由能,单位是kcal/mol.
2 结果与讨论
2.1 N原子进攻C1原子的过程
3,5-二甲基异恶唑中的N原子可以分别进攻丙炔酸盐的两个不同位点的碳原子(C1和C2),其中N进攻C1原子的势能面如图2和图3所示.金催化剂首先与R1中的炔烃部分配位,形成中间体im1,同时释放了9.4 kcal/mol的能量.接着,R2中的N原子进攻im1中的C1原子,克服了13.4 kcal/mol的能垒,形成了一个比im1更加稳定的中间体im3.在im3的结构中,N—C键成键,炔烃结构被破坏,碳碳三键变为碳碳双键,中间体im3的相对能量降至17.5 kcal/mol.在接下来的开环过程中,R2中的N—O键断裂,五元环开环,经过过渡态ts2生成了中间体im3,此过程需要能垒17.2 kcal/mol.

图2 3,5-二甲基异恶唑中的N原子进攻丙炔酸盐下C1原子以及N—O开环步骤的势能面(相对自由能单位是kcal/mol)
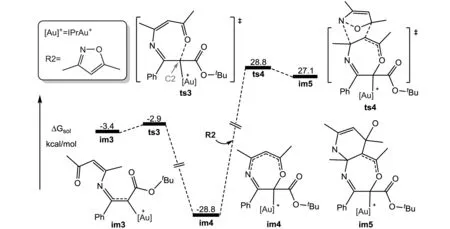
图3 C-O闭环步骤和R2再次加入过程的势能面(相对自由能单位是kcal/mol)
如图3所示,im3中的O原子进攻C2原子,O—C键成键,越过0.5 kcal的能垒形成了更加稳定的七元环中间体im4.随着另一分子R2的加入,会发生扩环反应形成中间体im5,但此过程的能垒太高(57.6 kcal/mol),表明这条路径是走不通的.
2.2 N原子进攻C2原子的过程
在否定了N原子进攻C1原子的这种可能性后,我们接着研究了N原子进攻C2原子的情况,其机理如图4至图7所示.金催化剂首先与R1配位生成im1,接着R2中的N原子进攻im1中炔烃的C2原子形成一个更稳定的中间体im6,其相对能量降至-15.4 kcal/mol.该过程克服了27.2 kcal/mol的能垒(ts5相对应im2),炔烃的碳碳三键结构被破坏变成了碳碳双键结构,而且金催化剂转移到苯基一端的C1原子上.在接下来的五元环开环过程中,通过跨越13.1 kcal/mol的能垒,N—O键断裂生成了中间体im7.

图4 3,5-二甲基异恶唑中的N原子进攻丙炔酸盐下C2原子以及N—O开环步骤的势能面(相对自由能单位是kcal/mol)

图5 环闭合步骤的势能面(相对自由能单位是kcal/mol)
如图5所示,O原子经过与N原子的断键过程之后,会进攻C1原子,通过过渡态ts7,形成了一个七元环中间体im8,这一步仅需要3.2 kcal/mol的能量.之后,与碳碳键配位的金催化剂会与N原子配位,形成一个更稳定的共轭中间体im9,同时释放了16.3 kcal/mol的能量.
如图6所示,im9会通过克服29.8 kcal/mol的能垒,发生缩环反应生成稳定的五元环中间体im10.随后,—COPh基团经过过渡态ts9发生第一次迁移过程,生成中间体im11.接着,如图7所示,—COPh基团再次发生迁移,经过过渡态ts10,越过16.1 kcal/mol的能垒,形成比im11更加稳定的中间体im12.接下来,在水分子协助下,H原子从C原子转移到N原子上,此过程需要能垒22.6 kcal/mol.最后,产物P生成的同时,金催化剂再生,其相对能量降至-67.0 kcal/mol.

图6 缩环和—COPh基团迁移步骤的势能面(相对自由能单位是kcal/mol)
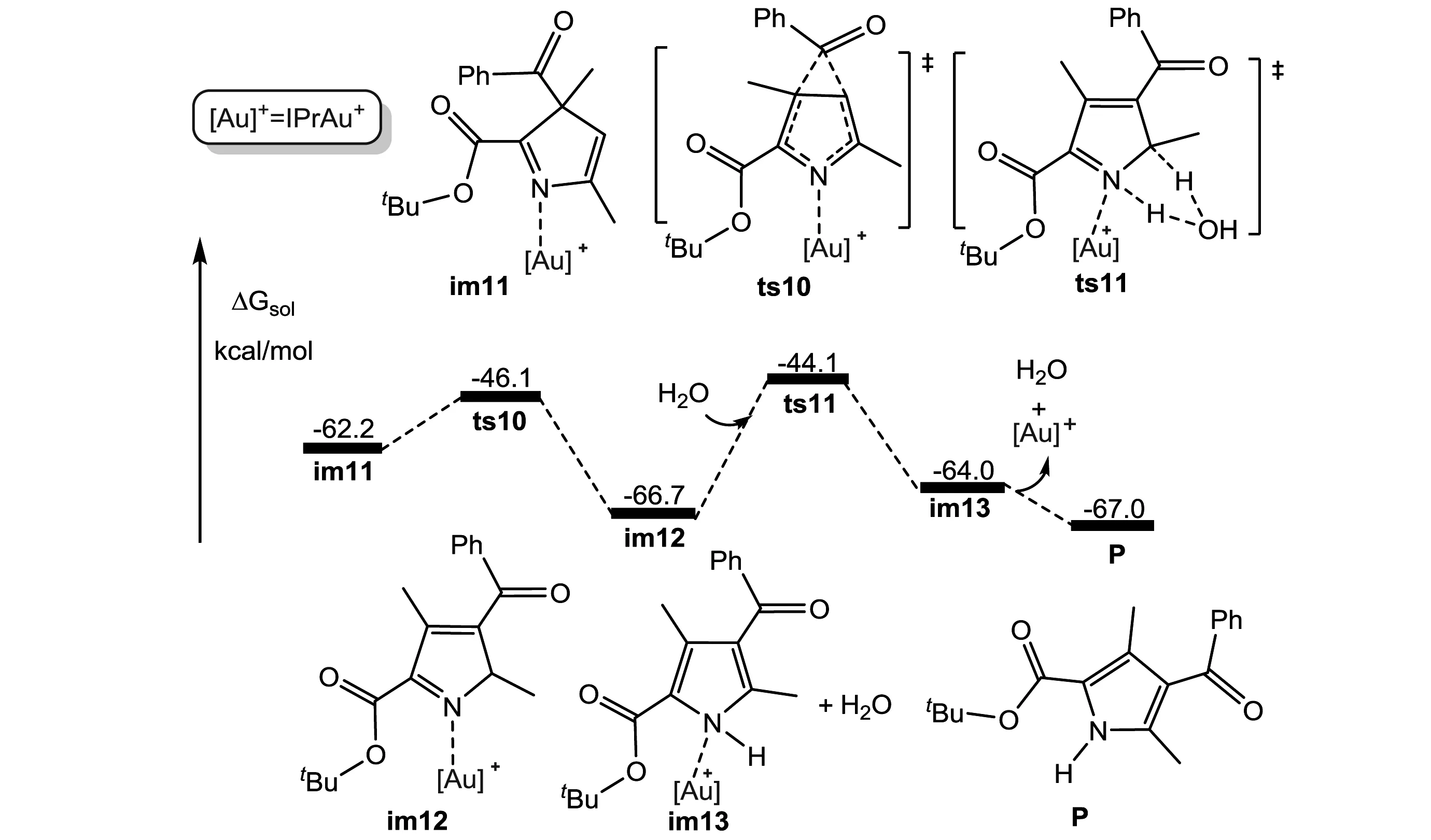
图7 —COPh基团再次迁移和水协助H转移步骤的势能面(相对自由能单位是kcal/mol)
综合图2到图7,不难看出,整个反应的决速步是七元环缩环为五元环的步骤,总能垒29.8 kcal/mol.决定选择性的步骤是形成七元环中间体之后的扩环或缩环步骤.由于O原子的电负性比N原子大,更富电子,亲核进攻C原子相对容易,所以缩环过渡态ts8明显低于扩环过渡态ts4,导致P为该反应的产物,与实验现象一致.
3 结 论
本文中,我们用DFT方法研究了金催化的丙炔酸盐与3,5-二甲基异恶唑的环化反应机理.我们详细探讨了该反应的机理,主要包括以下步骤:3,5-二甲基异恶唑的开环、七元环中间体的形成、七元环缩环为五元环以及氢转移.其中,七元环缩环为五元环是反应的决速步.该反应的区域选择性起源于O原子和N原子的电负性的差异,因为O原子的电负性比N原子大,所以O更易于发生亲核进攻.
