多花黄精组培再生体系构建及驯化研究
2021-04-22杨寻
杨 寻
(成都农业科技职业学院,四川 成都 611130)
多花黄精(Polygonatumcyrtonema Hua)又名囊丝黄精,为百合科(Liliaceae)黄精属多年生草本植物,自然分布于河南、江苏、安徽、浙江、江西、福建和贵州等省,生于林下、灌丛或山坡阴处,其根状茎肥厚,通常为连珠状或结节成块而像姜形[1],故又名姜形黄精,含黏液质、淀粉、糖分、蒽醌类化合物、多种氨基酸和维生素等成分,可供食用,花可供观赏。地下茎除食用外,还可入药,为《中华人民共和国药典》记载的中药黄精的原植物之一[2]。其根状茎既供药用,又可食用,具养阴润肺、补脾益气、滋肾填精之功效,黄精始载于《名医别录》,是中医临床常用补虚药,味甘,性平,有补气养阴、健脾、润肺、益肾的功效。
目前,多花黄精的繁殖方法有种子繁殖(有性繁殖)和根状茎(无性繁殖)2种。种子繁殖存在收集难度大、发芽率低、育苗周期长和后代性状分化严重等问题[3];根状茎繁殖存在繁殖率低和多次繁殖容易积累病毒等缺点。因此,目前多花黄精种苗问题成为制约黄精人工大规模种植的瓶颈[4]。组织培养既能实现植物个体的快速大量繁殖,又能较好地保持植物的种质特性[5],可实现多花黄精的工厂化育苗和优良品种的加快推广[6]。
1 材料与方法
1.1 试验材料
从市场买入长势较好、无病虫害的多花黄精品种。本试验选取的是多花黄精的带芽根状茎作为外植体。
1.2 试验方法
1.2.1 外植体的消毒及预处理
将外植体表面的泥土用自来水洗净,转移到超净工作台内的灭菌烧杯中,用无菌水冲洗3次,将其用75%的酒精浸泡消毒15s,用无菌水漂洗1次,用10%的次氯酸钠溶液浸泡消毒5min,用无菌水漂洗3次[7]。沥水后待用。
1.2.2 不定芽的诱导
将已消毒的多花黄精带芽根状茎接种于MS基本培养基上,设置6-BA(0.5mg·L-1、1.0mg·L-1、1.5mg·L-1)加NAA(0.1mg·L-1、0.2mg·L-1、0.3mg·L-1),共9个处理组合进行不定芽诱导培养,每个处理接种15个外植体,重复3次,具体见表1。从中筛选出适宜不定芽诱导的最佳培养基,并对其不定芽的生长数进行统计。
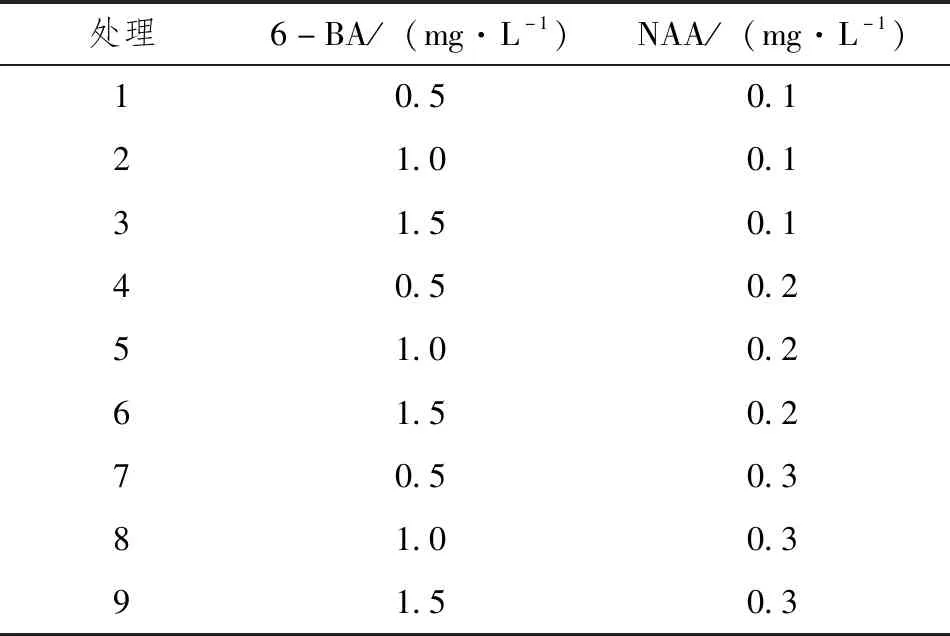
表1 不同植物生长调节剂的配比方案
1.2.3 生根培养
将增殖培养后生长健壮的单苗转移至不定根诱导培养基。以1/2MS为基本培养基,设置NAA(0.2mg·L-1、0.3mg·L-1、0.4mg·L-1、0.5mg·L-1、0.6mg·L-1、0.7mg·L-1),共6个处理,每个处理接种15个外植体,重复3次,具体见表2。从中找出适宜生根的最佳培养基,并记录生根情况。
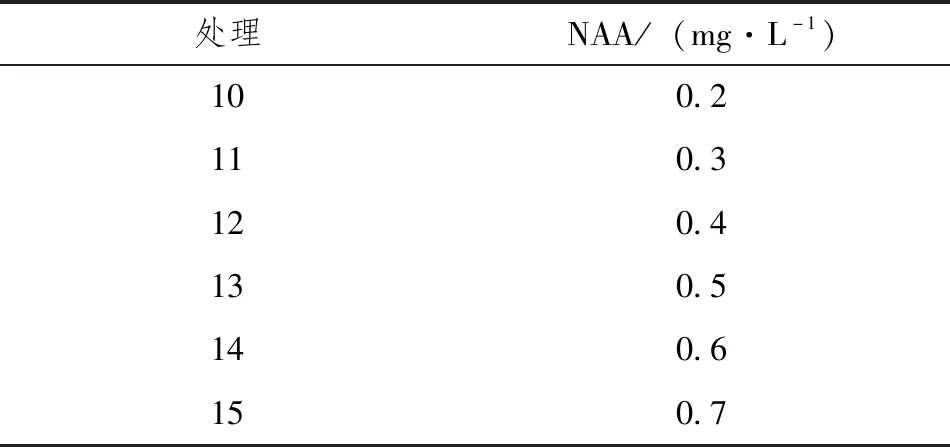
表2 植物生长调节剂NAA的添加量
1.2.4 组织培养条件
培养基内琼脂浓度6.5g·L-1,蔗糖浓度30g·L-1,pH值5.8。培养时光照时间12h·d-1,光照强度1500~2000lx,温度24±2℃。
1.2.5 组培苗的炼苗与移栽
将已生根的组培苗放入日光温室炼苗1~2周,选取生根多于4条、平均根1cm以上的根状茎,移植时将生根苗从培养瓶中小心取出,用清水洗净组培苗根部培养基后进行移栽。栽种到已灭菌的基质。
采用单因素试验设计,除栽培基质组成不同外,其余栽培条件完全相同。设3种基质组合:A处理为100%泥炭土,B处理为V泥炭土∶V蛭石∶V珍珠岩=3∶1∶1,C处理为V泥炭土∶V椰糠=3∶1;具体见表3。育苗容器为育苗筛,规格为42.5cm×45cm×5.5cm,每筛移植45株,3次重复,每隔7d施用1次营养液,30d后统计成活率。

图1 组培苗的生长情况

表3 不同基质处理的配比方案
2 结果与分析
2.1 植物生长调节剂组合对不定芽诱导的影响
将外植体接种在不同植物生长调节剂组合的培养基中,2~3周后腋芽在9个处理中均能正常展叶,具体见表4。结果表明,在处理1、2、3中,NAA添加量为0.1mg·L-1时,不定芽诱导数量较少;在处理4、5、6中,NAA添加量为0.2mg·L-1时,不定芽诱导数量较多;但是在处理7、8、9中,当NAA增至0.3mg·L-1时,不定芽诱导数量有所减少。在6-BA(0.5mg·L-1、1.0mg·L-1、1.5mg·L-1)加0.2mg·L-1NAA组合中,其中0.5mg·L-16-BA加0.2mg·L-1NAA组合的培养基长势最好,叶片舒展,颜色深绿,且不定芽诱导数量最多。
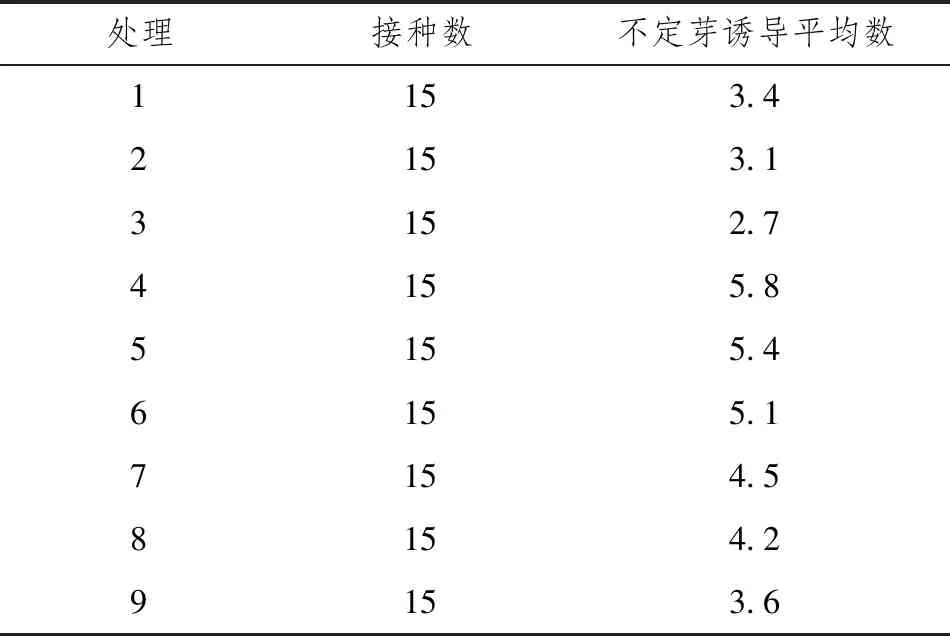
表4 植物生长调节剂组合对不定芽生长情况的影响
综合不定芽诱导数量及新芽生长情况来看,MS加0.5mg·L-16-BA加0.2mg·L-1NAA为诱导不定芽的最佳培养基。
通过多花黄精不定芽的诱导试验,继续不定芽的增殖培养,再对其获取的不定芽进行生根试验。
2.2 植物生长调节剂对不定芽生根的影响
将丛生芽分株后的单芽置于附加不同浓度NAA的1/2MS生根培养基,于4周左右发现凸根,继续培养1~2周后大部分根长至1.0~2.0cm。由表5可以看出,不同浓度的NAA均可诱导多花黄精组培苗生根。其中,添加0.5mg·L-1NAA诱导生根的效果最好,生根平均数最多,根粗且长,生长力旺盛。
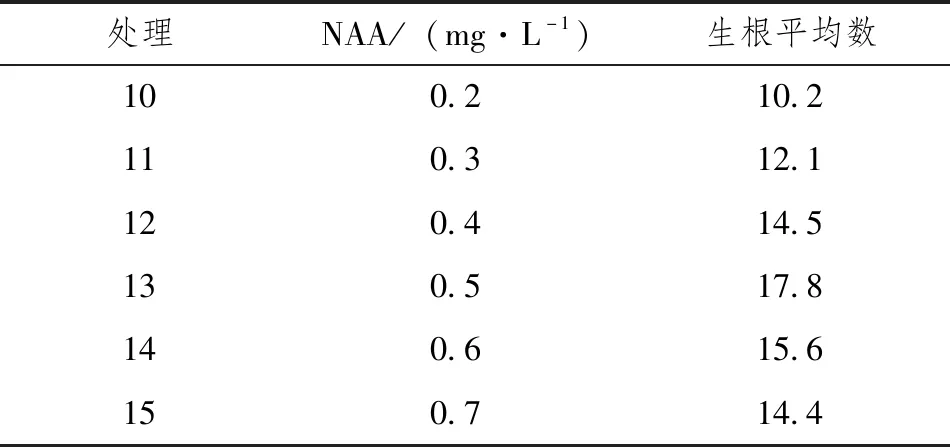
表5 植物生长调节剂对不定芽生根的影响
综合生根数量及长势来看,最适宜的生根培养基为1/2MS加0.5mg·L-1NAA。
2.3 不同基质处理对多花黄精组培苗成活率的影响
不同基质配比对多花黄精组培苗的成活率有显著影响,处理C中的多花黄精组培苗的成活率最高,达85.19%;处理B中的组培苗成活率次之,为75.56%;处理A中的组培苗成活率最低,仅为60.74%。方差分析与多重比较分析显示,组培苗的成活率在不同基质处理间表现出极显著差异(p<0.01),具体见表6。

表6 不同基质处理对多花黄精组培苗成活率的影响
3 结论与讨论
本研究以多花黄精带芽根状茎为外植体,成功建立了多花黄精组织培养再生体系。研究结果表明,最佳的不定芽诱导培养基为MS加0.5mg·L-16-BA加0.2mg·L-1NAA,最佳的生根培养基为1/2MS加0.5mg·L-1NAA。许多研究表明,泥炭土和蛭石有利于提高组培苗的成活率[8-10]。对于多花黄精而言,纯泥炭土中的组培苗成活率相对较低,在泥炭土中加入蛭石和珍珠岩提高了成活率,在泥炭土中加椰糠能显著提高成活率。所以在本研究中,V泥炭土∶V椰糠=3∶1是提高多花黄精组培苗移栽成活率的最佳基质配比。试验中另将多花黄精组培苗在进行不定芽诱导和增殖培养后,经过短期的炼苗处理,将其移栽于基质中,也有部分组培苗成活,这或许为多花黄精的工厂化育苗提供了一个新方向,具体试验过程有待进一步研究。
