2020年V1版《NCCN结直肠癌遗传高风险评估指南》更新要点解读*
2021-04-22高显华刘连杰张卫
高显华,刘连杰,张卫△
1 海军军医大学附属长海医院肛肠外科 上海 200433
2 海军军医大学附属长海医院遗传性结直肠癌筛查防治中心和遗传性肿瘤家庭阻断中心 上海 200433
遗传性结直肠癌(hereditary colorectal cancer,HCRC)是指由于可遗传的基因突变(即胚系基因突变)引起的结直肠癌(CRC)。大约20%的CRC患者有家族史,其中约5%是HCRC。与散发性CRC相比,HCRC发病年龄更年轻、多原发癌更常见、罹患其他癌症的风险更高,且常有癌症家族史[1-2]。结合新近的文献和循证医学证据,《NCCN结直肠癌遗传高风险评估指南》每年更新2~3次。2020年7月21日NCCN在线发布了2020年V1版《NCCN结直肠癌遗传高风险评估指南》(以下简称“本指南”)[3]。本指南与2019年V3版[4]相比,有较多将影响临床实践的重要更新,我们将对这些更新内容进行解读。
1 林奇综合征(LS)的筛查、基因突变结果解读和监测的更新
1.1 强调微卫星不稳定性(MSI)和错配修复缺陷(dMMR)检测在LS筛查中的作用
本指南增加了一条LS的筛查标准:表现为高度微卫星不稳定(MSI-H)或dMMR,且没有MLH1启动子甲基化的任何肿瘤,都需要行错配修复基因(MMR)的胚系突变检测。特别说明,MSI的检测方法可以是PCR法或者二代测序法(NGS),并分别阐述了PCR法和NGS法检测MSI的总原则。
1.2 反复强调了MMR基因的体系突变检测在明确LS致病原因中的重要性
对于肿瘤筛查结果(MSI、dMMR、BRAF V600E突变和MLH1启动子甲基化检测)和MMR基因胚系突变检测结果不相符时,均建议行配对的MMR基因胚系突变检测和体系突变检测。研究[5-6]表明,有45%~68%的原因不明的dMMR(MSI-H和/或IHC异常,且无证据表明MLH1启动子超甲基化)具有MMR基因的双重体细胞突变(两个致病性变异或一个致病性变异和杂合性丢失)。由于MMR基因双重体细胞突变或LS导致的病例比例因免疫组化结果而异,这可能有助于决定是先行胚系突变检测,还是先行配对的体系突变和胚系突变检测[7]。肿瘤组织的体系突变检测有助于指导那些肿瘤筛查为dMMR,而又未检测到胚系突变的病例的治疗。如果发现双重体细胞突变,则建议对这些患者及其近亲属根据其家族史进行处理,而不是按照LS进行处理。如果发现双重体细胞突变,即便LS已经被排除,他们家族中发生癌症的风险仍然较高。如果仅发现一个体细胞致病性变异,则未识别的致病性变异可以是胚系或体系突变。如果没有发现体细胞致病性变异,则免疫组化结果可能是不正确的(特别是当肿瘤测序发现肿瘤表现为微卫星稳定)或者没有可识别的致病性变异(胚系或体系)。
1.3 分别列出了不同致病基因引起的LS患者各种癌症的风险和监测策略
本指南最大的修改在于,根据不同的致病基因分别列出了各种癌症的发病风险和监测策略(详见表1和表2)。

表1 不同基因突变引起的LS患者各种癌症的平均发病年龄和80岁之前的累计发病风险
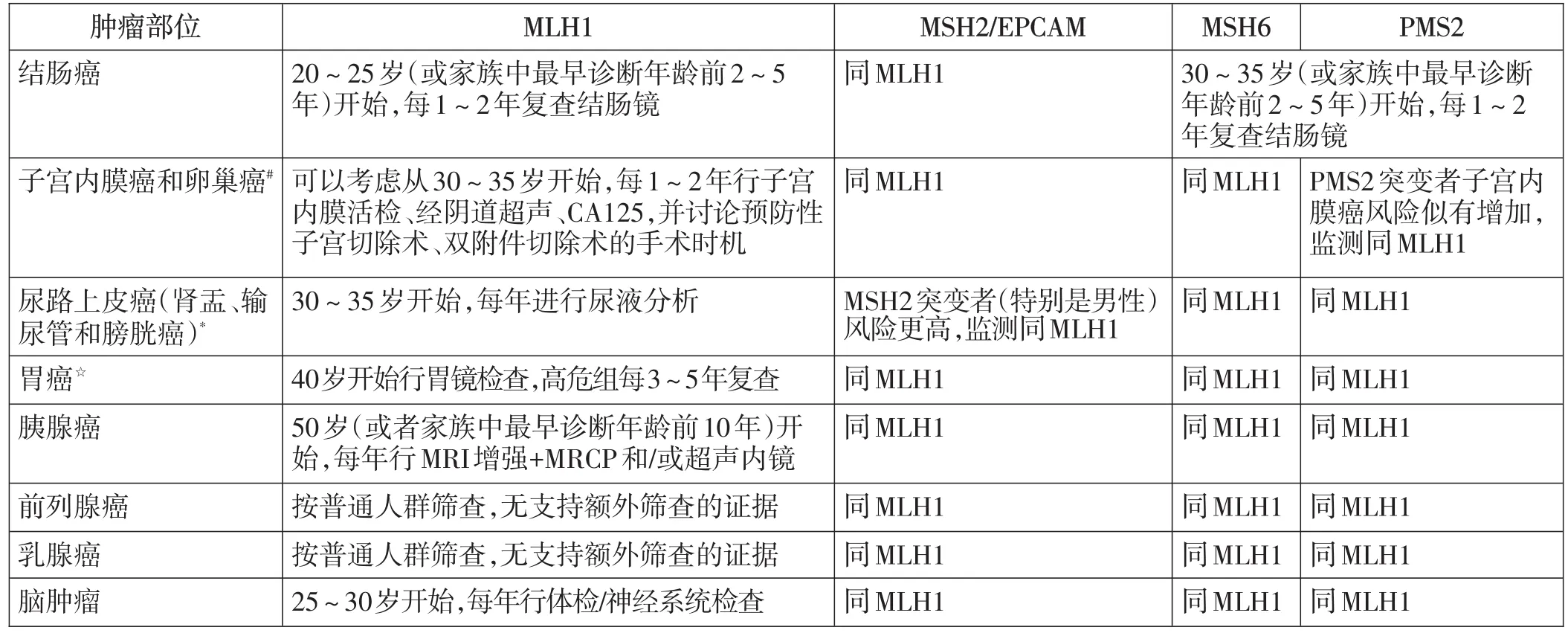
表2 不同基因突变引起的LS患者各种癌症的监测策略★
此外,对于LS伴结肠腺癌患者,应根据临床情况、年龄和致病性变异等因素,选择行节段性或扩大的结肠切除术。MLH1和MSH2基因突变携带者行节段性结肠切除术后,异时性CRC的累计终生风险高达43%,建议行扩大的结肠切除术。MSH6和PMS2突变者发生异时性CRC的风险较低,建议行节段性的结肠切除术。结肠或直肠手术后,如果有结肠或直肠残留,应每1~2年进行一次结肠镜检查。具有危险因素的患者,例如CRC病史、男性、MLH1/MSH2致病性变异、年龄>40岁和腺瘤病史,每年复查一次的获益优于每两年复查一次。对于拟行结肠手术的女性,建议在结肠切除术前转诊至妇科咨询,以讨论是否行预防性的全子宫+双侧附件切除术。关于胃癌和胰腺癌的推荐指南做了较多更新。
2 家族性腺瘤性息肉病(FAP)监测推荐意见的更新
强调了FAP患者行基因检查的重要性。建议与未行基因检测的先证者和高危家族成员讨论基因检测的优点,包括减少医疗费用和医疗负担,降低频繁行结肠镜检查的风险(如果排除了基因突变)。对于存在APC基因突变伴结肠息肉的轻表型FAP患者,取消了以21岁为治疗年龄的限制,分为内镜下能处理或不能处理的息肉负荷分别处理。内镜下能处理的行内镜下治疗,内镜下不能处理的考虑行全结肠切除术或全大肠切除术。对于存在APC基因突变,但是未发现结肠息肉的患者,本指南的推荐更加灵活。建议从15岁开始,每2年复查一次结肠镜。如果多次复查结肠镜未见腺瘤,则可根据临床判断,适当延长复查间隔。全大肠切除+IPPA术后的结肠镜复查,由“每1~3年一次”改为“每年一次”;如果有绒毛状组织学特征和/或高度不典型增生的大的扁平息肉,则缩短为每6个月一次。可以考虑采用化学预防来处理残余直肠和全大肠切除术后储袋中的进展性息肉负荷。对于十二指肠息肉的筛查,强调透明帽辅助的上消化道内镜足以实现十二指肠壶腹部的可视化。关于甲状腺癌和硬纤维瘤监测意见的更新内容见表3。

表3 FAP患者甲状腺癌和硬纤维瘤监测策略的推荐意见对比
3 MUTYH相关息肉病(MAP)管理的更新
关于MAP的管理,也取消了以21岁为治疗年龄的限制,只分为内镜下能处理或不能处理的息肉负荷分别管理。内镜下能处理的行内镜下治疗,内镜下不能处理的考虑行全结肠切除术或全大肠切除术。有MAP家族史且检测到MUTYH的双等位基因突变的患者,建议从25~30岁开始行结肠镜检查。如果未发现息肉,则每1~2年复查一次;如果发现息肉,每1~2年行结肠镜检查和息肉切除术,必要时评估和讨论是否行全结肠或全大肠切除术。从30~35岁开始进行十二指肠(含壶腹部)的监测。
4 致病基因不明的结肠腺瘤性息肉病(CPUE)
CPUE被定义为腺瘤≥10~20枚,且未找到息肉病相关基因的致病性变异的个体。同时,腺瘤数目统计的是终生累计腺瘤数目。在诊断为CPUE之前,强烈推荐进行包含所有息肉病相关基因和HCRC相关基因的多基因组合检测。腺瘤性息肉病相关基因包括但不限于APC、GREM1、POLE、POLD1和AX⁃IN2的单等位基因变异,以及MUTYH、NTHL1和MSH3中的双等位基因变异。对于以前根据临床指导进行过有限基因检测的患者,可以考虑更新基因检测。息肉数目越少,基因突变检出率越低。有研究[10]显示,10~19枚腺瘤的患者APC的检出率仅5%;20~100枚腺瘤,APC的检出率仅12%;100~1 000枚腺瘤,APC的检出率为54%;>1 000枚腺瘤,APC的检出率高达80%。
在临床实践中发现,CPUE的发生率很高,是临床上的一大诊治难点。本指南对CPUE的诊治指南进行了较多更新,2019年的指南将“一级亲属≥100枚腺瘤”按照亲属出现100枚以上腺瘤的年龄是否大于40岁而分为两组,并分别进行管理;在本指南中,取消了以40岁为界值的年龄分组,并对各个亚型的推荐意见进行了较多更新(表4)。
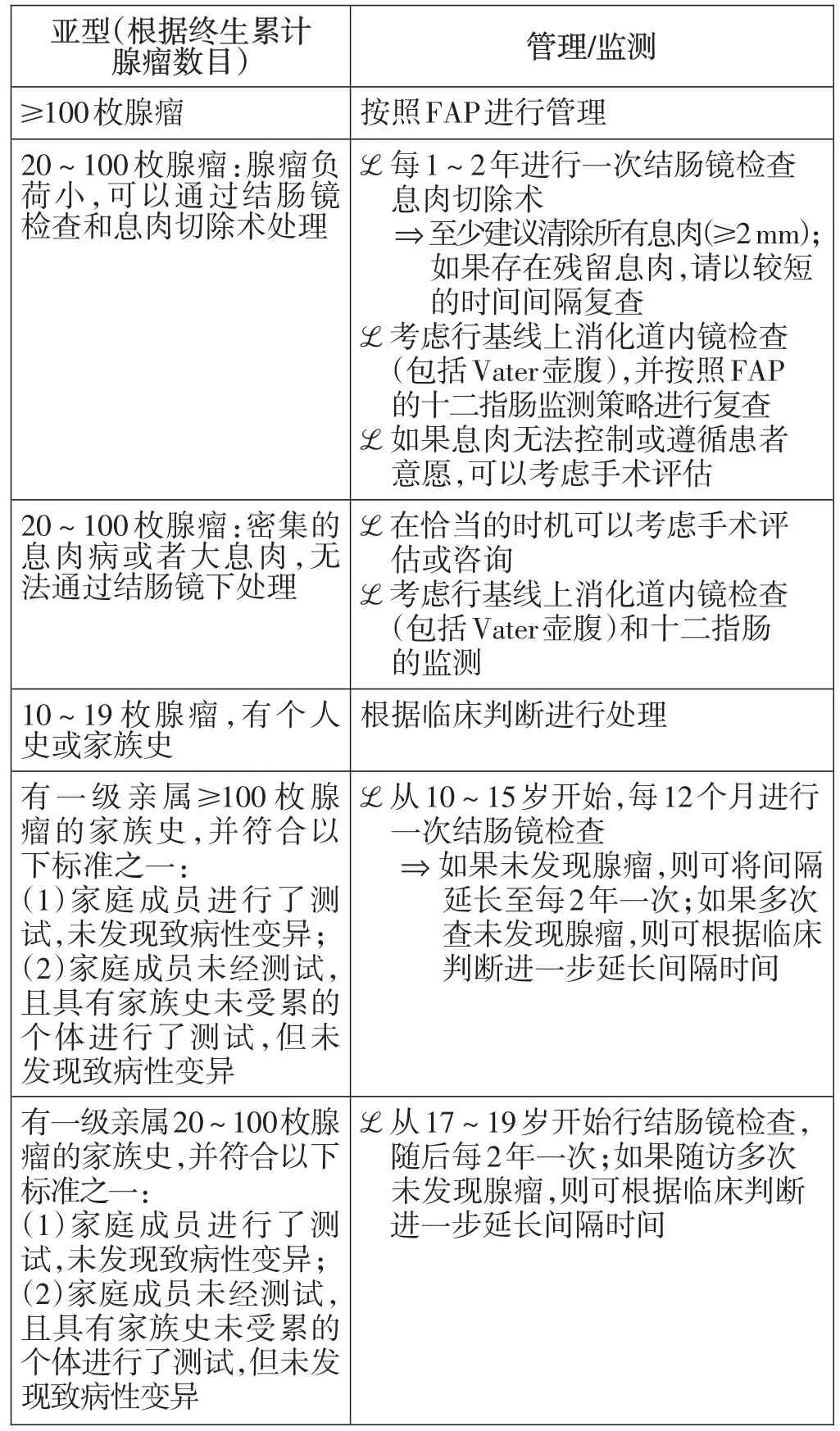
表4 本指南中关于CPUE的监测/管理建议
5 黑斑息肉病综合征(PJS)患者各种肿瘤监测建议的更新
PJS乳腺癌筛查的起始年龄从25岁推迟到了30岁。胰腺癌的筛查间隔期缩短了:2019年建议为每1~2年,2020年建议为每年行MRCP+增强扫描或者超声内镜。卵巢癌的筛查增加了一条内容:从8岁开始,每年体检,观察是否存在性早熟。
6 幼年性息肉病综合征(JPS)
更新了JPS患者结肠镜和上消化道内镜监测的频率,以及胃/结肠切除术的适应证。见表5。

表5 2020年V1版与2019年V3版的JPS管理更新要点比较

表5(续)
7 更新了锯齿状息肉病综合征(SPS)的定义和相关的致病基因
本指南对SPS的定义进行了更新,使之与WHO最新分类定义一致。SPS的新定义为满足以下至少一项经验标准:(1)直肠近端锯齿状病变/息肉≥5枚,所有息肉大小均≥5 mm,其中2枚≥10 mm;(2)在全大肠分布有超过20枚任何大小的锯齿状病变/息肉,其中5枚及以上位于直肠近端。最终的息肉计数中包括任何锯齿状病变/息肉的组织学亚型,息肉计数指的是多次结肠镜检查发现的累计数目。RNF43的单等位基因突变与MUTYH的双等位基因突变已被鉴定为SPS的罕见原因,但是大多数SPS的致病基因不明。SPS患者经常会出现腺瘤,应注意与FAP、MAP相鉴别。
8 强调基因突变检测在HCRC诊断、分型、治疗、监测和遗传阻断中的作用
本指南推荐符合筛查标准的CRC患者都进行基因的胚系突变检测,高危亲属也要进行家族突变基因的检测,并根据基因突变情况进行相应的治疗、监测和遗传阻断。此外,特别注明将“可能致病性变异”按照“致病性变异”来管理。关于基因突变检测的年龄,应根据需要进行医学管理的年龄来定:(1)如果怀疑为FAP需要早期行结肠镜筛查,建议提前至10~12岁进行基因突变检测;(2)PJS患者需要在8岁开始进行胃肠道和生殖系统肿瘤的监测,所以需要在8岁前完成基因突变检测;(3)SPS患者需要在15岁开始进行CRC和胃癌的筛查,所以需要在15岁之前行基因突变检测;(4)如果JPS家族中存在已知的SMAD4的致病性变异,由于存在遗传性出血性毛细血管扩张症(HHT)的风险,应在婴儿出生后6个月内进行基因突变检测。如果不存在上述情况,则可以待个体成年后,有能力选择医学管理方案时,再行基因突变检测。
9 多基因组合检测成为了疑似HCRC患者基因突变检测的首选方法
多基因组合检测的出现,迅速改变了HCRC高风险患者及其亲属的基因检测方法。NGS一次可以检测数十个甚至数百个基因,成本很低,具有更高的效率和成本效益。本指南概括了目前各种商业化的多基因组合基因列表中常见基因的CRC风险、证据强度、表型相关性和监测建议。这些基因包括APC、BM⁃PR1A、MLH1、MSH2、MSH6、PMS2、EPCAM、PTEN、STK11、SMAD4、TP53、GREM1、POLD1、POLE、AXIN2、CHEK2、ATM、BLM、GALNT12、RNF43和RPS20基因,以及MUTYH、NTHL1和MSH3的双等位基因变异、APC I1307K的致病性变异和MUTYH的杂合性变异。在本指南中,进一步强调了多基因组合检测的价值,成为了首选的基因检测方法,这一推荐也与目前的临床现状相符。
10 其他
由于HCRC的罕见性和诊断治疗的复杂性,建议将患者转诊至一个具有相关专业知识背景的医师或中心,并根据患者的基因型、表型和个体因素进行个性化管理,各种监测与检查也建议最好在专业中心进行。需强调家族史和个人史的重要性,根据家族史可能需要更早行结肠镜检查;有尿路上皮癌家族史的LS可能需要行尿路上皮癌的筛查;有卵巢癌家族史的LS可能需要行卵巢癌筛查;有硬纤维瘤个人史的FAP需要进行硬纤维瘤的筛查。
11 小结
2020年V1版NCCN指南根据新近的研究证据,在HCRC的筛查、诊断、遗传咨询和随访监测等方面提出了很多重要的更新。由于缺乏大样本高质量的循证医学证据,部分内容仍然存在争议。学习最新的指南并应用到临床实践当中,可以规范和统一HCRC的临床诊治和家系管理,助力我国HCRC诊治水平的提高。
