环境浓度TBBPA暴露对人正常肝细胞致癌风险研究
2021-04-21吕良苏瑞军晋小婷张立超李卓玉
吕良,苏瑞军,晋小婷,张立超,李卓玉*
(1.山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.山西大学 生物医学研究院,山西 太原 030006)
0 引言
四溴双酚A(Tetrabromobisphenol A,TBBPA)是目前全球广泛使用的溴代阻燃剂(BRFs)之一[1],因其热稳定性高而被添加用于环氧树脂、聚酯树脂等产品中,从而使产品拥有优良的阻燃性和自熄性。TBBPA在全球年产量近17万吨,其中我国是亚洲的生产大国[2]。近些年,TBBPA在各种环境介质中被检出,如沉积物、水体、土壤、大气等[3-5]。美国国家毒理学计划(NTP)研究证实,TBBPA暴露导致大鼠甲状腺激素水平改变,并发现TBBPA暴露增加了大肠癌的发病率[6]。2016年国际癌症研究中心(IARC)将TBBPA列为2A级致癌物质[7]。但环境浓度暴露下TBBPA对肝的致癌风险尚需进一步评估。
肝癌(Hepatocellular carcinoma,HCC)有较高发病率和死亡率,是五大常见癌症之一[8]。我国新诊断肝癌患者占全世界肝癌人数的60%,其死亡率居恶性肿瘤第二位[9]。在肝癌发生发展过程中,正常的肝细胞会从卵石状向长梭形转变,同时许多肝癌标志物的表达也会发生相应变化,对肝癌进展有重要影响。GPC-3是一种在肝癌组织中高表达的蛋白,是肝癌早期的敏感标记物[10]。MMP-2和MMP-9是基质金属蛋白酶家族的重要成员,在肝癌组织中的表达高于癌旁组织,主要参与破坏细胞外基质,促进肿瘤细胞浸润和转移[11]。VEGF是血管生成因子,在肝癌组织中高表达[12]。肿瘤细胞中高表达的VEGF分泌到肿瘤微环境,能够促进肿瘤相关血管的生成,从而利于肿瘤细胞生长、浸润以及转移[13-15]。因此,通过检测上述肝癌标志物表达量的变化,能够有效地评估环境浓度TBBPA长期暴露的致肝癌风险。
有研究表明高浓度TBBPA引起人正常肝细胞L02氧化应激ROS升高,降低细胞线粒体膜电位(MMP)并增加细胞凋亡水平[16]。TBBPA对肝癌细胞HepG2的毒性作用及剂量研究表明,TBBPA对HepG2细胞具有明显毒性,基准剂量值为 9.45 μmol/L[17]。并随TBBPA浓度增加(>1 μmol/L)HepG2细胞活力下降,ROS过量生成及细胞凋亡增加[18]。Chen等研究表明暴露于600 mg/kg的TBBPA会损害鲷鱼肝脏[19]。Arnon等研究表明TBBPA对肝脏毒性主要是对组织损害[20]。Yang等研究表明慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪肝的病因与肝细胞凋亡密切相关[21]。然而,低剂量的环境浓度TBBPA暴露对肝癌的风险尚未报道。因此本研究以人正常肝细胞系HL-7702为材料,用低剂量环境浓度的TBBPA进行长期暴露,检测细胞在形态学和分子层面的变化。探讨TBBPA与肝癌发生发展的相关性,可为环境浓度TBBPA长期暴露的致肝癌风险提供一定的理论依据。
1 材料与方法
1.1 材料、试剂与仪器
HL-7702细胞(ATCC,USA),胎牛血清(Gibco,USA),RPMI-1640培养基(Minibio,China),TBBPA(St.Louis,Mo,USA),DMSO(Solarbio,China),反转录试剂盒(TransGen Biotech,China),CO2细胞培 养 箱(Eppendorf Galaxy170S),倒 置 显 微 镜(Zeiss,Germany),实 时 定 量 PCR 仪(Bio-Rad,USA)。
1.2 HL-7702细胞的培养
人源正常肝细胞HL-7702培养于37℃,体积分数为5% CO2,恒温恒湿条件下。所用培养基为含10%胎牛血清的RPMI-1640培养基。
1.3 细胞毒性测定
采用CCK-8对细胞存活率进行测定。将生长状态良好的HL-7702细胞用胰酶消化,1 000 r/min离心并制成细胞悬液,接种到96孔板中(2×103个/孔)。人体血液样本中TBBPA的浓度约为1.3×10-8mol/L~9.5×10-12mol/L[22],因此在细胞贴壁后,对照组用空白培养基处理,实验组用含浓度为1.00×10-12、1.00×10-11、1.00×10-10、1.00×10-9、1.00×10-8、1.00×10-7、1.00×10-6、1.00×10-5、1.00×10-4mol/L的TBBPA培养基处理,24 h更换一次培养基,48 h后更换无血清培养基并加入CCK-8,2 h后450 nm下测定吸光值。
1.4 细胞形态观察
将2×106个对数期HL-7702细胞接种于75 cm2培养瓶中,待细胞贴壁后,用倒置显微镜拍摄0周时细胞形态图像。将细胞计数,取2×106个细胞继续传代培养,收集余下的细胞作为0周时细胞样。待传代细胞贴壁后,弃培养基并用PBS缓慢洗3次,加入10 mL含1.00×10-8mol/L的TBBPA培养基处理1周,并拍摄1周时细胞形态图像。将细胞计数,取2×106个细胞继续传代培养,收集余下的细胞作为1周时细胞样。第2、3和4周的处理方法与第一周相同。
1.5 实时荧光定量PCR
收集TBBPA暴露处理0、2、4周后的HL-7702细胞样品,加入Trizol提取总RNA,并利用反转录试剂盒反转录成cDNA模板,然后于实时定量PCR仪进行qRT-PCR分析。内参GAPDH基因将目的基因mRNA表达量进行均一化处理。基因表达变化的计算采用倍增变化率表示,倍变化增率=2-△△Ct(△Ct为目的基因和内参基因Ct值的差值)。实验引物序列见表1。

表1 引物序列Table1 Primer sequences
1.6 集落形成实验
将TBBPA暴露处理0、2、4周的HL-7702细胞接种于24孔板中(5×103个细胞/孔),用空白培养基培养3 d。吸弃培养基,PBS缓慢清洗3次,加入4%多聚甲醛室温固定20 min。吸弃4%多聚甲醛,PBS缓慢清洗3次,加入700 μL 0.5%结晶紫染色液,染色15 min。吸弃染色液,PBS缓慢清洗3次,室温干燥。用显微镜对染色后的细胞进行拍照,每组重复3次。将拍照后的细胞每孔加入700 μL 1% SDS溶液,室温孵育20 min后混匀,每孔吸取100 μL加入96孔板中(6组平行),用酶标仪在波长570 nm下检测吸光值。集落形成率=(实验组吸光值/对照组吸光值)×100%。
1.7 锚着独立性生长实验
用RPMI-1640培养基配制1.4%的琼脂糖溶液高温高压灭菌15 min,稍冷后放入39℃恒温水浴锅中保温,然后加入预温的含20%胎牛血清的RPMI-1640培养基稀释成0.7%琼脂糖溶液。取6孔板,每孔加入1.5 mL 0.7%琼脂糖溶液铺制底层琼脂,凝固后备用。分别将TBBPA暴露处理0、2、4周的HL-7702细胞与等体积的0.7%琼脂糖溶液与细胞悬液充分混匀,使上层琼脂糖终浓度为0.35%,每孔加1 mL,接种细胞密度为5×103个细胞/孔。待顶层琼脂凝固后每孔加入1 mL空白培养基。在37℃,体积分数为5% CO2,恒温恒湿条件下进行培养(每3天更换一次培养基)。待长出单细胞克隆团时,吸弃培养基,显微镜下观察并拍照,统计每组克隆的单细胞克隆数。克隆形成率=(克隆数/接种细胞数)×1000‰,用mean±SD表示。
1.8 统计学分析
实验数据采用GraphPad Prism 7.0和SPSS软件进行分析,用t检验对样本均值进行比较,结果以平均值±标准差(Mean±SD)表示,*P<0.05,**P<0.01,表示差异有统计学意义。
2 结果与分析
2.1 环境浓度TBBPA短期暴露对人正常肝细胞存活率没有影响
首先采用CCK-8检测不同浓度的TBBPA短期暴露对HL-7702细胞存活率的影响情况。如图1所示,TBBPA在环境浓度(1.00×10-12~1.00×10-8mol/L)下对细胞存活率影响不大,而浓度大于1.00×10-8mol/L时,随着浓度的增加细胞存活率逐渐降低,数据表明环境浓度下的TBBPA对肝正常细胞的存活率没有显著影响。因此,将采用1.00×10-8mol/L的TBBPA长期暴露,探究TBBPA对HL-7702细胞的致癌风险。
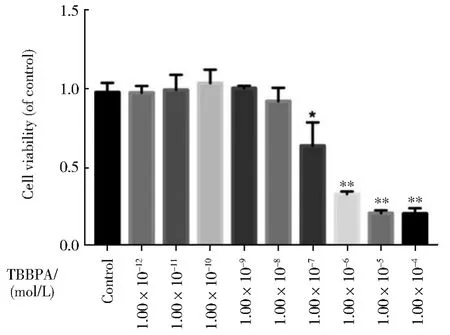
图1 环境浓度TBBPA短期暴露对人正常肝细胞的存活率没有影响(与对照组相比,*P<0.05,**P<0.01,n=6)Fig.1 No effect of liver cells viability rate by short-term TBBPAexposure can be observed(Compared with the control,*P<0.05,**P<0.01,n=6)
2.2 环境浓度TBBPA长期暴露对人正常肝细胞形态变化影响
用1.00×10-8mol/L的TBBPA暴露细胞1~4周后,细胞形态变化见图2。由图2可知,对照组细胞呈正常的鹅卵石形状。经TBBPA暴露后,细胞数量变化不明显,部分细胞出现细长梭形的形态,细胞间空隙增大,细胞出现丝状伪足,呈现癌细胞的迁移形态特征。结果表明:环境浓度TBBPA长期暴露引起细胞形态学改变,表明环境浓度TBBPA长期暴露对HL-7702细胞有诱发细胞癌变的风险。
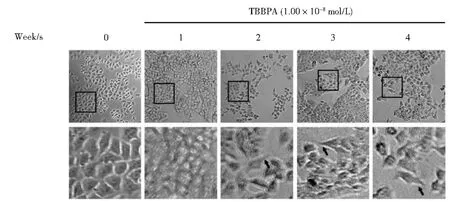
图2 环境浓度TBBPA长期暴露对人正常肝细胞形态变化影响(黑色箭头指示为细胞伪足,n=3)Fig.2 Effect of morphological in liver cells by long-term TBBPAexposure(Black arrows showed pseudopod of cells,n=3)
2.3 环境浓度TBBPA长期暴露对肝癌早期标志物GPC-3的影响
检测环境浓度TBBPA暴露HL-7702细胞0、2、4周后,肝癌早期标志物GPC-3的表达情况。结果表明,GPC-3表达量随TBBPA暴露时间增加而显著升高,表明环境浓度TBBPA长期暴露对HL-7702细胞有诱发癌变的风险。
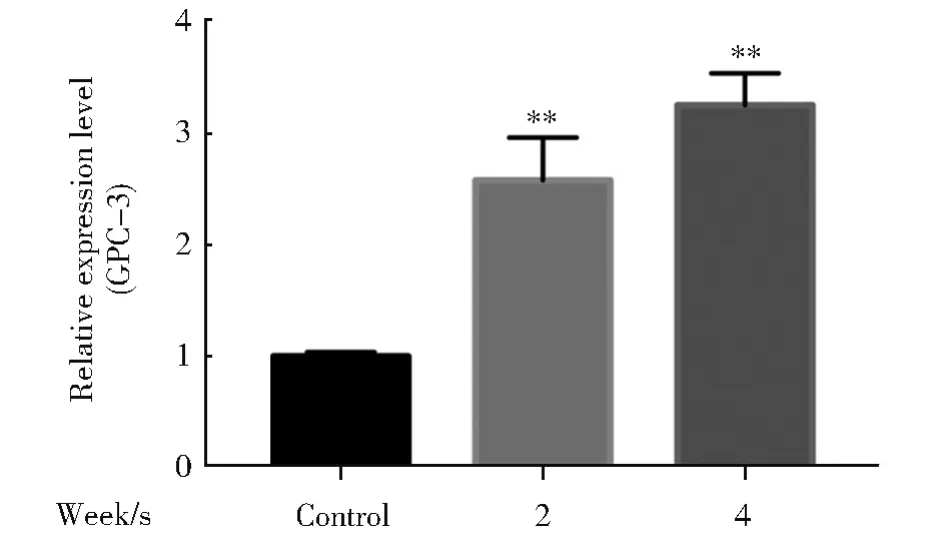
图3 环境浓度TBBPA长期暴露对肝癌早期标志物GPC-3的影响(与对照组相比,*P<0.05,**P<0.01,n=3)Fig.3 Effect of long-term TBBPAexposure in early marker of liver cancer GPC-3(Compared with the control,*P<0.05,**P<0.01,n=3)
2.4 环境浓度TBBPA长期暴露对肝癌浸润、转移主要标志物MMPs的影响
检测环境浓度TBBPA暴露HL-7702细胞0、2、4周后,肝癌浸润、转移标志物MMP-2和MMP-9的表达情况。如图4所示,随TBBPA暴露时间增加,MMP-2表达量略有升高,MMP-9的表达量显著升高。结果表明:环境浓度TBBPA长期暴露能够引起HL-7702细胞浸润和转移标志物表达升高,有诱发细胞癌变的风险。

图4 环境浓度TBBPA长期暴露对肝癌浸润、转移主要标志物MMPs的影响(与对照组相比,*P<0.05,**P<0.01,n=3)Fig.4 Effect of long-term TBBPAexposure in MMPs,the major marker of liver cancer infiltration and metastasis(Compared with the control,*P<0.05,**P<0.01,n=3)
2.5 环境浓度TBBPA长期暴露对肿瘤相关血管生成关键标志物VEGF的影响
检测环境浓度TBBPA暴露HL-7702细胞0、2、4周后,细胞中血管生成标志物VEGF的表达情况。如图5所示,结果表明:VEGF表达量随TBBPA暴露时间增加而显著升高,这说明环境浓度TBBPA长期暴露促进HL-7702细胞血管生成关键标志物VEGF基因表达,有诱发细胞癌变的风险。
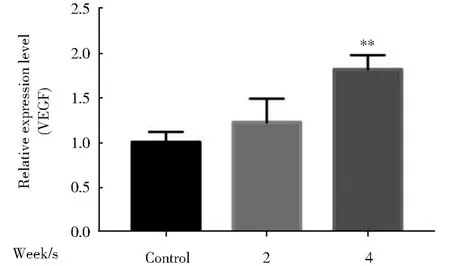
图5 环境浓度TBBPA长期暴露对肝癌瘤内血管生成关键标志物VEGF的影响(与对照组相比,*P<0.05,**P<0.01,n=3)Fig.5 Effect of long-term TBBPAexposure on VEGF,the key marker of angiogenesis in liver cancer(Compared with the control,*P<0.05,**P<0.01,n=3)
2.6 环境浓度TBBPA长期暴露对细胞集落形成的影响
检测TBBPA暴露处理0、2、4周的HL-7702细胞的集落形成情况,结果如图6所示。结果表明:与对照组相比,集落形成数量随暴露时间增加而显著增加(图6 A),图6 B为定量统计图,这说明环境浓度TBBPA长期暴露能促进HL-7702细胞集落的形成,有诱发细胞癌变的风险。
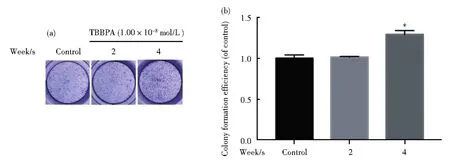
图6 环境浓度TBBPA长期暴露对细胞平板克隆形成率的影响(与对照组相比,*P<0.05,**P<0.01,n=3)Fig.6 Effect of long-term TBBPAexposure in colony formation efficienty of cells(Compared with the control,*P<0.05,**P<0.01,n=3)
2.7 环境浓度TBBPA长期暴露对细胞软琼脂克隆形成的影响
软琼脂锚着独立生长能力和细胞的侵袭性密切相关。图7结果表明,与对照组相比,软琼脂克隆形成率随暴露时间增加而增加,对照组克隆形成率为(1.67±0.54)‰,TBBPA暴露2周组克隆形成率为(1.89±0.42)‰,TBBPA暴露4周组克隆形成率为(2.28±0.16)‰。表明环境浓度TBBPA长期暴露能增强HL-7702细胞锚着独立生长能力,有诱发细胞癌变的风险。
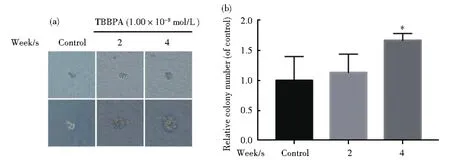
图7 环境浓度TBBPA长期暴露对细胞软琼脂克隆形成的影响(与对照组相比,*P<0.05,**P<0.01,n=3)Fig.7 Effect of long-term TBBPAexposure in soft agar colony formation of cells(Compared with the control,*P<0.05,**P<0.01,n=3)
3 讨论
肝脏是人体中控制葡萄糖代谢、脂质代谢和有害物质排出的关键器官[23],是应激反应的主要器官,具有多种抗压的酶[24-27]。环境污染物暴露能引起肝功能异常[28],诱发肝脏病变。TBBPA暴露能引起肝母细胞瘤、血管瘤和大肠肿瘤的发病率增加[29]。有研究表明,TBBPA暴露引起子宫内膜癌细胞Ishikawa细胞形态明显改变,由卵圆形变成长梭形,少数细胞出现丝状伪足[22]。Voulgari等研究发现肿瘤细胞在浸润和转移过程中,细胞形态变细长并出现伪足[30]。在本研究也得到相似结果,发现长期环境浓度TBBPA暴露能够诱导肝正常细胞发生明显的形态改变,提示有引起肝细胞癌变的风险。肝癌标志物GPC-3、MMPs和VEGF对原发性肝癌的检测诊断非常重要。GPC-3在HCC组织中高度表达,有文献表明GPC-3可以作为肝癌的一种新的早期标志物[10,31]。本研究中环境浓度 TBBPA 长期暴露人HL-7702细胞后,早期肝癌标志物GPC-3在第2周就发生显著升高,表明GPC-3响应敏感,预示细胞有早期癌变趋势。MMPs是肿瘤细胞恶化时破坏细胞外基质的主要参与者,其典型代表MMP-2和MMP-9与肿瘤细胞的浸润和转移关系最为密切,且MMP-2和MMP-9的高表达是肿瘤细胞发生浸润和转移的重要因素之一[11]。有研究表明,TBBPA显著诱导人乳腺癌MCF-7细胞中MMP-9的表达升[32]。McCormick等在TBBPA暴露斑马鱼研究发现,MP P-2、MMP-9和MMP-13表达增加2 ~ 8[33]。在本研究中,TBBPA暴露4周后,HL-7702细胞中MMP-2和MMP-9表达显著增加,表明TBBPA暴露可以通过影响MMP-2和MMP-9表达来促进肿瘤的恶化。
VEGF与血管生成密切相关,参与肿瘤的生长、浸润和转移,在肝癌组织中VEGF常常高表达,并分泌到微环境中促进肿瘤相关血管的生长[12-15]。VEGF能特异性结合血管内皮细胞上的受体,促进血管生成,从而维持肿瘤的继续生长[34-35]。Zheng等研究发现,PM2.5细颗粒物暴露人肺上皮细胞和肺微血管内皮细胞引起 VEGF、IL-6、MDM-2、AKT-1、STAT、和P-53表达失调,在一定程度上解释了PM2.5细颗粒物的致癌分子机制[36]。本研究中TBBPA长期暴露HL-7702细胞后,能够诱导细胞中VEGF表达显著升高,为TBBPA通过促进血管生成增加致癌风险提供一定的依据。
集落形成和锚着独立生长实验是检测肿瘤细胞生物学特性常用的方法[37]。肿瘤细胞失去接触抑制,可在平板中形成集落或在半固体琼脂培养基中形成克隆,具有锚着独立生长能力,是恶性肿瘤细胞重要标志[38]。李世珍等研究表明,铀矿粉暴露支气管上皮细胞诱导细胞呈锚着不依赖性增长,获得了恶性细胞特征[39]。唐莹等研究表明,高剂量烟尘染毒肺泡II型上皮细胞,细胞软琼脂克隆能力增强,预示高剂量烟尘染毒引起细胞恶性转化[38]。本研究中TBBPA长期暴露HL-7702细胞后,随暴露时间增加,HL-7702细胞的集落形成率和软琼脂克隆率增加,说明TBBPA长期暴露诱导HL-7702细胞呈现锚着不依赖性生长,获得了某些恶性细胞的生物学特性,为TBBPA长期暴露增加致癌风险提供实验依据。
4 结论
本研究结果表明,环境浓度TBBPA长期暴露人正常肝细胞HL-7702后,诱导细胞形态呈长梭形,细胞间隙变大,出现丝状伪足,呈现癌细胞特征。此外,细胞内早期肝癌标志物GPC-3、MMPs和VEGF的表达量显著升高,细胞集落形成和锚着独立生长能力增强。表明环境浓度TBBPA长期暴露有诱发肝细胞癌变的风险,该结果为评价TBBPA的致癌风险奠定了一定的理论基础。
