N掺杂荧光碳点对姜黄素的免标记检测及细胞成像
2021-04-21胡军辉梁帆刘洋宋胜梅董川双少敏
胡军辉,梁帆,刘洋,宋胜梅,董川,双少敏
(山西大学 环境科学研究所,化学化工学院,山西 太原 030006)
0 引言
姜黄素(curcumin,Cur),1,7-双-(4-羟基-3-甲氧基苯基)-1,6-庚二烯-2,5-二酮,是一种天然多酚色素,来自姜黄的根茎[1]。它可以用于制作胶囊、药丸、片剂或草药补充剂,同时它也是食用色素和食品调味剂中的常用成分。由于其生物学和药理学活性,如抗氧化、抗癌、抗炎、抗菌和抗糖尿病作用,Cur引起了极大的关注[2]。曾有报道指出,Cur可以作为治疗各种疾病的有效药物,包括过敏、艾滋病、尔茨海默氏症,癌症,心血管和呼吸系统疾病等。然而,过量的Cur对脱氧核糖核酸(DNA)的氧化活性具有促进作用[3],并且可导致细胞内ATP水平降低并引发坏死过程[4]。由此可以看出,Cur的抗氧化或抗氧化活性取决于其浓度。因此,控制进入人体的Cur浓度是至关重要的。目前用于测定Cur的常规分析方法包括伏安法[1,5],高性能薄层层析(HPTLC)[6],高效液相色谱(HPLC)[7-8],超高效液相色谱(UHPLC)[4],液相色谱-串联质谱(LC-MS/MS)联用[9]和分光光度法[10]。这些方法虽然具有良好的准确性和选择性,然而样品预处理复杂、操作程序烦琐、仪器昂贵、分析时间长等缺点,限制了其应用。而荧光分光光度法[7]由于其高精度,优良的选择性和灵敏度,操作简便,经济快速等特点,已逐渐成为一种高效的检测方法。如Liu等[11]通过酸碱中和反应碳化的方式制备氮磷共掺杂蓝色荧光碳点,并应用于溶液中Cur的灵敏检测,检出限为58 nmol/L;Gong等[12]在250 ℃,12 h水热条件下制备氮硫共掺杂黄色荧光碳点,并应用于细胞内pH和Cur的检测,检出限为81 nmol/L。目前开发灵敏度更高的Cur荧光探针仍然是必要的。
碳点(carbon dots,CDs)由于制备方法简便,强烈的光致发光性能、优良的稳定性、水溶性和高选择性等优点,被广泛应用于荧光探针和生物成像等领域[13-14]。研究者为了提高CDs的量子产率和实现其功能化,提出了多元素掺杂、表面功能化、官能团修饰等多种方法[15-16]。其中,非金属杂原子的掺杂因易于实现,能改进碳点的功能而备受青睐。如Jiao等[17]通过简洁有效的热处理方法,一锅法合成了N掺杂CDs,并成功应用于细胞中银离子和谷胱甘肽的检测;Liu等[18]以二氨基甲苯硫酸盐为原料,通过一步水热法合成了具有良好发光性能的氮硫共掺杂CDs,并成功用于细胞成像。目前人们已通过不同的原料成功地制备出各种功能化荧光碳点[19]。随着人们对环境的逐步重视,废弃生物质材料的利用越来越引起了大家的关注,已经有不少的研究者采用废弃生物质为原料制备荧光碳纳米材料。如:Zhou等[20]将西瓜皮在220 ℃碳化2 h,获得了2 nm左右的碳纳米粒子。Lu等[21]通过水热工艺使用低成本的柚子皮废料成功制备出了荧光碳纳米粒子。本文采用水热法,利用麦秸秆(碳源)和乙二胺(氮源)制得氮掺杂CDs,并基于内滤效应和静态猝灭的共同作用构建了检测Cur的荧光传感新方法,该方法的检测限为55.17 nmol/L。同时,所制备的CDs也被成功应用于人体肝癌细胞的体外成像。
1 材料与方法
1.1 主要试剂与仪器
主要试剂:麦秸秆粉末(太原市蓝海农贸市场);20 mmol/L不同pH磷酸盐缓冲溶液,配制所用试剂T水合磷酸氢二钠、磷酸二氢钾、氯化钠和氯化钾购自Sigma-Aldrich化学工业有限公司(Missouri,St.Louis County,USA);姜黄素和乙二胺均为分析纯,购自上海阿拉丁生化科技股份有限公司(中国·上海);其他所用试剂购自国药集团药业股份有限公司(中国·上海),均为分析纯,使用前没有进一步纯化,实验用水为超纯水(≥18.25 MΩ·cm)。
主要仪器:Lambda 365紫外-可见分光光度计(美国珀金埃尔默公司),Cary Eclips荧光分光光度计(美国瓦里安公司),FE20酸度计(瑞士梅特勒-托利多公司),Tensor-27红外光谱仪(德国布鲁克公司),JEM-2100透射电子显微镜(日本电子光学公司),AXIS ULTRADLD X-射线光电子能谱仪(日本岛津公司),Vario EL CUBE元素分析仪(德国元素公司),FV1000激光共聚焦显微镜(日本奥林巴斯公司),Millipore(密理博)Milli-Q超纯水机。
1.2 CDs的制备及表征
制备:在干燥、洁净的100 mL烧杯中将0.3 g麦秸秆(50目)、10 mL去离子水与2 mL乙二胺混合均匀后转移至50 mL的不锈钢高压釜的聚四氟乙烯内衬中,在200℃下反应20 h,待反应完成后将溶液进行过滤、离心操作(10 000 r/min,10 min)。得到的溶液用500 Da透析膜在去离子水中透析48 h,将膜内红棕色溶液冷冻干燥获得干燥的固体样品。
表征:以元素分析和光电子能谱(XPS)检测CDs的化学成分和含量,傅里叶变换红外光谱仪(FTIR)测定CDs表面的官能团结构,透射电子显微镜(TEM)表征CDs的表面形态及其尺寸大小。以紫外可见分光光度计和荧光分光光度计获得CDs的紫外可见吸收光谱及其荧光光谱。利用荧光分光光度计研究其激发波长依赖性。
荧光量子产率测量:以硫酸奎宁为标准,以五点法根据(1)式计算CDs的荧光量子产率。
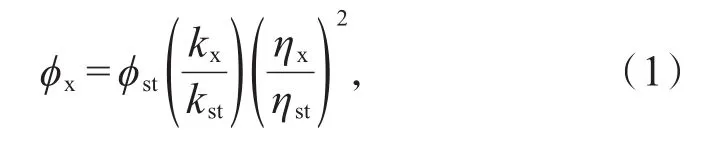
其中φ指荧光量子产率。k是荧光积分面积与对应浓度下吸光度的比值。η是折射率,对于水溶液,ηx=ηst。下标“st”和“x”分别指标准品和样品。
为了避免发生溶液自吸现象,调节10 mm荧光比色皿中的CDs和硫酸奎宁溶液的吸光度在0.01~0.1范围内(激发波长为378 nm),荧光积分面积所选区域为410 nm~600 nm。
1.3 CDs的选择性和稳定性研究
准确称取20.00 mg冷冻干燥过的CDs粉末,以超纯水定容到10 mL,得到2 mg/mL CDs储备液。配制 18 种金属离子(0.1 mol/L K+,Na+,Zn2+,Pb2+,Al3+,Ca2+,Cd2+,Cr3+,Hg2+,Cu2+,Ni2+,Sn2+,Co2+,Mn2+,Fe2+,Fe3+,Ag+,Mg2+)、20种氨基酸(0.01 mol/L甘氨酸(Gly)、丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、甲硫氨酸(蛋氨酸,Met)、苯丙氨酸(Phe)、脯氨酸(Pro)、色氨酸(Trp)、丝氨酸(Ser)、酪氨酸(Tyr)、半胱氨酸(Cys)、天冬酰胺(Asn)、谷氨酰胺(Gln)、苏氨酸(Thr)、天冬氨酸(Asp)、谷氨酸(Glu)、赖氨酸(Lys)、精氨酸(Arg)和组氨酸(His))和9种药物(0.01 mol/L叶酸(FA),桑色素(MH),抗坏血酸(AA),人血清白蛋白(HSA),谷胱甘肽(GSH),多巴胺盐酸盐(DA),四环素(Tet),阿霉素(DOX)和姜黄素(Cur))的储备液。将 30 μL 的 2 mg/mL的CDs水溶液加入2.5 mL超纯水中(CDs浓度为24 μg/mL),在378 nm激发波长下,测478 nm发射波长处的荧光强度F0。然后在此系列荧光强度为F0的碳点溶液中,分别加入20 μL上述各种金属离子、氨基酸和药物,记录478 nm处的荧光强度,以相对荧光强度F/F0探讨碳点的选择性。
在20 mmol/L不同pH值的PBS中测量pH值对CDs的荧光强度的影响。将30 μL的2 mg/mL的CDs水溶液加入2.5 mL不同pH值的PBS中,室温下混合均匀,固定激发波长为378 nm,记录其荧光发射光谱,并根据478 nm处的荧光强度,考察pH值对CDs荧光强度的影响。
将30 μL的2 mg/mL的CDs水溶液加入2.5 mL超纯水中,连续用氙灯照射CDs溶液180 min,记录其发射光谱478 nm处的荧光强度,研究CDs的光稳定性。
1.4 CDs用于Cur检测及细胞成像研究
为了考察所制备碳点检测Cur的范围,向2.5 mL浓度为24 μg/mL的CDs超纯水溶液中滴加不同体积的0.01 mol/L Cur的乙醇溶液(加入Cur的体积依 次 为 0、0.1、0.2、0.3、0.4、0.6、0.8、1.0、1.2、1.4、1.7、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0、14.0、16.0、18.0、20.0、22.0、24.0 和 27.0 μL),摇匀后在室温下孵育1 min,测定其荧光光谱,记录478 nm处荧光强度(λex=378 nm)。
实验采用MTT法检测CDs对细胞的毒性。取B16F10细胞(小鼠黑色素瘤细胞)悬液于96孔板中,每孔100 μL。放置于培养箱中,在37℃、体积分数5% CO2条件下培养24 h后,弃去上层液,给药孔中加入含不同浓度 CDs(0、50、100、200、400和600 μg/mL)的新鲜培养基。再孵育24 h后,用含MTT新鲜培养基(5 mg/mL)替换所有药孔中培养基,继续培养2 h。最后,吸掉上层液,加入DMSO轻摇几分钟后,用酶标仪在478 nm处测量吸光度,记录并处理实验结果。
为了观察CDs在细胞中的成像效果,将适量人肝癌细胞SMMC 7721悬液加入共聚焦培养皿中,放置于培养箱,在37℃、体积分数5% CO2条件下进行贴壁培养。然后,弃上层液,用PBS缓冲液润洗1次,加入含CDs(500 mg/mL)的新鲜培养基,再继续培养6 h。最后,取出培养皿,移除培养液,用PBS润洗细胞3次,以激光共聚焦显微镜进行细胞成像。
2 结果与分析
2.1 CDs的结构表征
首先以元素分析仪和XPS分析了解CDs的元素组成及元素状态。如表1A所示,所合成的CDs由C 50.02%,H 7.03%,N 19.15%和O 23.8%(计算)组成,表明氮已掺杂于碳点中。表1B是各元素对应的相对原子数,据此推算CDs的经验组成式可能是C42H70N14O15。CDs的XPS全谱(图1A)分析含有三个峰,位于529 eV、397 eV和283 eV处,分别与O 1s、N 1s和C1s对应。C1s(图1B)的高分辨谱可分为286.5、285.5和284.8 eV三个峰,分别对应C=O、C-N和C-O-C键。N 1s谱(图3C)可分为400.2 eV和399.2 eV两个峰,分别对应N-H键和C-N-C键。O 1s高分辨率谱(图1D)可为532.9和531.6 eV两个峰,分别对应C=O键和C-O键。由XPS数据可知,CDs表面含有C-N、C-O-C、C-N-C、N-H、C=O、C-O等基团。
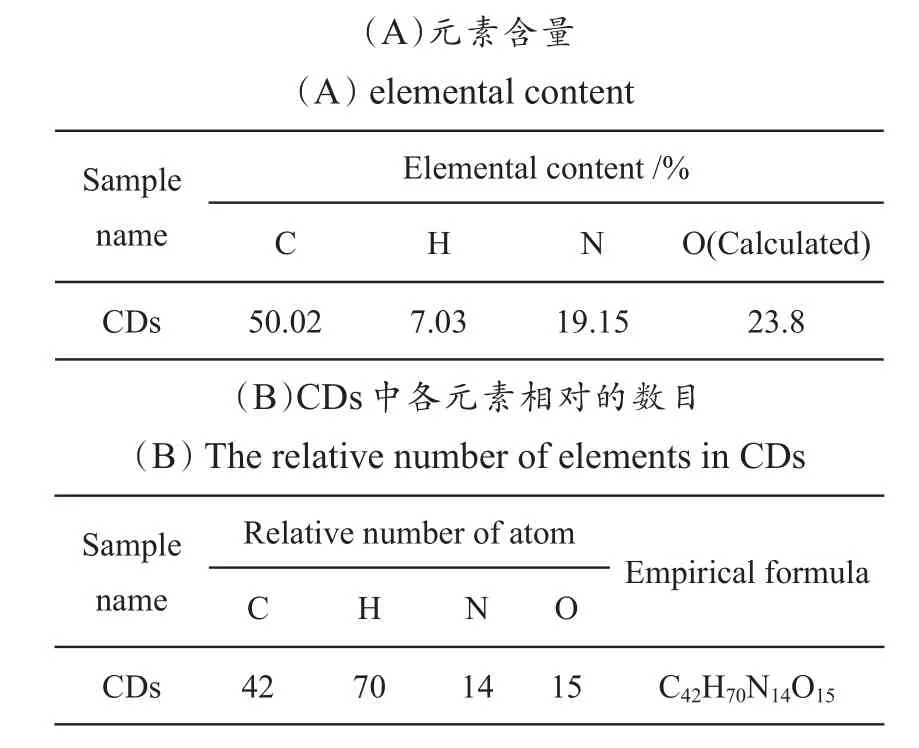
表1 CDs的元素分析Table 1 Elemental analysis of the CDs
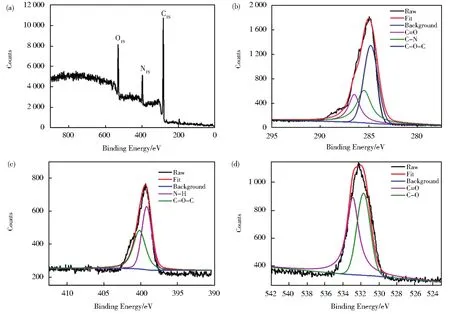
图1 (A)XPS全谱,C 1s(B),N 1s(C)和O 1s(D)高分辨谱Fig.1 XPS spectrum(A)and high resolution spectra of C1s(B),N 1s(C)and O1s(D)
进一步用FTIR表征CDs表面的官能团(图2),在3 660 cm-1~3 133 cm-1处有一个宽吸收峰,在2 935 cm-1和1 050 cm-1处有两个尖吸收峰,它们分别由O-H/N-H以及C-H和C-O-C伸缩振动引起。1 578 cm-1的吸收峰对应-C=O伸缩振动;1 472 cm-1对应C-N/CON-H的吸收峰。结合元素分析和XPS结果,表明N已成功掺杂进CDs中。进一步用TEM(图3A)表征所制备CDs表面形貌及尺寸,发现其为分散均匀的球状,具有0.21 nm的晶格条纹,与石墨碳的(100)面一致。约50个CDs颗粒的统计结果(图3中下插图)表明所制备CDs粒径正态分布在3 nm~8 nm范围内,平均粒径为4.97 nm。
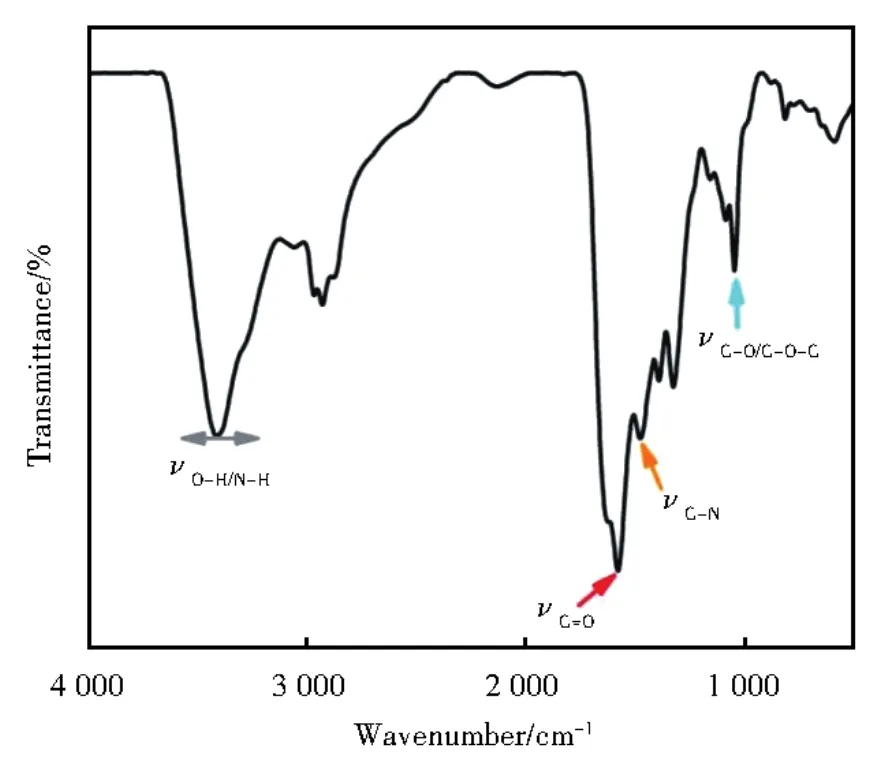
图2 CDs的红外光谱图Fig.2 FTIR spectrum of CDs
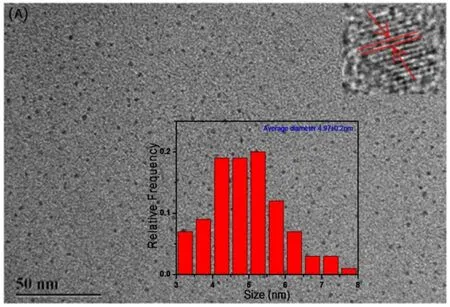
图3 CDs的TEM、粒径分布和晶格条纹图Fig.3 Images of TEM,particle size distribution and HRTEM.
2.2 CDs的光谱性能
CDs的紫外-可见光吸收和荧光光谱如图4。图4A中CDs在271 nm和347 nm处的吸收分别对应于π→π*跃迁和n→π*跃迁;360 nm处的吸收肩峰与最佳激发波长相近归因于CDs表面官能团的吸收。CDs的水溶液在可见光下呈现出淡黄色澄清溶液,在紫外灯(365 nm)下发射出蓝色荧光图4A插图。图4B表明,所制备CDs的荧光发射波长具有激发波长依赖性[22],发射强度随着激发波长的红移先增大后减小,其最佳激发和发射发波长分别为378 nm和478 nm。以硫酸奎宁为标准,五点法计算该CDs的量子产率为0.42。
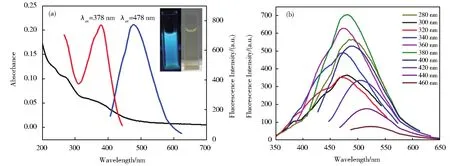
图4 (A)CDs的紫外吸收光谱(黑线)及最佳激发(红线)、发射(蓝线)光谱。插图是CDs的水溶液在紫外(左)和日光(右)照射下的图像。(B)CDs在不同激发(280 nm~460 nm)下的发射光谱图Fig.4 (A)UV-Vis absorption spectrum(black line)and optimal fluorescent excitation(red line)and emission(blue line)spectra of CDs.The inset is an image of an aqueous solution of CDs illuminated under ultraviolet(left)and daylight(right).(B)Fluorescent emission spectra of CDs at different excitation wavelengths(280-460 nm)
2.3 CDs荧光的稳定性
不同pH下该CDs的荧光强度图(图5A)表明其荧光强度在pH 4.00~9.00范围内基本稳定,显示出该CDs在较宽pH范围内具有潜在的应用前景。CDs溶液在氙灯持续照射180 min的荧光强度图(图5B)表明180 min后CDs荧光强度仍有最初强度的95.72%,该CDs具有较好的光稳定性。
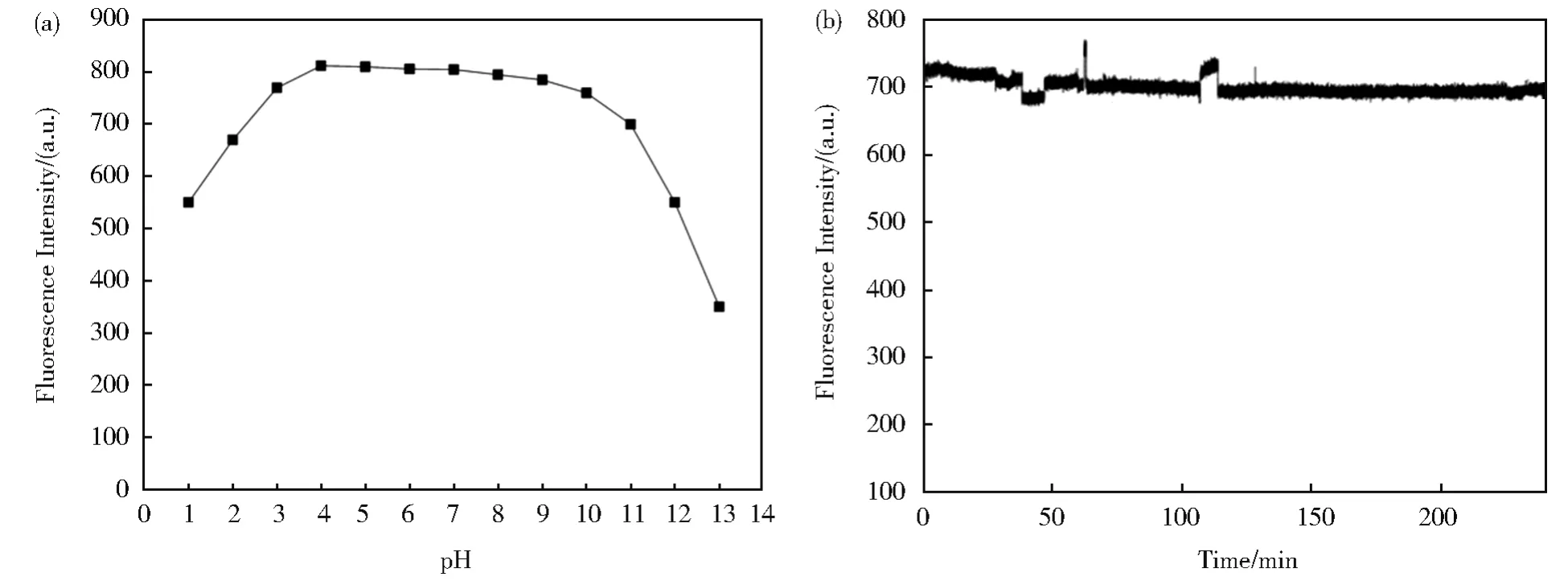
图5 (A)pH对CDs荧光强度的影响,(B)氙灯持续照射下CDs荧光发射强度Fig.5 Fluorescent intensity of CDs under different pH(A),illuminated continuously by xenon lamps(B)
2.4 免标记荧光法测定Cur及机理
研究了18种金属离子、20种氨基酸和9种药物对CDs荧光强度的影响,以确定CDs的选择性,结果如图6A、6B所示,Cur可导致CDs荧光明显猝灭,而金属离子、氨基酸和其他药物对CDs的荧光猝灭程度较小,可忽略不计,说明CDs对Cur有较好的选择性。本实验还考察了Cur与CDs(24 μg/L)在水溶液中的反应时间对荧光强度的影响。如图6C所示,加入 Cur(80 μmol/L)后,CDs的荧光强度在 10 s内迅速下降,之后荧光强度便趋于稳定状态,说明Cur与CDs的反应仅需10 s即可完成。同时,体系的酸度对检测的灵敏度会有影响,因此考察了不同pH的磷酸缓冲溶液中Cur对CDs荧光的猝灭程度,结果如图6D。由图可知,Cur对CDs荧光的猝灭程度在pH为3.00~10.00的范围内基本相同,且在超纯水中猝灭效果更好些。所以选择碳点和Cur共孵育1 min,在超纯水中检测为后续实验条件。
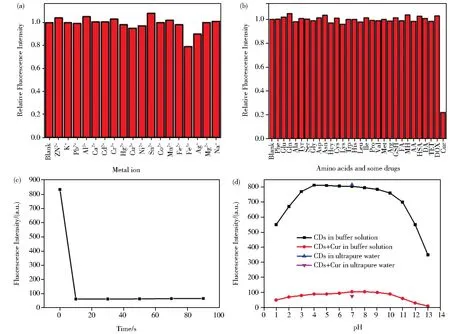
图6 CDs对金属离子(A)、氨基酸和药物(B)的选择性;(C)Cur(80 μmol/L)对 CDs(24 μg/mL)荧光强度的动力学影响;(D)在超纯水和不同pH的CDs溶液中加入Cur的荧光猝灭程度比较Fig.6 Selectivity of the CDs to(A)metal ion and amino acids and some drugs(B).(C)Kinetics effect of Cur(80 μmol/L)on the fluorescence intensities of CDs(24 μg/mL).(D)Comparison of fluorescence intensity of CDs in ultrapure water and different pH solutions in the presence or absence of Cur(80 μmol/L)
图7A描绘了加入不同浓度的Cur时,CDs的荧光强度变化图。由图可知,当Cur的浓度从0到108 μmol/L增加时,CDs的荧光强度由强变弱。图7B中,在3 μmol/L~ 10 μmol/L范围内ΔF(F0-F)与Cur浓度线性关系良好,(ΔF=20.511 9CCur+37.797 62),F0为没有Cur时的荧光强度,F是存在Cur时的荧光强度。该方法的检测限为55.17 nmol/L,表明基于该CDs的荧光传感方法可用于Cur的检测。随着Cur加入,在530 nm处出现新的发射峰,该峰为Cur自身530 nm处的微弱荧光,随着Cur浓度增加而出现并逐渐加强,由图7(B)可知,Cur在530 nm的峰并不影响CDs对Cur的线性检测。
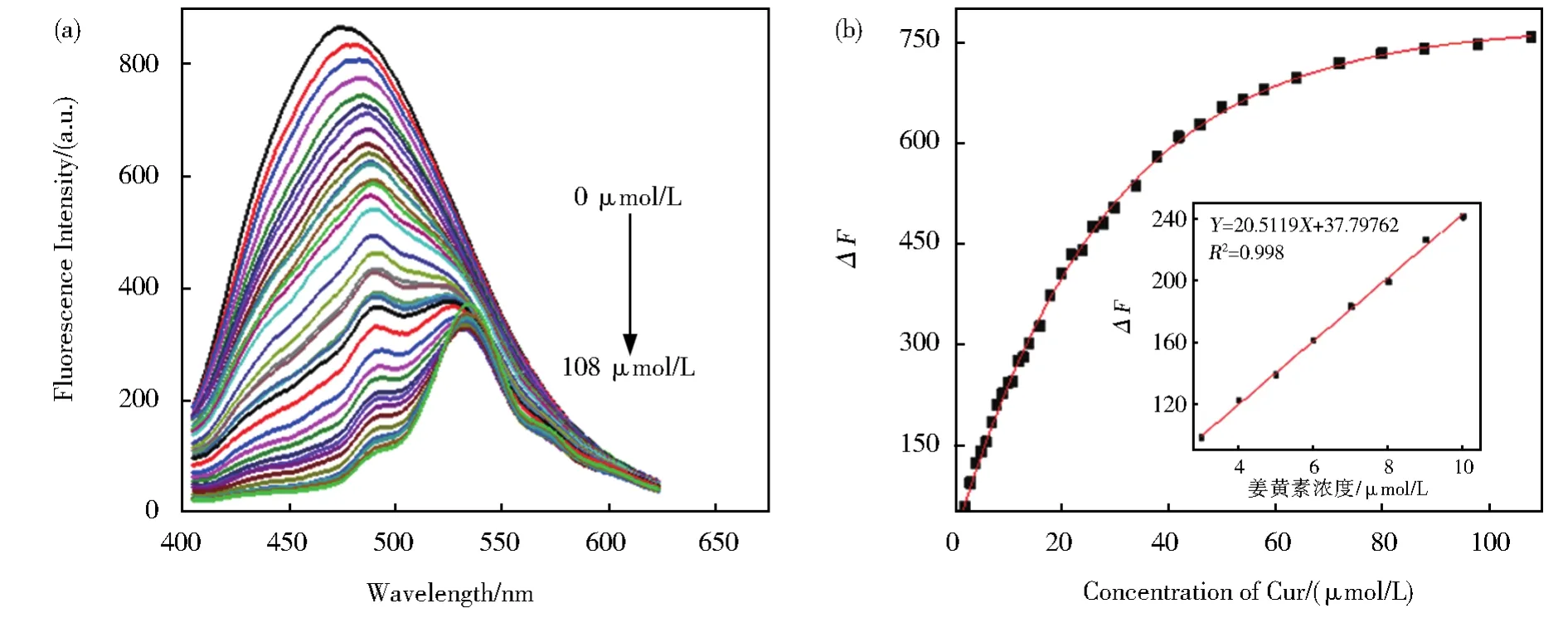
图7 (A)Cur(0 μmol/L~108 μmol/L)猝灭CDs荧光图。(B)Cur对CDs的荧光猝灭曲线以及线性拟合曲线(3.2 μmol/L~10 μmol/L)Fig.7 (A)Fluorescence quenching of CDs by Cur(0 μmol/L~108 μmol/L).(B)Fluorescence quenching curve of the CDs by Cur,and its linear fitting curve(3.2 μmol/L~10 μmol/L)
为进一步探究Cur对CDs的荧光猝灭机理,考察了CDs的激发和发射光谱与Cur的吸收光谱,如图8A所示,发现Cur的吸收光谱与CDs的激发和发射光谱均存在较大重叠。因此Cur可吸收CDs的激发和发射光,导致CDs的荧光猝灭,即Cur可对CDs的荧光产生内滤效应而导致CDs荧光猝灭,且随着Cur浓度的增加,内滤效应增强,荧光猝灭程度增加。图8B为荧光寿命曲线,CDs的寿命组分为τ1=2.9 ns(45.55%),τ2=10.2 ns(54.45%),平均荧光寿命是 6.8 ns(χ2=1.170)。加入 Cur后,两种寿命组分分别为 τ1=2.7 ns(40.45%),τ2=9.2 ns(59.55%),平均荧光寿命是 6.6 ns(χ2=1.206)。Cur加入后荧光寿命基本不变。图8C为CDs,Cur和CDs-Cur的紫外-可见吸收光谱,图中Cur在419 nm有吸收;CDs在347 nm~393 nm有吸收的弱包;当Cur加入CDs溶液中,吸收光谱在463 nm处出现了一个明显的新峰;该峰不是通过CDs和Cur的吸收峰的简单叠加得到的,而是一个新的吸收峰。可知Cur与CDs的基态分子之间发生相互作用生成了新的化合物。通过这些结果可推测,CDs的荧光猝灭是由于Cur对CDs的激发和发射光谱的内滤效应以及二者之间的静态相互作用共同造成的。
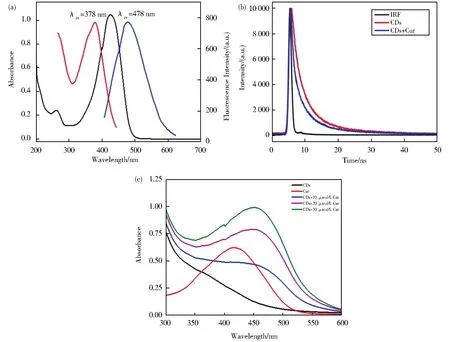
图8 (A)CDs的激发(红)、发射(蓝)光谱与Cur的吸收光谱(黑),(B)CDs的荧光衰减曲线,λex=378nm,(C)24 μg/mL CDs(黑)、20 μmol/L Cur(红)和在24 μg/mL CDs超纯水溶液中含有10(蓝),20(紫),30(绿)μmol/L Cur后的吸收光谱Fig.8 (A)Excitation(red)and emission(blue)spectrum of CDs and the absorption spectrum of Cur(black).(B)Fluorescence decay curve of CDs,λex=378nm.(C)Absorbance spectra of 24 μg/mL CDs(black),20 μmol/L Cur(red),and 24 μg/mL CDs in the presence of 10(blue),20(purple),30(green)μmol/L Cur in ultrapure water
2.5 MTT分析和多色细胞成像
通过MTT法评价所制备CDs的细胞毒性,为进一步的生物学应用奠定基础。如图9所示,在37℃下,小鼠黑色素瘤细胞B16F10与600 μg/mL CDs共孵育48 h后,其存活率仍保持在70%以上,表明该CDs具有较低的细胞毒性。
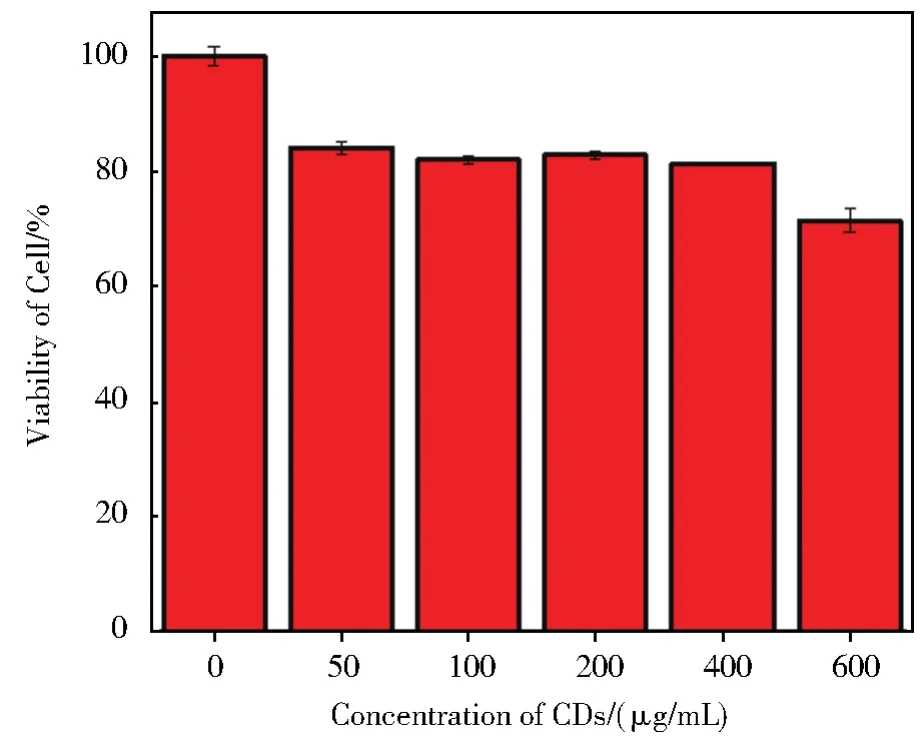
图9 不同CDs浓度下,小鼠黑色素瘤细胞的存活率Fig.9 Survival rate of B16F10 cells at different concentrations of CDs
图10为CDs与人体肝癌细胞(SMMC 7721)的激光共聚焦图像。从图中可以看出,CDs在细胞质区域分散良好,仅有一小部分CDs进入细胞核中。此外,用CDs培养的SMMC 7721细胞具有正常的形态,表明CDs细胞毒性较低,生物相容性较好。当用405 nm、488 nm、515 nm的激光器激发这些细胞时,能够发射出蓝色(图10B)、绿色(图10C)、黄色(图10D)荧光,其中以蓝色荧光较亮,而黄色荧光较弱,合并图像(图10E)中能看到明亮的蓝色荧光,而绿色和黄色荧光显示很弱。通过以上结果可知,该CDs可作为良好的蓝色荧光细胞成像试剂。
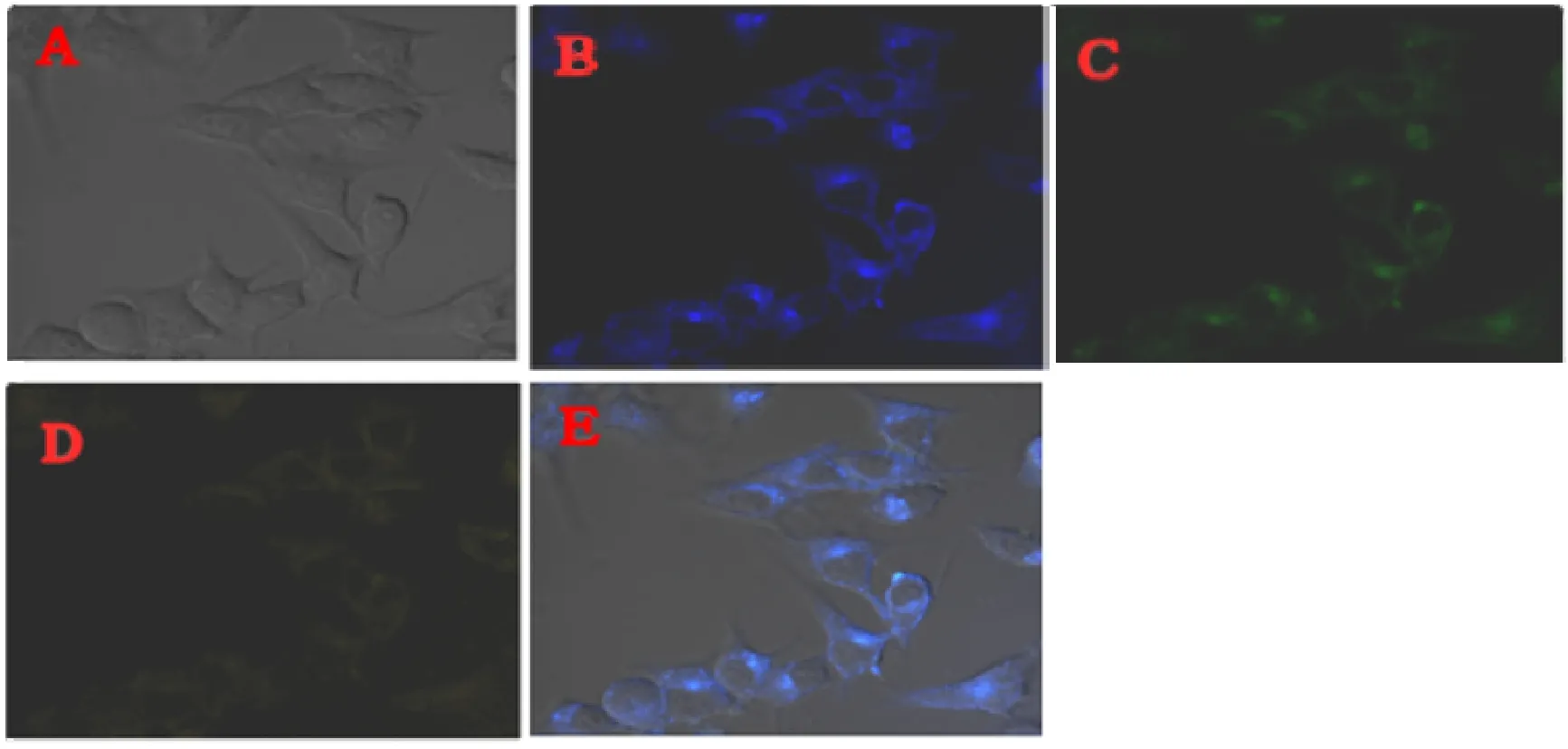
图10 SMMC 7721细胞与250 μg/mL CDs在37℃下孵育2 h的LSCM图像。A.明场图像,B,C和D分别是在λex/λem分别为(405/422±25),(488/500±25)和(515/570±25)nm处拍摄的细胞图像。E是A,B,C,D的合并图像Fig.10 LSCM images of SMMC 7721 cells incubated with 250 μg/mL CDs at 37 ℃ for 2 h.Ais the bright field image of SMMC 7721 cells.B,C and D are the cell images at λex/λemof(405/422 ± 25),(488/500 ± 25)and(515/570 ± 25)nm,respectively.E is the merged images ofA,B,C and D
3 结论
通过以麦秸秆(碳源)、乙二胺(氮源)为原料,制备了蓝色荧光氮掺杂CDs。该CDs具有良好的分散性和荧光稳定性。基于Cur和CDs之间的内滤效应和静态猝灭,构筑了检测Cur的荧光传感新方法,检测Cur的检测限可达55.17 nmol/L。此外,该CDs还可用作细胞成像荧光试剂。因此,该CDs有望作为荧光探针在生物医学和生物成像等领域得到进一步应用。
