RPL35A 基因在不同月龄寒泊羊肌肉组织中的表达及其生物信息学分析
2021-04-21贺名扬刘爱菊周荣艳田树军陈晓勇
贺名扬 ,刘爱菊,张 鑫,周荣艳,田树军,白 莹*,陈晓勇*
(1.河北农业大学动物科技学院,河北保定 071000;2.河北工程大学生命科学与食品工程学院,河北邯郸 056000)
寒泊羊是以杜泊绵羊为父本、小尾寒羊为母本经过十余年培育的肉繁兼用新种群,于2014 年通过河北省畜牧兽医局组织的中试论证,该种群繁殖性能明显[1],但肉用性能选育仍停留在增重等表型层面。因此,筛选、挖掘、鉴定影响肌肉组织发育的关键候选基因有助于解析肌肉组织发育规律,为肉质性状遗传机理研究和选育提供理论依据。RNA-seq 技术可从转录水平筛选差异表达的基因,已广泛应用于畜禽动物的经济性状遗传机理研究[2-4]。
核糖体蛋白基因(RPL35A)位于人3 号染色体的q29-qter 区段,编码大亚基中的核糖体蛋白L35AE 家族中的RPL35A 蛋白。在小鼠中,该蛋白位于核糖体中的P 位和A 位或完全位于P 位,与启动因子及延伸因子相结合参与核糖体的翻译活动[5-6]。杜玉杰等[7]对大熊猫RPL35A基因及其编码的蛋白序列研究发现,RPL35A其理化性质和功能位点在哺乳动物中高度保守,对于核糖体编码蛋白质极其重要。此外,有研究表明RPL35A基因变异与再生障碍性贫血有关[8-11]。Pappas 等[12]研究发现60S 核糖体亚单位的L35a 和40S 核糖体亚单位的S5 表达受分化鼠类红白血病细胞的共同机制调节,导致核糖体功能下降。目前,RPL35A基因在畜禽领域的研究报道很少。本团队前期研究利用转录组测序方法筛选到RPL35A基因为不同月龄寒泊羊mRNA 差异表达基因(未发表),为此,本研究利用定量PCR 验证转录组测序得到的RPL35A基因表达,并利用生物信息学分析RPL35A基因的核苷酸及蛋白质结构及其特性,为探究寒泊羊RPL35A基因与绵羊肌肉生长发育相关性提供参考。
1 材料与方法
1.1 实验样品 随机选取无亲缘关系的1 月龄、7 月龄、13 月龄寒泊公羊各3 只。采集背最长肌3~5 g,用无菌生理盐水冲洗,放入2 mL 冷冻管,迅速置于液氮中暂时保存,带回实验室后在-80℃冰箱中保存。
1.2 主要试剂与仪器 动物组织总RNA 提取试剂盒、胶回收试剂盒、琼脂糖、DNA Marker 和荧光定量试剂盒均购自全式金(北京)有限公司,反转录试剂盒购自大连宝生物有限公司。实时PCR 仪为ABI 7300(Applied Biosystems,Foster City,CA,U.S.A.)。
1.3 引物合成 从GenBank 中下载绵羊RPL35A基因的mRNA 序列(XM_004002995.3),使用Primer 5 设计特异引物。引物:RPL35AF:5'-TACAAAGCAAAG AACAACA-3',RPL35AR:5'-GGTACAGCATCACAC GAAT-3',产物片段为169 bp,将甘油醛-3-磷酸脱氢酶(GAPDH) 基因作 为内参。GAPDHF:5'-CACCCTCAAGATTGTCAGC-3',GAPDHR:5'-CA GTGGTCATAAGTCCCTCC-3',产物片段为107 bp。
1.4 组织RNA 提取及cDNA 合成 取100 mg 样品在液氮中迅速研磨成粉末,依据Trizol 法提取各组织总RNA,测定浓度和纯度,取10 μLRNA 样品,70℃处理2 min,2% 琼脂糖凝胶电泳检测,利用NanoDrop 2000 分光光度计检测RNA 浓度和纯度。按照大连宝生物的PrimeScript Ⅱ1st Strand cDNA Synthesis Kit 将合格的RNA 反转录为cDNA,质控合格后保存备用。
1.5 荧光定量PCR 检测mRNA 表达丰度 以背最长肌cDNA 为模板,利用RPL35A F1/R1 特异引物扩增RPL35A基因的编码区序列,反应体系(20 μL):荧光染 料Mix 8 μL,ROX 3 μL,模 板1 μL (50 ng/μL),上下游引物(10 pmol/μL)各0.5 μL,Taq 酶0.2 μL,无酶水7 μL。三步法反应程序:98℃ 3 min;98℃ 20 s,57 ℃ 30 s,72 ℃ 1 min,34 个循环;72 ℃ 10 min。扩增产物经2%琼脂糖凝胶电泳检测。PCR 扩增反应程序:95 ℃ 5 min,95° C 10 s,60° C 30 s 和72° C 30 s,40个循环。模板的扩增阶段,60~95℃,每15 s 缓慢升温0.3℃,建立熔解曲线阶段。按照荧光定量试剂盒说明书操作,将GADPH基因为内参,每个样品设置3 个重复。
1.6 统计分析 RNA-seq 结果由FPKM 法计算,本实验所采用的荧光定量法为相对荧光定量,按照2-△△Ct相对定量计算公式计算,二者之间计算方式不同。因此在进行比对时需将数据均一化处理,对分析得到的数据再使用SPSS 22.0 进行单因素方差分析,以P<0.05 表示差异显著。
1.7 生物信息学分析
1.7.1 序列获取及进化树构建 通过NCBI 网站中Blastp 应用程序下载13 个物种的RPL35A 氨基酸序列及其核苷酸序列,使用DNAStar Lasergene 应用程序MegAlign 软件对绵羊及获取的12 个物种RPL35A基因的核苷酸序列及氨基酸序列进行多序列比对,分析绵羊RPL35A 与其他物种的相似性。使用MEGA 7.0 软件基于近邻结合(Neighbor-Joining,NJ)法(number of Bootstrap replication :1000)对绵羊及其他13 个物种RPL35A 氨基酸序列构建进化树。
1.7.2 理化性质分析及亚细胞定位预测 利用ExPASy数据分析系统中的ProtParam 工具(http://web.expasy.org/protparam/),分析RPL35A 的分子式、分子质量、酸碱性、等电点和稳定性等理化性质。使用ProtScale工具(https://web.expasy.org/protscale/)分析RPL35A的亲疏水性。利用SignalP 4.1 Severve 软件(http://www.cbs.dtu.dk/services/SignalP-4.1/) 分 析RPL35A有无信号肽,使用TMHMM Server v.2.0 软件(http://www.cbs.dtu.dk/services/TMHMM/) 分 析RPL35A 有无跨膜区域。利用在线工具NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析RPL35A 的丝氨酸、苏氨酸或酪氨酸磷酸化位点。使用PSORT II 软件(www.genscript.com/psort.)预 测RPL35A 的亚细胞定位。
1.7.3 蛋白高级结构预测 使用 Conserved Domains 在线软件(https://www.ncbi.nlm.nih.gov/cdd)预测绵羊RPL35A 蛋白的结构域。使用SOPMA 在线预测软件(https://npsa-prabi.ibcp.fr/npsa_sopma.html)预测山羊RPL35A 蛋白的二级结构。利用SWISS-MODEL 在线软件(https://swissmodel.expasy.org/)预测蛋白的三级结构。
1.7.4 预测蛋白互作网络 利用STRING 数据库(https://string-db.org/),将可信度值设置为0.7,控制互作蛋白的数量在10 以内,构建RPL35A 的蛋白互作网络。
2 结果与分析
2.1 不同月龄背最长肌mRNA 表达丰度比较 由图1 可知,1 月龄寒泊羊背最长肌RPL35A基因mRNA 高于7月龄,后者低于13 月龄,表达趋势与转录组测序结果一致,说明转录组测序结果可靠,该基因可能与寒泊羊肌肉生长发育相关。

图1 RPL35A 基因在不同月龄绵羊肌肉中的表达
2.2 不同物种RPL35A 序列系统发育分析以及相似性比较 由表1 可知,绵羊RPL35A基因核苷酸及氨基酸序列与山羊、牛、猪、家马、猫的相似性较高。对绵羊及其他13 个物种RPL35A 氨基酸序列构建进化树,结果发现绵羊与山羊、牛、猪同源性最高,聚为一支。与灵长目的人、黑猩猩、大猩猩同源性居中,与啮齿目的鼠及鱼类的斑马鱼同源性较低(图2)。

表1 绵羊RPL35A 基因与其他物种氨基酸和核苷酸序列相似性分析
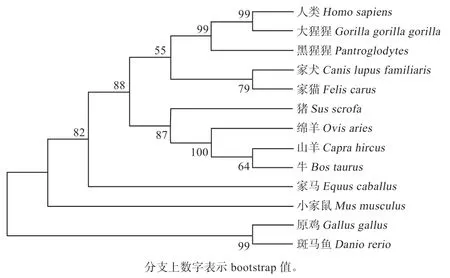
图2 RPL35A 氨基酸序列系统发育分析NJ 树
2.3 RPL35A 蛋白特性分析 ExPASy 在线软件发现该蛋白分子质量为125.51 ku,分子式为C561H907N175O145S4,理论等电点PI=11.07,为碱性蛋白质。RPL35A 为亲水蛋白(图3-A),亲水性总平均值(GRAVY)为-0.579。哺乳动物的网织红细胞半衰期为30 h,且不稳定性系数是35.85,证明其属于稳定蛋白。RPL35A 蛋白亲水性最强的位点位于19 位的精氨酸,值为-2.722,29 位的赖氨酸为疏水性最强位点,值为1.067,疏水区域少于亲水区域,进一步印证了亲水性分析结果。信号肽预测分析可知,绵羊RPL35A 蛋白序列中不包含信号肽(图3-B)。RPL35A 蛋白为亲水性蛋白。通过TMHMM Server v.2.0 在线分析发现。该蛋白未见到跨膜信号,因此不属于跨膜蛋白(图4)。

图3 RPL35A 蛋白特性分析
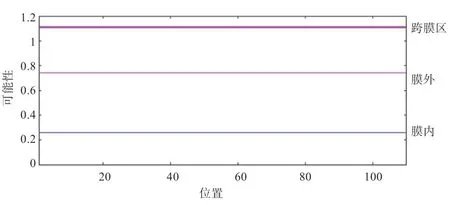
图4 RPL35A 蛋白跨膜结构预测
磷酸化位点分析发现RPL35A 蛋白包含了多个可能存在的位点,其中丝氨酸(Ser)略低于酪氨酸(Tyr)和苏氨酸(Thr)含量(图5)。预测得分(Score)介于0.000~1.000,分值超过0.500 表示有被磷酸化的可能。

图5 RPL35A 蛋白磷酸化位点预测
2.4 预测RPL35A 蛋白亚细胞的定位 亚细胞定位可明确蛋白质或表达产物在细胞内的具体存在部位,经PSORT II 软件进行亚细胞定位分析可知,RPL35A 蛋白在线粒体(69.6%)、细胞核(17.4%)、细胞质(8.7%)、过氧化物酶体(4.3%)内发挥作用。
2.5 RPL35A 蛋白一级结构预测 预测绵羊RPL35A 蛋白结构域,结果表明绵羊RPL35A 蛋白属于RPL35Ae超家族成员,有1 个保守结构域。
2.6 RPL35A 蛋白高级结构预测 使用SOPMA 在线分析软件,对绵羊RPL35A 蛋白进行二级结构预测,结果发现该蛋白中有1.26%的α-螺旋、26.36%的延伸链、5.44%的β-转角、66.95%的无规则卷曲,构成上述结构的氨基酸残基数目分别为3、63、13、160 个,说明RPL35A 蛋白结构元件主要为无规则卷曲,β-转角和延伸链也占一定比例,α-螺旋较少。在SWISS-MODEL网页中提交绵羊RPL35A 氨基酸序列后预测蛋白质的三级结构,如图6 所示,绵羊RPL35A 蛋白序列与Blast数据库中的模板序列相似性高达82.22%,同时预测结果显示GMQE 为0.57,QMEAN 为-1.90,覆盖率为82.22%,表明该结构模型合理。

图6 RPL35A 蛋白三级结构预测
2.7 RPL35A 蛋白互作网络分析 由图7 可知,RPL35A与核糖体蛋白合成具有紧密的蛋白互作联系,网络中的RPL11、RPL18A、RPL29 及RPS3、RPS11、RPS17、RPS19 和RPS20 蛋白彼此之间具有紧密的关联性,表明RPL35A 与多个核糖体蛋白互作在核糖体合成中发挥重要作用。
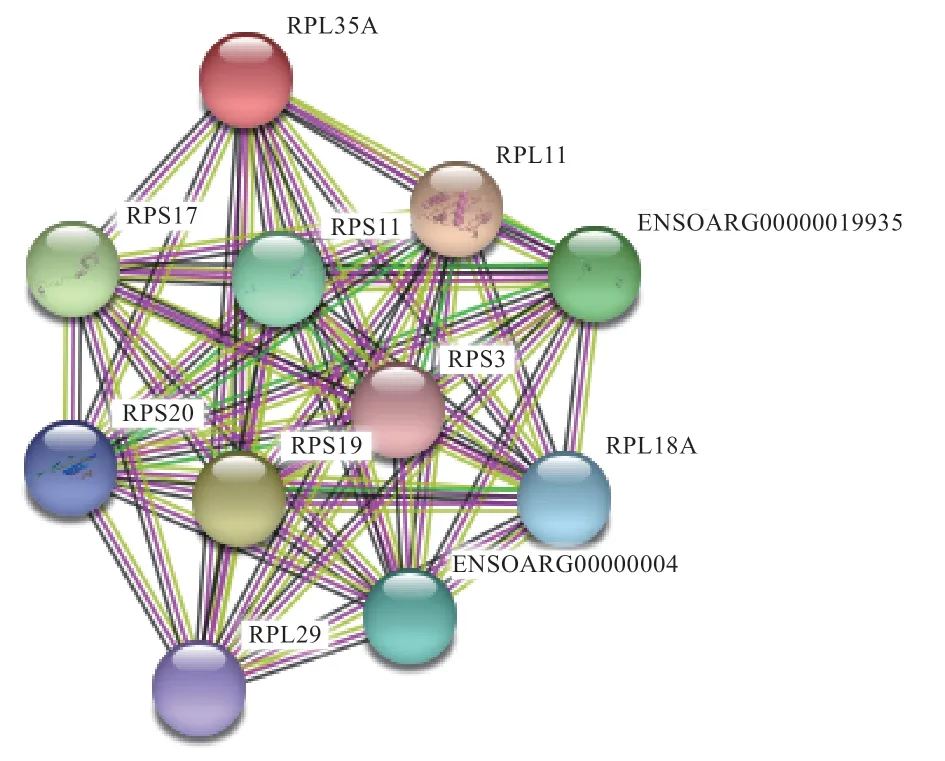
图7 绵羊RPL35A 蛋白互作网络预测
3 讨 论
RPL35基因是60S 核糖体亚基的重要组成成分,在蛋白质和内质网中发挥重要作用[13]。寒泊羊出生后,RPL35A基因的表达丰度随着月龄增加以及自身生长发育的改变而改变。1 月龄为羔羊肌纤维发育的初级阶段,6~7 月龄为商品肉羊育肥出栏阶段,12~13 月龄是骨骼肌发育基本成熟的阶段,因此本实验选取这3 个发育阶段。本研究结果显示,RPL35A基因在1 月龄寒泊羊背最长肌的表达量达到最高,7 月龄达到最低,表达量曲线呈“U”型,荧光定量结果与RNA-seq 结果表达趋势一致,说明转录组测序结果可靠,RPL35A基因与寒泊羊肌肉生长发育相关。
通过生物信息学分析发现,绵羊RPL35A基因所编码的蛋白分子式为C561H907N175O145S4,分子质量为125.51 ku,该基因的蛋白质和核酸序列与猪[14]、牛[15]相似性高。跨膜信号分析和信号肽分析结果表明该蛋白不属于跨膜蛋白且不包含信号肽;多肽序列分析发现有多个磷酸化位点,且主要分布在N-端的核苷酸结合结构域,此外,发现该序列主要在线粒体和细胞核中发挥作用。该蛋白分子质量和理论等电点与大熊猫RPL35A蛋白分子量为12.5355、pI 为11.63 接近[7],可见该蛋白非常保守。RPL35A 蛋白属于RPL35Ae 超家族成员,有1 个保守结构域,其二级结构主要是不规则卷曲,还存在一定比例的延伸链和β-转角以及少量的α-螺旋,其三级结构与模板序列相似性高达99.09%。
本研究利用转录组测序技术和生物信息学分析方法筛选到了RPL35A基因为寒泊羊生长发育mRNA 差异表达基因,为绵羊的肌肉组织发育提供参考和研究价值。目前,有关RPL35A基因的生理功能认识还非常有限,除了与人贫血症有关外[16],研究表明真核生物翻译延长因子2(eEF2)是RPL35A基因下调的信号分子,牛乳腺上皮细胞RPL35A基因与eEF2 作用调节β-酪蛋白合成,RPL35A基因是蛋氨酸调控β-酪蛋白翻译延长和分泌的重要正调控因子[13]。此外,长链非编码RNA lncNB1 通过与核糖体蛋白RPL35 相互作用促进肿瘤发生[17]。RPL35 基因是如何在核糖体中调控目标蛋白质的合成,进而影响与肌肉生长发育相关蛋白质的表达以及蛋白质互作网络调控作用机制有待深入研究。
4 结 论
本研究通过对不同月龄背最长肌组织中RPL35A基因mRNA 差异表达分析发现,该基因对寒泊肉羊肌肉生长发育相关。绵羊RPL35A基因序列分析发现其与山羊、牛、猪的RPL35A基因核苷酸及氨基酸序列同源性较高,属于亲水性稳定蛋白,含有多个磷酸化位点,有1 个保守结构域,二级结构以无规则卷曲为主。与RPL11、RPL29、RPL18A 及RPS3、RPS11、RPS17、RPS19 和RPS20 蛋白互作,从而进一步调控不同发育阶段寒泊肉羊肌肉生长发育。
