一测多评结合指纹图谱的肝复乐胶囊质量控制研究
2021-04-21曾杨丽徐菲蔡思张梦通潘宇李娟肖利辉李顺祥
曾杨丽,徐菲,蔡思,张梦通,潘宇,李娟,肖利辉,李顺祥
中药研究与开发
一测多评结合指纹图谱的肝复乐胶囊质量控制研究
曾杨丽1,徐菲1,蔡思1,张梦通1,潘宇1,李娟1,肖利辉2,李顺祥1
1.湖南中医药大学,湖南省中药活性物质筛选工程技术研究中心,湖南 长沙 410208; 2.康普药业股份有限公司,湖南 长沙 410008
建立一测多评(QAMS)法同时测定肝复乐胶囊中白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、橙皮苷、黄芩苷、芦荟大黄素7种药效特征成分含量的方法。采用YMC-Pack ODS-A色谱柱,以乙腈-0.1%甲酸水溶液为流动相,分段转换波长为285 nm(0~30 min、35~50 min)、260 nm(30~35 min、50~80 min),柱温25 ℃,流速0.8 mL/min,建立肝复乐胶囊HPLC指纹图谱,并以橙皮苷为内标,建立白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、橙皮苷、黄芩苷、芦荟大黄素的相对校正因子,计算7种成分的含量,并与外标法测定结果进行比较,以验证QAMS方法的准确性、重复性及可行性。10批指纹图谱共确定29个共有峰,指认白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、橙皮苷、黄芩苷、芦荟大黄素7种主要特征成分。10批样品图谱的相似度均大于0.95,峰形、分离度均较为良好,精密度及重复性RSD均小于1.5%,在24 h内供试品溶液稳定,测定成分线性关系良好,线性范围适当。QAMS法计算值与外标法实测值差异无统计学意义。本研究建立的QAMS方法可作为简便快捷的质量评价模式用于肝复乐胶囊中7种成分的质量控制。
肝复乐胶囊;质量控制;一测多评;指纹图谱
肝复乐胶囊为中药三类新药,2004年被列入《国家基本医疗保险药品目录》抗肿瘤药。其处方为全国名老中医潘敏求教授结合多年临床经验,在经典名方四君子汤、茵陈蒿汤、龙胆泻肝汤、四逆散基础上加减而成,由半枝莲、白术、黄芪、陈皮、大黄等21味药组成,用于肝瘀脾虚为主证的原发性肝癌,症见上腹肿块、胁肋疼痛、神疲乏力、食少纳呆、脘腹胀满、心烦易怒、口苦咽干等,疗效肯定[1-2]。潘教授将该处方药物按功效分为健脾理气组(党参、麸炒白术、黄芪、茯苓、薏苡仁、制香附、陈皮、柴胡、沉香、川木通)、化瘀软坚组(醋鳖甲、土鳖虫、桃仁、苏木、牡蛎、郁金、大黄)、清热解毒组(重楼、败酱草、茵陈、半枝莲)[3]。目前肝复乐胶囊执行国家食品药品监督管理局标准(YBZ12132006),仅对橙皮苷进行定量,无法全面控制该制剂的内在质量[4]。因此,从多种药效特征成分同时监控角度出发,建立该复方指纹图谱及主要特征成分的定量检测方法尤为重要[5-6]。本研究同时测定肝复乐胶囊中7种主要药效成分——健脾理气组的白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、橙皮苷和芸香柚皮苷,化瘀软坚组的芦荟大黄素,清热解毒组的野黄芩苷、黄芩苷含量,并建立10批肝复乐胶囊HPLC指纹图谱及7种成分的一测多评含量测定方法,以全面控制肝复乐胶囊质量。
1 仪器与试药
1260型高效液相色谱仪(DAD检测器),安捷伦科技(中国)有限公司;MS205DU电子分析天平,梅特勒-托利多国际贸易(上海)有限公司;KQ-500E数控超声波清洗器,昆山市超声仪器有限公司;YMC- Pack ODS-A反相色谱柱(250 mm×4.6 mm,5 μm),北京谱飞科技有限公司;离子色谱用SPE-C18型前处理柱,天津希波氏科技有限公司;12位SPE色谱萃取仪,上海那艾精密仪器有限公司。
肝复乐胶囊(规格0.5 g/粒),批号分别为20171114(S1)、20180301(S2)、20171003(S3)、20180505(S4)、20180302(S5)、20171206(S6)、20180219(S7)、20171205(S8)、20181113(S9)、20180806(S10),康普药业股份有限公司。对照品白术内酯Ⅰ(批号CHB170224,含量98%)、黄芩苷(批号CHB170720,含量98%)、芸香柚皮苷(批号CHB170227,含量98%)、橙皮苷(批号CHB180416,含量98%)、芦荟大黄素(批号12054023,含量98%),成都克洛玛生物科技有限公司;对照品野黄芩苷(批号110842-201709,含量91.7%)、毛蕊异黄酮葡萄糖苷(批号111920-2016,含量97.6%),中国食品药品检定研究院;甲醇为色谱纯,水为超纯水,甲酸为分析纯。
2 方法与结果
2.1 色谱条件
采用YMC-Pack ODS-A色谱柱(250 mm×4.6 mm,5 μm),以乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱(0~5 min,90%B;5~45 min,90%~75%B;45~65 min,75%~60%B;65~75 min,60%~20%B;75~80 min,20%B),流速0.8 mL/min,检测波长285 nm(0~30 min、35~50 min)、260 nm(30~35 min、50~80 min),柱温25 ℃,进样量10 μL。
2.2 溶液制备
2.2.1 混合对照品溶液
分别取各对照品适量,精密称定,加50%甲醇,制成浓度分别为白术内酯Ⅰ 60 μg/mL、毛蕊异黄酮葡萄糖苷20.4 μg/mL、野黄芩苷108 μg/mL、芸香柚皮苷800 μg/mL、橙皮苷400 μg/mL、黄芩苷110 μg/mL、芦荟大黄素20 μg/mL的混合对照品溶液,摇匀,过滤,取续滤液,即得。
2.2.2 供试品溶液
取样品粉末1.0 g,精密称定,置于具塞锥形瓶中,精密量取50%甲醇溶液25mL,称定质量,超声(功率250 W,频率40 kHz)提取1 h,冷却至室温,50%甲醇补足减失的质量[7-8],摇匀,15 000 r/min离心10 min,精密量取上清液1.0 mL,用超纯水稀释至5 mL,过SPE-C18型前处理柱固相萃取柱(使用前分别用甲醇、超纯水活化处理),依次用10%甲醇5 mL和甲醇5 mL洗脱,收集甲醇洗脱液,60 ℃水浴蒸干后,用50%甲醇溶解并定容至1.0 mL,以0.45 μm微孔滤膜过滤,即得。
2.3 指纹图谱建立
2.3.1 精密度试验
取同一批肝复乐胶囊供试品溶液(批号20180505),按“2.1”项下色谱条件,连续进样6次,记录色谱图,以橙皮苷峰为参照峰,计算各共有峰相对保留时间RSD均小于1.2%,相对峰面积RSD均小于2.0%,表明仪器精密度良好。
2.3.2 稳定性试验
取同一批肝复乐胶囊供试品溶液(批号20180505),按“2.1”项下色谱条件,于0、2、4、8、16、24 h分别进样1次,记录色谱图,以橙皮苷峰为参照峰,计算各共有峰相对保留时间RSD均小于0.6%,相对峰面积RSD均小于2.1%,表明供试品溶液在24 h内稳定。
2.3.3 重复性试验
取同一批肝复乐胶囊供试品溶液(批号20180505),按“2.2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样,以橙皮苷峰为参照峰,计算各共有峰相对保留时间RSD均小于0.55%,相对峰面积RSD均小于1.5%,表明方法重复性良好。
2.3.4 指纹图谱相似度评价
取10批样品,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,记录色谱图。将10批样品图谱导入国家药典委员会《中药色谱指纹图谱相似度评价系统》(2012版),采用中位数生成对照图谱,设置时间窗宽度为0.20 min,进行多点校正Mark峰及全谱匹配[8],生成共有峰。结果10批样品指纹图谱共确认29个共有峰,10批指纹图谱的相似度分别为0.952、0.979、0.965、0.966、1.000、0.965、0.979、0.952、0.970、0.951,均大于0.95。见图1。
2.3.5 部分共有峰指认及相对峰面积计算
通过与混合对照品色谱图进行归属比对,指认指纹图谱中7个化合物,白术内酯Ⅰ(10号峰)、毛蕊异黄酮葡萄糖苷(11号峰)、野黄芩苷(12号峰)、芸香柚皮苷(14号峰)、橙皮苷(16号峰)、黄芩苷(19号峰)、芦荟大黄素(26号峰)平均保留时间分别为(31.27±0.02)min、(33.19±0.03)min、(37.25±0.04)min、(40.31±0.01)min、(44.08±0.03)min、(51.64±0.04)min、(73.25±0.01)min。其中橙皮苷峰位居中,分离度良好,峰面积较大,因此选为参照峰,计算各共有峰相对峰面积,结果见表1。
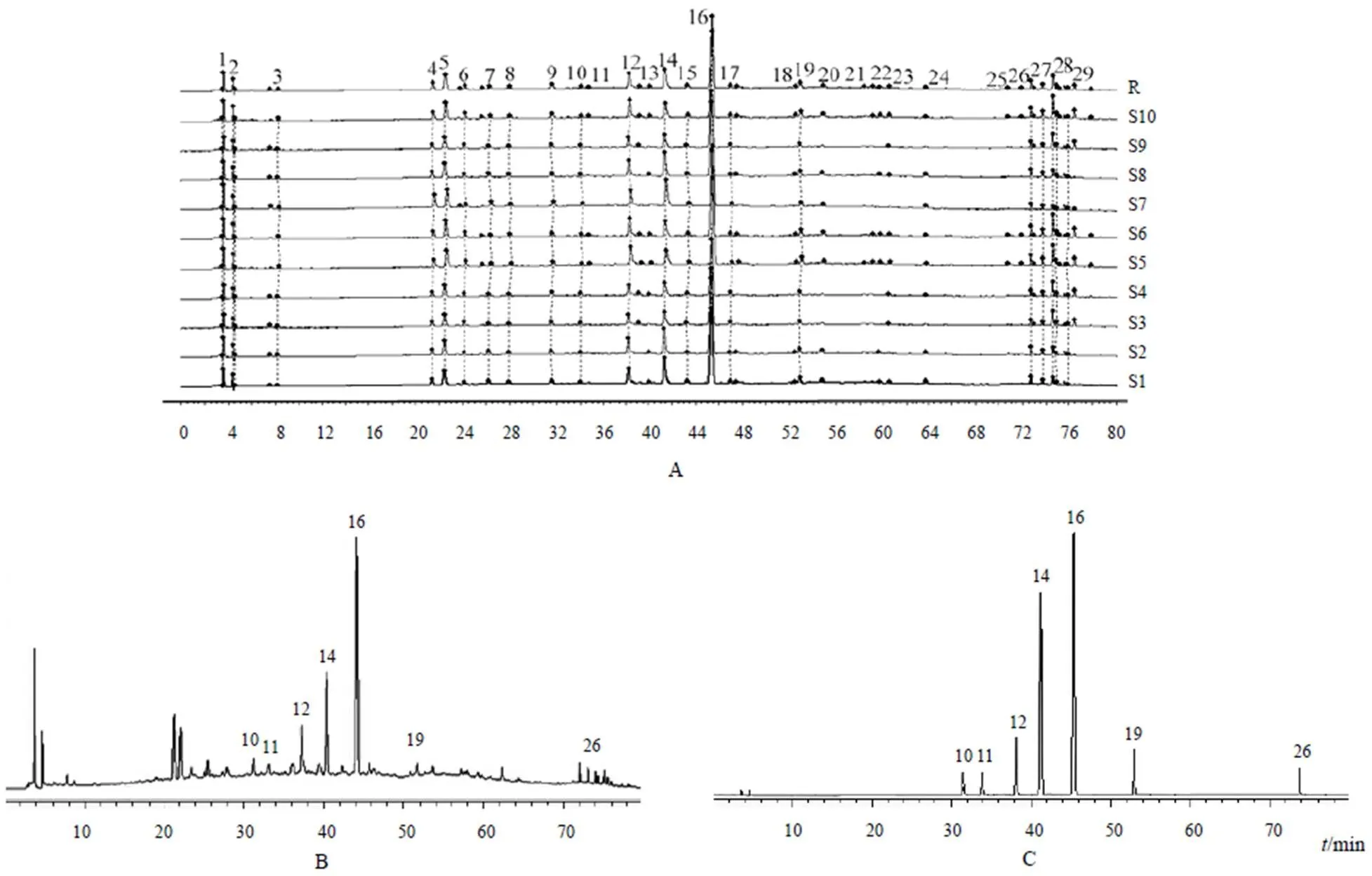
注:A.供试品叠加图;B.对照图谱;C.混合对照品;10.白术内酯Ⅰ;11.毛蕊异黄酮葡萄糖苷;12.野黄芩苷;14.芸香柚皮苷;16.橙皮苷;19.黄芩苷;26.芦荟大黄素
表1 10批肝复乐胶囊样品指纹图谱共有峰相对峰面积
峰号S1S2S3S4S5S6S7S8S9S10 10.1470.1900.1550.1830.2450.1550.1900.1470.2020.030 20.0380.0340.0320.0730.0750.0320.0340.0380.0690.038 30.0170.0150.0170.0160.0180.0170.0150.0170.0160.011 40.0700.0820.0780.2740.1020.0780.0820.0700.2760.015 50.1610.1690.1760.1970.1500.1760.1690.1610.1990.085 60.0380.0330.0520.0390.0190.0520.0330.0380.0380.037 70.0240.0190.0220.0180.0220.0220.0190.0240.0170.020 80.0160.0370.0280.0520.0220.0280.0370.0160.0510.024 90.0190.0190.0160.0180.0220.0160.0190.0190.0170.017 100.0490.0510.0700.0820.0370.0700.0510.0490.0860.029 110.0170.0170.0160.0140.0180.0160.0170.0170.0090.017 120.2140.2090.1370.2100.2110.1370.2090.2140.2120.155 130.0380.0430.0450.0740.0340.0450.0430.0380.0740.033 140.1870.3320.2510.4220.2540.2510.3320.1870.4250.182 150.0300.0200.0310.0460.0120.0310.0200.0300.0540.023 161.0001.0001.0001.0001.0001.0001.0001.0001.0001.000 170.0250.0350.0250.0420.0300.0250.0350.0250.0390.033 180.0220.0170.0190.0170.0210.0190.0170.0220.0190.022 190.0570.0610.0550.0590.0760.0550.0610.0570.0600.057 200.0340.0470.0230.0350.0480.0230.0470.0340.0320.045 210.0130.0150.0120.0220.0130.0120.0150.0130.0170.013 220.0190.0130.0210.0240.0110.0210.0130.0190.0180.024 230.0220.0260.0350.0210.0310.0350.0260.0220.0220.031 240.0110.0250.0160.0320.0180.0160.0250.0110.0320.013 250.0410.0480.0370.0360.0440.0370.0480.0410.0390.042 260.0450.0350.0260.0320.0390.0260.0350.0450.0320.040 270.1660.0750.1410.0370.1140.1410.0750.1660.0370.167 280.0280.0170.0290.0170.0190.0290.0170.0280.0170.028 290.0130.0270.0200.0320.0140.0200.0270.0130.0340.011
2.4 方法学考察
2.4.1 线性关系考察
精密移取“2.2.1”项下混合对照品溶液0.50、1.25、2.50、5.00、7.50、10.00 mL,分别用50%甲醇定容至10 mL,制备6份不同浓度的混合对照品溶液,按“2.1”项下色谱条件,依次进样,记录色谱图峰面积。以相应成分的峰面积为纵坐标,对照品浓度(μg/mL)为横坐标,绘制标准曲线,得到白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、橙皮苷、黄芩苷和芦荟大黄素7种成分的回归方程及线性范围,结果见表2。
表2 7种成分线性关系考察结果
成分回归方程r2线性范围/μg 白术内酯ⅠY=7.202 4X+0.318 41.000 075~1500 毛蕊异黄酮葡萄糖苷Y=18.154X+0.971 11.000 025.5~510 野黄芩苷Y=9.463 2X-0.269 31.000 0135~2700 芸香柚皮苷Y=4.073 9X+2.588 21.000 01000~2000 橙皮苷Y=11.49X+35.4930.999 0500~10 000 黄芩苷Y=6.546 5X-0.900 10.999 9137.5~2750 芦荟大黄素Y=14.657X+0.226 80.999 325~500
2.4.2 精密度试验
取“2.2.1”项下混合对照品溶液,按“2.1”项下色谱条件,连续进样6次,结果白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、橙皮苷、黄芩苷和芦荟大黄素的峰面积RSD分别为1.63%、0.07%、2.64%、0.37%、0.44%、1.41%、0.38%,表明仪器精密度良好。
2.4.3 稳定性试验
取肝复乐胶囊供试品溶液(批号20180505),按“2.1”项下色谱条件,于0、2、4、8、16、24 h分别进样1次,计算峰面积,结果白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、橙皮苷、黄芩苷和芦荟大黄素的峰面积RSD分别为2.04%、0.25%、2.09%、0.46%、0.60%、1.76%、1.57%,表明供试品溶液在24 h内稳定。
2.4.4 重复性试验
取肝复乐胶囊样品(批号20180505),按“2.2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样,计算峰面积,结果白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、橙皮苷、黄芩苷和芦荟大黄素的峰面积RSD分别为0.68%、0.31%、0.13%、0.31%、0.04%、1.49%、0.41%,表明本方法重复性良好。
2.4.5 加样回收率试验
精密称取6份肝复乐胶囊样品(批号20180505),每份1.0 g,分别置于具塞锥形瓶中,分别精密加入0.254 mg/mL白术内酯Ⅰ对照品溶液1 mL、0.042 mg/mL毛蕊异黄酮葡萄糖苷对照品溶液1 mL、0.578 mg/mL野黄芩苷对照品溶液1 mL、2.066 mg/mL芸香柚皮苷对照品溶液1 mL、1.615 mg/mL橙皮苷对照品溶液1 mL、0.158 mg/mL黄芩苷对照品溶液1 mL和0.042 mg/mL芦荟大黄素对照品溶液1 mL,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录峰面积,分别计算7种成分的平均回收率及RSD,结果表明本方法加样回收率良好,见表3。
表3 肝复乐胶囊中7种成分加样回收率试验
成分取样量 /g样品中 含量/mg加入 量/mg测得 量/mg回收率 /%平均回 收率/%RSD /% 白术内酯Ⅰ1.0010.2540.2540.49896.296.70.7 1.0450.2650.2540.51498.0 1.0250.2600.2540.50596.5 0.9980.2530.2540.49796.2 1.0250.2600.2540.50697.0 1.0060.2550.2540.50096.5 毛蕊异黄酮葡萄糖苷1.0390.0430.0420.08190.390.01.3 1.0870.0450.0420.08390.5 1.0140.0420.0420.07988.8 1.0390.0430.0420.08088.5 1.1110.0460.0420.08491.2 1.1350.0470.0420.08591.0 野黄芩苷1.1310.6110.5781.17697.898.90.8 1.1350.6130.5781.18599.0 1.1380.6150.5781.210100.3 1.1290.6100.5781.18399.1 1.1290.6100.5781.17798.1 1.1330.6120.5781.21398.9 芸香柚皮苷0.9992.0652.0664.11099.098.90.9 0.9992.0652.0664.10098.5 1.0002.0672.0664.09698.2 1.0032.0732.0664.193100.0 1.0022.0702.0664.13499.9 1.0012.0682.0664.09197.9 橙皮苷1.0301.6631.6153.26299.0100.52.4 1.0321.6651.6153.282100.1 1.0291.6601.6153.330103.1 1.0301.6631.6153.332103.4 1.0331.6671.6153.291100.6 1.0341.6691.6153.23797.1 黄芩苷1.0130.1590.1580.45193.193.60.8 1.0010.1570.1580.44992.7 1.0030.1580.1580.45994.0 1.0010.1570.1580.45193.5 0.9940.1560.1580.45593.5 1.0030.1580.1580.46294.8 芦荟大黄素1.0020.0470.0420.08691.292.10.8 1.0430.0490.0420.08892.4 1.0020.0470.0420.08793.0 1.0210.0480.0420.08792.1 1.0020.0470.0420.08791.3 1.0430.0490.0420.08992.8
2.5 一测多评法建立
2.5.1 相对校正因子计算
精密吸取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件进样测定6次,记录峰面积。以橙皮苷为内标物,分别计算白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、黄芩苷、芦荟大黄素的相对校正因子,fk/s=fk/fs=(WkAs)/(WsAk),式中Wk为内标物浓度,Ak为内标物峰面积,Ws为待测组分浓度,As为待测组分峰面积,结果见表4。
表4 以橙皮苷为内标的相对校正因子
序号f1f2f3f4f5f6 11.542 60.605 81.223 72.756 71.765 10.803 4 21.586 80.628 91.208 82.807 61.742 70.780 0 31.576 60.631 41.214 32.753 71.734 50.808 8 41.551 30.623 41.231 12.764 51.767 40.786 7 51.573 40.615 61.244 12.818 81.721 20.813 1 61.566 40.630 41.223 12.754 31.752 40.776 8 平均值1.566 20.622 61.224 22.775 91.747 20.794 8 RSD/%1.051.621.021.061.031.96
注:f1~f6依次为白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、黄芩苷、芦荟大黄素的相对校正因子
2.5.2 待测成分色谱峰定位
采用相对保留时间即各待测成分与橙皮苷保留时间的比值,对色谱峰进行定位,结果白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、黄芩苷、芦荟大黄素的相对保留时间分别为0.70、0.75、0.84、0.91、1.17、1.63,RSD分别为2.8%、2.5%、3.8%、3.5%、2.7%、2.0%。
2.5.3 相对校正因子重复性考察
取“2.2.1”项下混合对照品溶液分别进样测定,考察安捷伦1260型高效液相色谱仪、Waters ACQUITY Arc型高效液相色谱仪及YMC-Pack ODS-A C18色谱柱、Supersil ODS2 C18色谱柱、SinoChrom ODS-BP C18色谱柱对相对校正因子的影响,结果见表5。不同仪器及不同色谱柱对白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、黄芩苷和芦荟大黄素的相对校正因子无显著影响。
2.6 一测多评法与标准曲线法结果对比
取10批样品,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录峰面积,采用外标法进行含量测定,再用一测多评法进行计算,结果见表6。2种方法测得的各成分含量无明显差异,表明建立的一测多评方法准确性较好。
表5 不同仪器和色谱柱对相对校正因子的影响
仪器色谱柱f1f2f3f4f5f6 安捷伦1260型YMC-Pack ODS-A C181.566 20.622 61.224 22.775 91.747 20.794 8 Supersil ODS2 C181.554 50.632 31.218 92.763 31.756 70.801 1 SinoChrom ODS-BP C181.575 70.621 91.247 82.805 71.788 80.785 5 Waters ACQUITY Arc型YMC-Pack ODS-A C181.563 70.632 41.234 52.732 31.785 40.802 3 Supersil ODS2 C181.567 80.621 61.226 72.746 81.744 30.793 4 SinoChrom ODS-BP C181.578 80.646 81.253 42.781 21.772 10.776 1 平均值 1.567 80.629 61.234 32.767 51.765 70.792 2 RSD/% 0.561.561.110.941.091.25
注:f1~f6依次为白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、野黄芩苷、芸香柚皮苷、黄芩苷、芦荟大黄素的相对校正因子
表6 7种成分含量外标法和一测多评法测定10批肝复乐胶囊样品结果比较(mg/g,n=3)
成分测定法S1S2S3S4S5S6S7S8S9S10 橙皮苷外标法2.360 72.086 51.556 41.614 63.260 43.309 01.557 32.090 12.361 62.289 7 白术内酯Ⅰ外标法0.145 40.137 90.153 50.253 60.514 80.535 40.156 90.147 90.152 20.280 4 一测多评法0.139 40.131 70.144 70.238 90.495 20.515 20.147 90.141 20.145 90.267 6 RSD/%2.973.244.154.222.732.724.153.272.993.30 毛蕊异黄酮 葡萄糖苷外标法0.029 60.027 80.036 20.041 40.080 60.081 60.035 30.026 10.030 80.056 1 一测多评法0.029 80.028 00.035 50.040 60.079 60.080 60.034 70.026 30.031 00.055 3 RSD/%0.480.381.231.430.860.851.160.600.361.05 野黄芩苷外标法0.651 70.544 50.295 70.539 80.839 20.831 70.298 00.545 90.617 90.737 0 一测多评法0.640 80.533 10.285 70.516 80.832 70.825 50.288 00.534 50.607 50.724 1 RSD/%1.191.502.433.080.550.532.431.501.191.25 芸香柚皮苷外标法1.287 62.022 61.170 92.065 91.931 94.158 41.175 42.044 51.417 71.694 4 一测多评法1.238 51.928 91.109 41.949 51.867 04.002 61.113 71.949 71.362 11.622 4 RSD/%2.753.353.814.102.412.703.813.362.833.07 黄芩苷外标法0.252 80.206 50.129 10.157 50.297 10.291 40.139 30.001 20.256 20.205 5 一测多评法0.243 00.197 00.120 40.147 90.288 60.283 10.130 20.211 40.246 30.196 6 RSD/%2.823.334.914.442.052.054.763.302.813.11 芦荟大黄素外标法0.287 10.106 10.169 20.047 20.066 30.083 00.169 40.103 50.295 70.049 6 一测多评法0.281 30.103 80.163 30.045 90.065 80.082 30.163 50.101 30.289 80.048 9 RSD/%1.441.572.521.980.500.562.521.561.441.05
3 讨论
本研究采用DAD检测器在200~400 nm范围内进行全波长扫描,显示260、285 nm波长吸收峰较多,分段切换波长能较全面反映肝复乐胶囊的化学成分,且各色谱峰分离较好,基线平稳,因此选择多波长切换作为采集波长,最大程度实现色谱峰分离、消除干扰、匹配更多共有峰,同时检测肝复乐胶囊中7种主要特征成分,提高检测的灵敏度和效率[8-11]。流动相摸索时,比较了甲醇-水溶液、乙腈-水溶液、甲醇-甲酸水溶液和乙腈-甲酸水溶液系统的效果,结果显示甲醇-水溶液分离度差,乙腈-水溶液、甲醇-甲酸水溶液系统各成分响应较小,基线噪音高,而乙腈-甲酸水溶液作为流动相洗脱效果最佳。选择样品提取溶剂时,对比了甲醇、50%甲醇、25%甲醇溶液的提取效果,结果采用50%甲醇提取时,样品色谱峰的峰形、数量、峰面积均较好,因此选择50%甲醇作为提取溶剂。
肝复乐胶囊的质量控制现行标准仅对陈皮中的橙皮苷进行定量分析,无法全面控制该制剂的质量。林新文等[12]对肝复乐胶囊进行指纹图谱研究,对样品指纹图谱中的22个共有峰进行了药材归属,但并未对其处方中代表量效关系的特征成分进行定性和定量分析。为此,本研究根据肝复乐胶囊组方的健脾理气、化瘀软坚和清热解毒功效解析确定主要特征成分,结合中药指纹图谱整体、特征性的优势,检测10批肝复乐胶囊色谱图,建立了含有29个共有峰的指纹图谱,并指认了3个功效组中除橙皮苷外的6个有效成分。本研究建立的肝复乐胶囊指纹图谱能够更全面表征处方中的药效信息,更为全面地控制该药品的质量,可用于指导工业生产,从而更好地保证产品质量。
一测多评法是采用成药或药材中的某一有效成分作为内标物,建立内标物与其他待测成分间的相对校正因子,并利用其测定其他成分含量的方法[13]。该方法不仅可在缺少对照品的情况下实现定量分析[14],而且能最大程度降低多指标成分含量测定的检验成本。本研究建立了一测多评法对肝复乐胶囊处方健脾理气组中白术、黄芪、陈皮特征成分白术内酯Ⅰ、毛蕊异黄酮葡萄糖苷、橙皮苷和芸香柚皮苷,化瘀软坚组中大黄特征成分芦荟大黄素,清热解毒组中半枝莲特征成分野黄芩苷、黄芩苷同时测定的方法,即以橙皮苷为内标物,建立其他6种成分的相对校正因子,计算各成分含量。10批样品测定结果显示,一测多评法与外标法无显著差异,可作为一种简便快捷的质量评价模式,用于肝复乐胶囊中7种成分的质量控制。
对于中药复方制剂,仅测定一种或几种有效成分的含量,通常难以真正反映制剂质量与疗效的关系。因此,根据刘昌孝等[15]提出的“质量标志物”概念,今后可立足于药效,以药效与物质基础的联系为出发点,继续深入研究肝复乐胶囊的质量标志物,以期更加有效控制制剂的质量。
[1] 樊素梅.肝复乐胶囊联合肝动脉栓塞化疗治疗晚期肝癌的临床研究[J].临床医药文献电子杂志,2014,1(1):53.
[2] 刘冬梅.肝复乐胶囊联合肝动脉栓塞化疗治疗晚期肝癌的疗效观察[J].临床医药文献电子杂志,2016,3(2):235-236.
[3] 潘博.潘敏求主任医师治疗肝癌经验[J].湖南中医杂志,2011,27(3):46-48.
[4] 刘艳.高效液相色谱法测定肝复乐胶囊中橙皮苷的含量[J].国际医药卫生导报,2008,14(12):96-98.
[5] 张铁军,许浚,韩彦琪,等.中药大品种质量标准提升研究的思路与实践[J].天津中医药,2017,34(1):4-12.
[6] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:23,66,76,158.
[7] 杨瑾,殷智,袁德培.基于指纹图谱分析和多成分同时定量的护肝片质量评价研究[J].药物分析杂志,2018,38(11):2029-2037.
[8] 卫亚洁,张泽坤,关彦玲,等.护肝片高效液相色谱指纹图谱及多成分定量分析研究[J].中南药学,2018,16(1):31-34.
[9] 华之卉,刘栋,李明春.高效液相色谱法同时测定软肝缩脾丸中7个成分的含量[J].药物分析杂志,2018,38(4):703-709.
[10] 彭文明,黄光磊,易徐航.HPLC法同时测定护肝片中7种活性成分的含量[J].江西中医药,2019,50(4):66-69.
[11] 辛国,赵昕彤,李文,等.不同时间煎煮柴胡对五柴胡饮中柴胡皂苷含量及药效学的影响[J].长春中医药大学学报,2018,34(4):641-644.
[12] 林新文,陈娜,陈征.肝复乐胶囊指纹图谱研究[J].中国处方药, 2019,17(7):42-44.
[13] 王智民,高慧敏,付雪涛,等.“一测多评”法中药质量评价模式方法学研究[J].中国中药杂志,2006,31(23):1989.
[14] 吴文平,何民友,吴淑珍,等.梅花配方颗粒超高效液相色谱指纹图谱及一测多评法研究[J].中国中医药信息杂志,2020,27(8):86-91.
[15] 刘昌孝,陈士林,肖小河,等.中药质量标志物(Q-Marker):中药产品质量控制的新概念[J].中草药,2016,47(9):1443-1457.
Study on Quality Control ofCapsules by QAMS and Fingerprint
ZENG Yangli1, XU Fei1, CAI Si1, ZHANG Mengtong1, PAN Yu1, LI Juan1, XIAO Lihui2, LI Shunxiang1
To establish a quantitative analysis of multi-components by single-marker (QAMS) method for the simultaneous determination of 7 medicinal properties of atractylenolide Ⅰ, verbascum isoflavone glycoside, wild baicalin, rutin naringin, hesperidin, baicalin, and aloe-emodin.YMC-Pack ODS-A column was used with acetonitrile-0.1% formic acid as mobile phase, and the conversion wavelength was 285 nm (0–30 min, 35–50 min) and 260 nm (30–35 min, 50–80 min), respectively; column temperature was 25 ℃; flow rate was 0.8 mL/min. HPLC fingerprint ofCapsules was established, and hesperidin was set as the internal reference substance to establish the relative correction factors of atractylenolide Ⅰ, verbascum isoflavone glycoside, wild baicalin, rutin naringin, hesperidin, baicalin, and aloe-emodin. The contents of the above seven components were calculated and were compared with the results of the external standard method to verify the accuracy, repeatability and feasibility of the QAMS method.A total of 29 common peaks were identified in 10 batches of fingerprints. 7 main characteristic components of atractylenolide Ⅰ, verbascum isoflavone glycoside, wild baicalin, rutin naringin, hesperidin, baicalin, and aloe-emodin were identified. The similarity of the 10 batch samples was more than 0.95. Under these conditions, the peak shape and resolution of the spectrum were relatively good; precision and repeatability RSD values were less than 1.5%; the sample solution was stable within 24 h; the measured component had a good linear relationship. There was no statistical significance between the calculated value of QAMS method and the measured value of the external standard method.The QAMS method established in this study can be used as a simple and quick quality evaluation model, which can be used for the quality control of seven components inCapsules.
Capsules; quality control; QAMS; fingerprint
R284.1
A
1005-5304(2021)04-0094-07
10.19879/j.cnki.1005-5304.202007127

湖南省科技计划(2016SK2033);长沙市科技计划(kp1907140、kp1801043);湖南中医药大学中药学一流学科项目(2018ZYX02)
李顺祥,E-mail:lishunxiang@hotmail.com
(收稿日期:2020-07-07)
(修回日期:2020-07-28;编辑:陈静)
