ZIF-8负载柠檬酸包覆纳米零价铁复合物的制备及其对U(VI)的吸附性能研究
2021-04-20石仕泷
何 江 高 飞 张 峰 冯 峰 石仕泷 刘 军
1(中国检验检疫科学研究院 食品安全研究所 北京 100176)
2(成都理工大学 核技术与自动化工程学院 成都 610059)
3(四川省原子能研究院 成都 610101)
核能作为一种清洁能源已得到广泛应用,发展核能被认为是解决能源危机的有效途径。核能发展的重要保障离不开高效、经济地开发铀资源,但此过程可使得铀被释入到环境中,并在土壤孔隙水或地下水中迁移,最后通过食物链进入人体,影响健康[1]。近年来,水体中铀污染已成为全球性的环境问题。据此,从含铀水体中分离去除铀,对核能可持续发展具有重要意义。
目前,从含铀水体中分离或去除铀的方法主要有生物法、化学沉淀法、溶剂萃取法、离子交换法和吸附法等。其中,吸附法是一种发展潜力大、用途广泛的分离富集技术[2]。吸附法的核心是筛选具有高吸附量或高选择性的固相吸附剂,主要利用固相吸附剂表面配位官能团将水体中吸附质转移到吸附剂上。固相吸附剂可大致分为无机吸附剂、有机吸附剂或无机/有机复合吸附剂等。其中,无机吸附剂具有较高比表面积和孔结构;有机吸附剂,如有机高分子,含有较丰富的络合官能团;无机/有机复合吸附剂则可利用各组分协同作用进一步提升或优化复合物吸附目标离子性能。
金属有机框架材料(Metal Organic Frameworks,MOFs)由金属中心离子和多功能的有机配体组成,是一类具有独特的孔洞和网格的有机-无机杂化材料。由于MOFs材料具有多孔性、大比表面积、结构与功能多样性以及不饱和金属位点,已被广泛应用于氢储、催化、药物载体及吸附与分离等领域[3],主要包括网状金属有机框架材料(Isoreticular Metalorganic Framework,IRMOF)、类沸石咪唑框架材料(Zeolitic Imidazolate Framework,ZIF)、柱层式框架材料(Coordination Pillared-layer,CPL)、拉瓦锡框架材料(Materials of Institute Lavoisier,MIL)、通道式框架材料(Porous Coordination Network,PCN)、奥斯陆框架材料(University of Oslo,UiO)等系列。其中,ZIF-8 作为ZIF 典型代表,是以Zn2+为中心离子、2-甲基咪唑为有机配体连接形成的具有方钠石型拓扑结构的MOFs 材料。由于ZIF-8 及其复合材料具有高疏水性以及良好的化学稳定性和热稳定性,有望成为放射性核素的潜在吸附剂。例如,王芙香等[4]合成了一种直径为 1~7 μm 的 ZnO@ZIF-8 核壳微球,发现此微球在水溶液中通过配位作用和氢键吸附铀酰离子。Wang 等[5]利用蒙特卡罗模拟和低本底α/β测量考察了纳米ZIF-8对氡的吸附动力学,发现纳米ZIF-8 对氡是一种良好的吸附剂。纳米材料由于具备微观界面和微孔特性,可加强许多界面反应。其中,纳米零价铁(Nanoscale Zero-valent Iron,nZVI)因其大比表面积和吸附量、高电负性和还原活性,被视作良好的重金属阳离子吸附材料。
为了进一步提升ZIF-8 对U(VI)的吸附性能并优化其磁性分离能力,合成了一种ZIF-8 负载柠檬酸包覆纳米零价铁(nZVI@CA/ZIF-8)材料。通过静态实验研究,考察了溶液初始pH、吸附时间、离子强度、U(VI)初始浓度以及温度对nZVI@CA/ZIF-8吸附U(VI)性能影响,并利用表征分析手段,探讨了此种MOFs 复合物吸附铀机理。研究结果可为MOFs 复合材料的合成及其用于放射性废水中U(VI)的去除提供技术和理论参考。
1 实验部分
1.1 主要试剂与仪器
六水合硝酸铀酰(UO2(NO3)2·6H2O)、六水合硝酸锌(Zn(NO3)2·6H2O)、2-甲基咪唑(C4H6N2)、二水柠檬酸三钠(C6H5Na3O7·2H2O)购于国药集团化学试剂有限公司,均为分析纯。
UV-2450 紫外分光光度计,日本岛津公司;Nicolet 6700 傅里叶红外光谱仪(Fourier Transform Infrared,FTIR),美国赛默飞世尔科技公司;EMPYREAN X 射线衍射仪,荷兰帕纳科公司;AXIS-ULTRA X 射线光电子能谱仪,英国Kratos 公司;JSM-7500F 扫描电子显微镜,日本JEOL 公司;TDL-5A离心机,上海安亭科学仪器厂;DZF-6020型真空干燥箱,上海一恒科技有限公司;pHs-3C 精密pH 计,上海精密科学仪器有限公司雷磁仪器厂;CS101-1型电热鼓风干燥箱,重庆实验设备厂。
1.2 样品制备
1.2.1 柠檬酸包覆纳米零价铁的制备
将2.238 g FeCl3溶于613.3 mL 去离子水中,迅速加入2.900 g NaBH4,氮气保护下磁力搅拌10 min,加入 4.400 g C6H5Na3O7·2H2O,继续搅拌12 h。静置后抽滤,用去离子水和无水乙醇交替洗涤4 次。将样品置于真空干燥箱(65 ℃)中干燥12 h,研磨制得柠檬酸包覆的nZVI粉末。
1.2.2 ZIF-8负载柠檬酸包覆的nZVI
分别称取0.194 7 g 柠檬酸包覆的nZVI 和1.500 g Zn(NO3)2·6H2O 加入到 50.00 mL 无水乙醇中,氮气保护下磁力搅拌均匀(体系A)。再称取3.280 g 2-甲基咪唑加入到17.50 mL 无水乙醇中溶解(体系B)。将体系B 加入到体系A 中,氮气保护下磁力搅拌4 h。搅拌完成后,放入冰箱,于4 ℃冷藏沉淀30 min。随后在10 000 r∙min−1下离心分离产物5 min得沉淀。沉淀经无水乙醇洗涤三次,在真空干燥箱中60 ℃干燥24 h。最后于室温研磨得ZIF-8负载柠檬酸包覆的nZVI 复合物粉末(nZVI@CA/ZIF-8)。
1.3 表征方法
傅里叶红外光谱仪(美国,热电公司,Nicolet 6700),以0.09 cm−1的分辨率在400~4 000 cm−1测定材料的FTIR,以确定材料可能含有的官能团。采用X 射线衍射仪(荷兰,帕纳科公司,EMPYREAN)在Cu Kα辐射(λ=1.54 nm)、仪器管电压为40 kV、管电流为30 mA、扫描角度为2θ=5°~90°、增量为0.02°/步的条件下测定材料的X 射线衍射(X-ray Diffraction Spectra,XRD),用于研究矿物成分的变化。采用X射线光电子能谱仪(英国,Kratos 公司,AXISULTRA)分析样品的表面元素及其所处的化学环境。采用扫描电子显微镜(日本,JEOL,JSM-7500F)观察材料的微观形貌。采用N2吸附-脱附实验(美国,QuadraSorb SI)测量样品的比表面积和平均孔径和孔容,确定材料的微观孔径结构。
1.4 吸附实验
取10.00 mg nZVI@CA/ZIF-8 粉末加入到25.00 mL含一定U(VI)浓度的水溶液中。利用微量HNO3或NaOH 溶液调节溶液pH,并在恒温水浴震荡箱中震荡一定时间后离心分离,取上层清液1.000 mL 于25.00 mL 容量瓶中定容。利用偶氮砷Ⅲ(Arsenazo Ⅲ)法于紫外分光光度计651.8 nm处分别测定初始和平衡U(VI)浓度,最后利用式(1)计算U(VI)平衡吸附量(qe)。
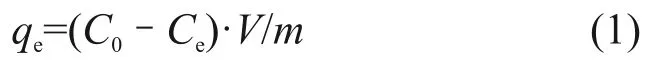
式中 :C0和Ce分别为初始和平衡 U(VI)浓度 ,mg∙L−1;V为溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 表征分析
2.1.1 XRD
nZVI@CA/ZIF-8 和 ZIF-8 的 XRD 谱 如 图 1 所示。nZVI@CA/ZIF-8在2θ为7.430°、10.45°、12.73°、14.77°、16.60°、18.20°处的衍射角分别对应ZIF-8 的(011)、(002)、(112)、(022)、(013)和(222)面[6]。此外,于 44.80°、64.90°和 82.40°处出现了 Fe0的衍射峰[7−8],表明nZVI@CA/ZIF-8成功合成。
2.1.2 扫描电镜和能谱分析
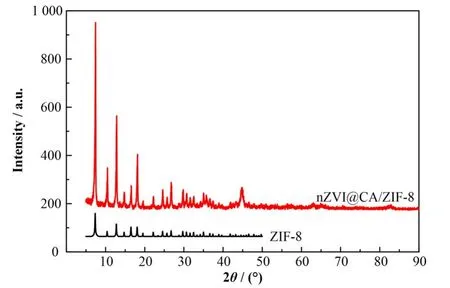
图1 nZVI@CA/ZIF-8和ZIF-8的XRD谱图Fig.1 XRD spectra of nZVI@CA/ZIF-8 and ZIF-8
吸附 U(VI)前后的 nZVI@CA/ZIF-8 扫描电镜如图2 所示。吸附前的nZVI@CA/ZIF-8 具有较为规则多面体结构,同时表面附着一定量直径约为100.0 nm 的柠檬酸包覆nZVI 颗粒。吸附 U(VI)后的nZVI@CA/ZIF-8 表面出现了较多针状或片状颗粒,这可能是由于吸附U(VI)过程中nZVI 被氧化所致。
表1列出了吸附U(VI)前后nZVI@CA/ZIF-8表面元素的原子百分比。无论吸附U(VI)前后,材料均含有C、N、Fe、O、Zn 等元素,证明柠檬酸包覆的nZVI 与ZIF-8 成功结合并表现出一定的结构稳定性。吸附U(VI)后,U 元素的原子百分数可达7.84%,表明材料对U(VI)具有较强的吸附能力。

图2 nZVI@CA/ZIF-8吸附U(VI)前后的扫描电镜图([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)Fig.2 SEM images of nZVI@CA/ZIF-8 before and after U(VI)adsorption([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)
2.1.3 FTIR
吸附U(VI)前后nZVI@CA/ZIF-8 红外吸收光谱如图 3 所示。吸附前,3 422 cm−1、3 132 cm−1和2 930 cm−1分别对应nZVI@CA/ZIF-8 中−OH、N−H和C−N伸缩振动。1 582 cm−1和1 457 cm−1处出现为C=N、C−N 吸收峰。1 421 cm−1和1 381 cm−1分别对应−COOH 和C−O 的拉伸振动。此外,1 178 cm−1和951.0 cm−1分别为柠檬酸中C−O 的特征吸收峰和−COOH 的面外变形振动峰。注意到MOFs 复合材料中于578.7 cm−1探测到了Fe−O 键振动,证实了柠檬酸包覆nZVI 颗粒存在。同时,Zn−N 的拉伸振动峰(423.2 cm−1)和2-甲基咪唑的平面外弯曲振动峰(693.3 cm−1)出现[9−10],再次验证了 nZVI@CA/ZIF-8被成功合成。
吸附U(VI)后,复合物中含N 官能团的特征吸收峰强度显著下降,这可能是由于在较低pH条件下部 分 ZIF-8 脱 溶 所 致 。 此 外 ,在 1 621 cm−1、903.3 cm−1和463.0 cm−1处出现新的吸收峰,分别对应表面−OH 的拉伸振动、O=UVI=O 的伸缩振动以及Zn−O的拉伸振动[11],可能涉及水分子进入MOFs复合材料孔道以及U(VI)通过O 与Zn 发生的配位作用。
2.1.4 BET测试
N2吸附-脱附曲线如图4 所示。nZVI@CA/ZIF-8 吸附U(VI)前后的N2吸附-脱附等温线表现为IV型H4回滞环,证明合成的MOFs复合材料具有微孔和介孔结构。吸附U(VI)后,在低的相对压力下N2吸附量显著下降,表明nZVI@CA/ZIF-8中的微孔或介孔结构可能与U(VI)的吸附密切相关。
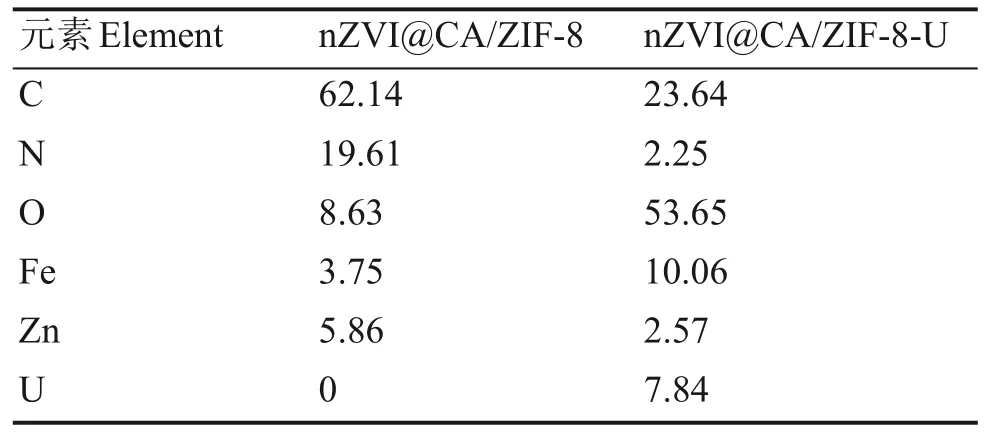
表1 吸附U(VI)前后nZVI@CA/ZIF-8表面元素的原子百分比(%)Table 1 Atomic percentage of each element on nZVI@CA/ZIF-8 before and after U(VI)adsorption(%)
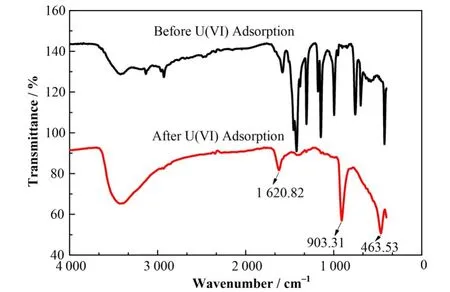
图3 nZVI@CA/ZIF-8吸附U(VI)前后的红外光谱([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)Fig.3 FTIR spectra of nZVI@CA/ZIF-8 before and after U(VI)adsorption([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)
表 2 列出吸附 U(VI)前后 nZVI@CA/ZIF-8 的BET参数。吸附U(VI)后MOFs复合材料比表面积和孔容大幅下降,说明U(VI)或水分子可能进入到nZVI@CA/ZIF-8孔道中。
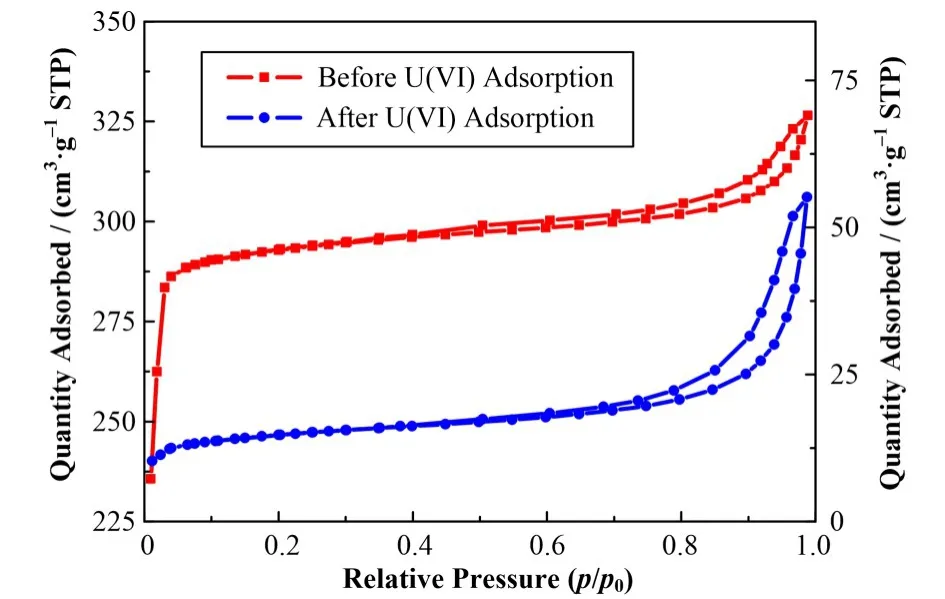
图4 吸附U(VI)前后nZVI@CA/ZIF-8的N2吸附-脱附等温线([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)Fig.4 N2 adsorption-desorption isotherms of nZVI@CA/ZIF-8 before and after U(VI)adsorption([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)
2.1.5 XPS
吸附 U(VI)前后 nZVI@CA/ZIF-8 的 XPS 全谱如图5(a)所示。吸附U(VI)前后,材料均含有C、N、Fe、O、Zn 等元素,吸附U(VI)后出现了 U4f 峰证实了此MOFs 复合物对U(VI)吸附能力,与EDX 测试结果一致。
对U4f 精细谱分峰后(图5(b)),在结合能分别为381.4 eV 和392.2 eV 拟合出代表U(IV)的峰,表明在吸附过程中涉及U(VI)的还原。进一步对O1s精细谱分峰拟合后发现(图5(c)),吸附U(VI)后在530.7 eV 和 533.2 eV 结合能处出现了 Zn−O−U 和H2O 的−OH 峰[11],再次证实了 U(VI)可能通过 O 与Zn2+发生的配位以及水分子的进入,与FTIR 分析结果一致。最后,图5(d)中在710.0 eV 和724.0 eV 结合能处代表着Fe(III)峰的出现以及709.0 eV 处的Fe0的峰位消失[12],表明 U(VI)的还原过程涉及nZVI的氧化。

表2 吸附U(VI)前后nZVI@CA/ZIF-8的BET表面积、孔容和孔径Table 2 The BET surface area,pore volume and pore size of nZVI@CA/ZIF-8 before and after U(VI)adsorption
2.2 静态吸附实验
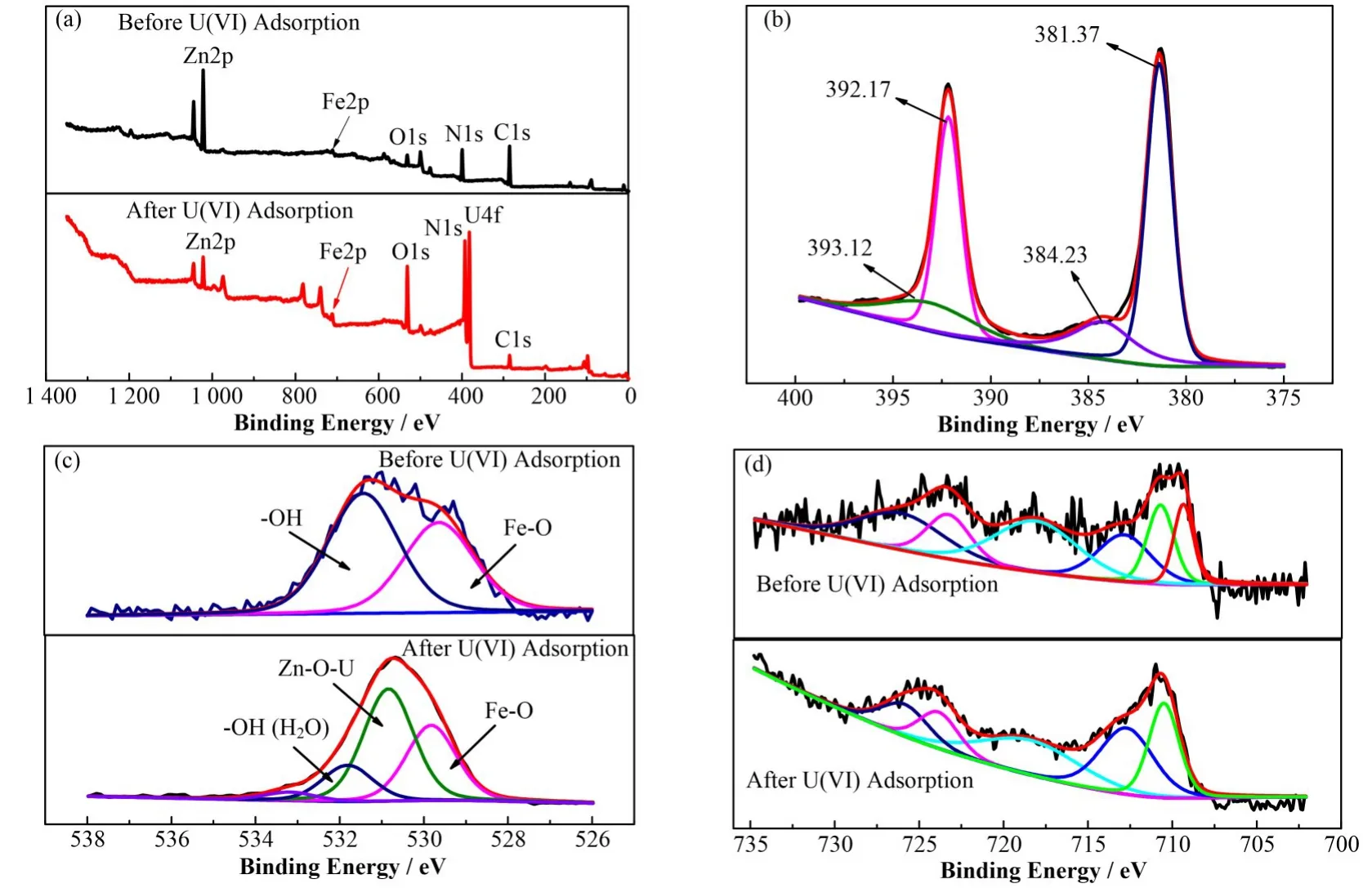
图5 吸附U(VI)前后nZVI@CA/ZIF-8的XPS全谱(a)和U4f(b)、O1s(c)、Fe2p(d)的精细谱([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)Fig.5 The XPS analysis of nZVI@CA/ZIF-8 before and after U(VI)adsorption:survey scans(a)and high-resolution scan of U4f(b),O1s(c),Fe2p(d)([U(VI)]initial=350.0 mg∙L−1,pH=4.0,S/L=0.4,t=3 h,T=25 ℃)
接触时间对 nZVI@CA/ZIF-8 吸附U(VI)性能的影响如图6(a)所示,在90 min 以内,由于材料表面的传质阻力较小,吸附量随着时间的增加而快速上升,随着吸附时间延长,有限数量的表面吸附位点被占据,在90 min 后逐渐趋于平衡。为了实验的准确性,后续实验选择3.0 h作为接触时间以保证吸附达到完全平衡。图6(b)绘制了初始pH对材料吸附U(VI)性能的影响,当 pH 小于 4.0 时,吸附量随着pH 的上升而增大,平衡吸附量约达(110.0±·5.0)mg∙g−1。低pH 下吸附量较低的原因可能是由于MOFs 复合材料表面质子化以及少量的nZVI@CA/ZIF-8 溶解所致[13]。随着 U(VI)初始浓度从 10.00 mg∙L−1增加到350.0 mg∙L−1,U(VI)吸附量逐渐增大,并在350.0 mg∙L−1以后趋于平衡(图6(c))。温度的影响如图6(d)所示,可以明显看出,较高温度有利于nZVI@CA/ZIF-8吸附U(VI),归因于加强了的离子或分子热运动。此外,nZVI@CA/ZIF-8 吸附U(VI)量在 NaCl 浓度为 0~0.5 mol∙L−1范围内基本保持不变(图6(e)),表明材料具有良好Na+抗性,即使在较高离子强度条件(0.5 mol∙L−1)下,材料依然保持较好的吸附U(VI)能力。本实验条件范围内,最佳吸附条件为:C0=350.0 mg∙L−1、pH=4.0、t=90 min和T=30 ℃。
2.3 动力学、等温模型和热力学分析
利用准一级和准二级吸附动力学模型来描述nZVI@CA/ZIF-8吸附U(VI)过程,其线性表达式:

表3 nZVI@CA/ZIF-8吸附U(VI)动力学参数Table 3 Kinetic parameters for U(VI)adsorption by nZVI@CA/ZIF-8
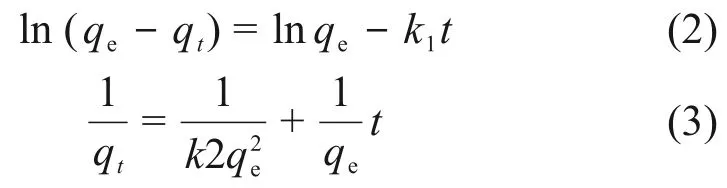
式中:qt为t时刻的吸附量,mg·g−1;k1(min−1)和k2(mg·g−1·min−1)分别是准一级和准二级速率常数。动力学拟合曲线示于图7,相应动力学参数列于表3。从相关系数(R2)值可以判断,nZVI@CA/ZIF-8吸附U(VI)更符合准二级动力学模型,表明此吸附过程为化学吸附主导[14]。
等温模型分析主要采用Langmiur 和Freundlich等温吸附模型,其表达式分别为:

式中:KL是Langmuir吸附平衡常数,L∙mg−1;KF是与吸附量有关的Freundlich常数,mg∙g−1(L∙mg−1)1/n,qm是最大理论吸附量,mg∙g−1。
等温模型拟合曲线及参数分别绘制和列于图8和表4。相较于Freundlich等温模型,Langmuir等温模型具有更高的相关系数值,表明此MOFs 复合物吸附U(VI)主要为单层表面吸附。此外,1/nF介于0.100~1.000,说明nZVI@CA/ZIF-8 对U(VI)的吸附有利[15]。
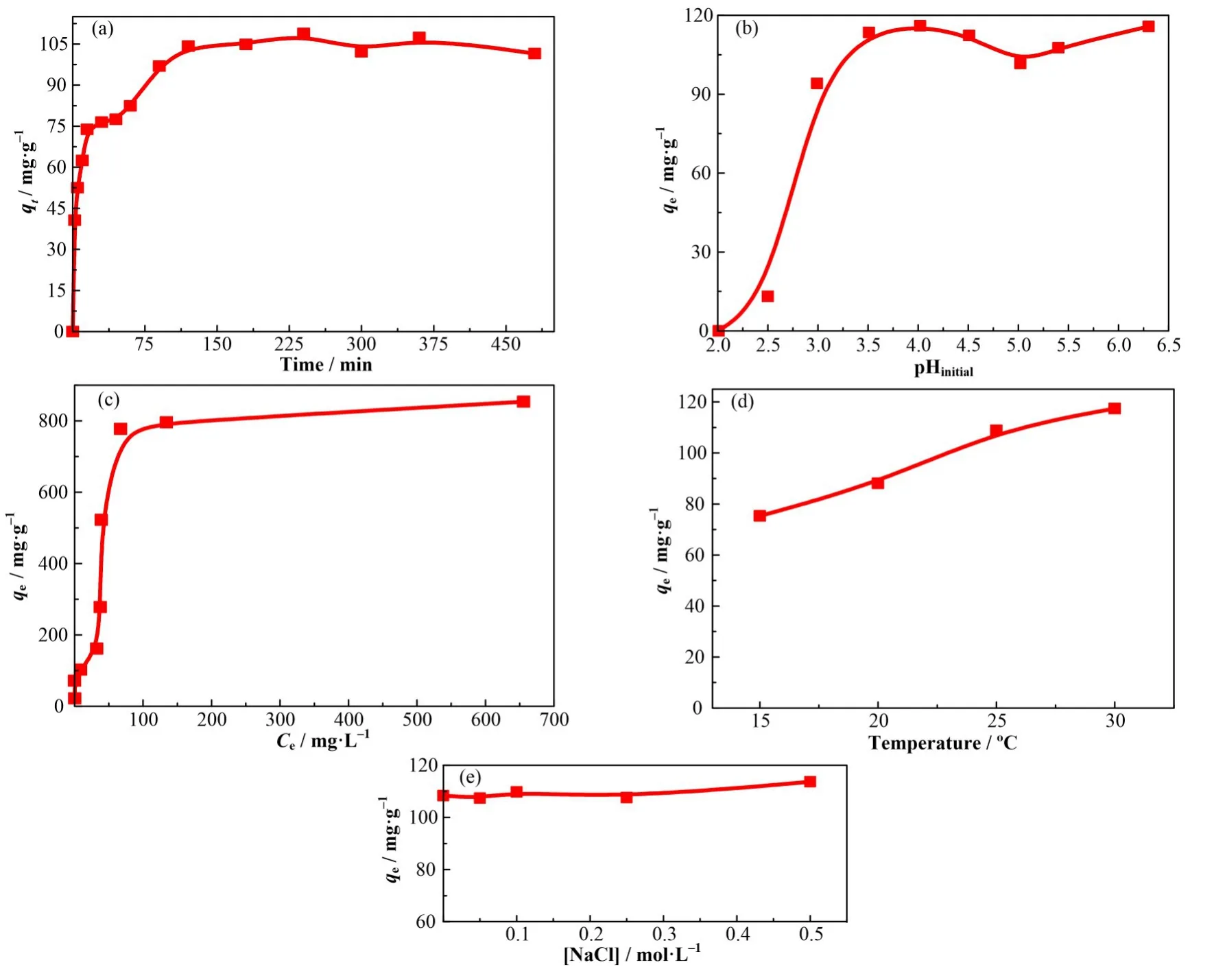
图6 时间(a)、初始pH(b)、U(VI)平衡浓度(c)、温度(d)及离子强度(e)对nZVI@CA/ZIF-8吸附U(VI)影响(实验采用控制变量法:固液比0.4,固定4个条件([U(VI)]initial=50.0 mg∙L−1,pH=4.0,t=3 h,T=25 ℃)中的三个条件,改变其中一个条件,误差范围±5%)Fig.6 The effect of contact time(a),initial pH(b),U(VI)concentration(c),temperature(d)and ionic strength(e)on U(VI)adsorption by nZVI@CA/ZIF-8(The control variable method:S/L=0.4,4 conditions are[U(VI)]initial=50.0 mg∙L−1,pH=4.0,t=3 h,T=25 ℃,among which 1 condition is selected as the variable,Error range of±5%)
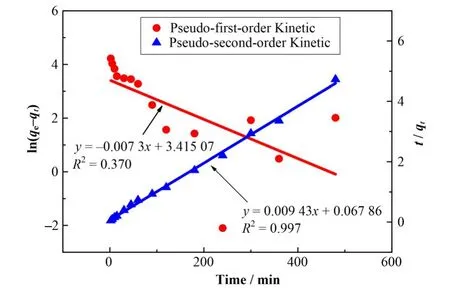
图7 nZVI@CA/ZIF-8吸附U(VI)动力学模型拟合曲线Fig.7 Fitting curves of the adsorption kinetic models for U(VI)adsorption by nZVI@CA/ZIF-8
热力学参数值计算:
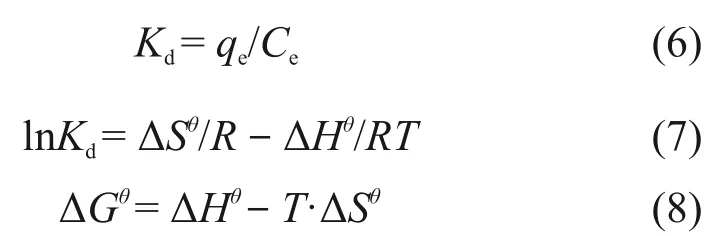
式中 :Kd为分配系数 ,mL·g−1;ΔHθ(kJ·mol−1),ΔSθ(J·mol−1·K−1)和 ΔGθ(kJ·mol−1)分别为焓变、熵变和吉布斯自由能变化;T为绝对温度,K;R为气体常数,8.314 J·mol−1·K−1。

表4 Langmuir和Freundlich等温模型参数Table 4 Langmuir and Freundlich isothermal model parameters
从lnKdvs.1/T线性曲线(图9)得到相应的热力学参数值(表5)。ΔHθ大于0表明此MOFs复合物吸附U(VI)为一吸热过程,此外和ΔGθ值随着温度的增加而下降,表明高温有利于nZVI@CA/ZIF-8复合材料吸附U(VI)。
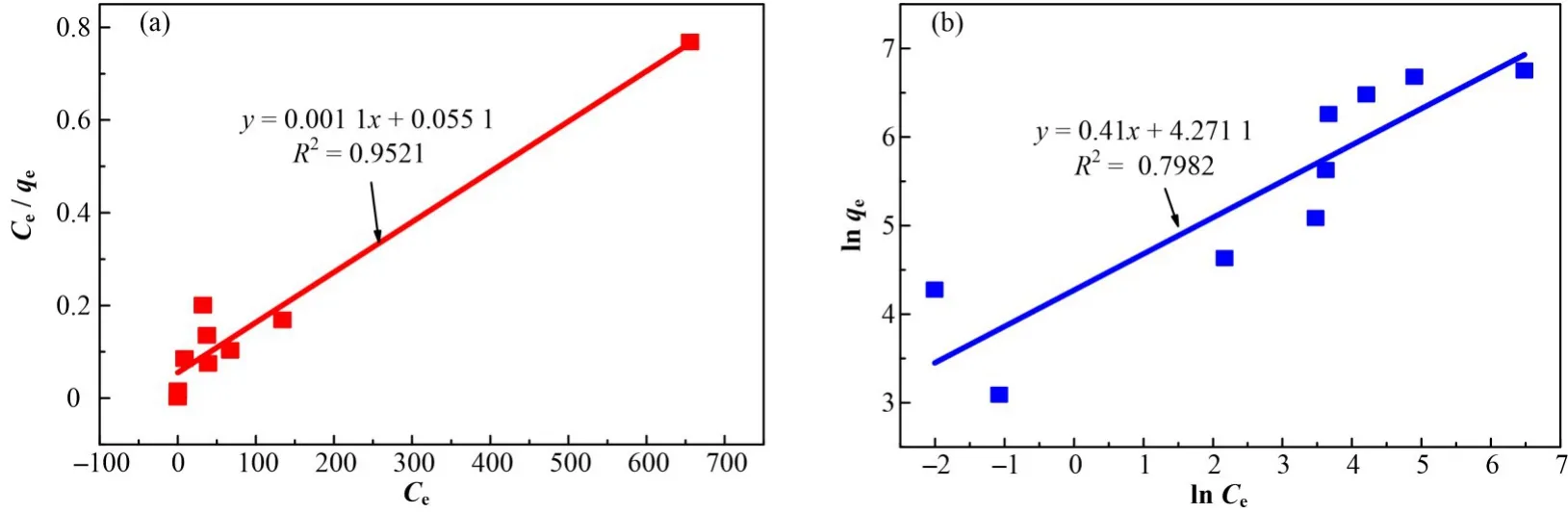
图8 nZVI@CA/ZIF-8吸附U(VI)的Langmiur等温模型(a)和Freundlich等温模型(b)拟合曲线Fig.8 Langmuir(a)and Freundlich(b)isotherm models for U(VI)adsorption by nZVI@CA/ZIF-8
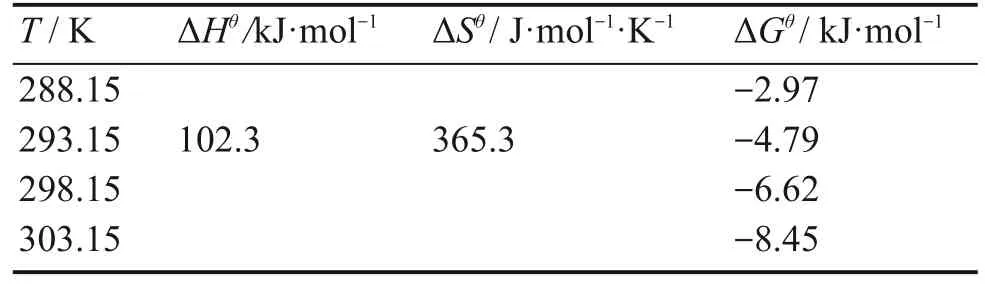
表5 nZVI@CA/ZIF-8吸附U(VI)的热力学参数Table 5 Thermodynamic parameters for U(VI)adsorption by nZVI@CA/ZIF-8
Olga 等[16]考察了零价纳米铁颗粒与铀酰离子反应机理,发现在pH 为3~7 的10−3mg∙L−1的铀酰溶液中,铀主要以还原沉淀UO2的形式从溶液中去除。Sun等[17]研究了还原氧化石墨烯负载纳米零价铁复合物对U(VI)的协同吸附和还原过程,X 射线吸收近边结构(X-ray Absorption Near Edge Structure,XANES)和XPS谱分析表明,SOUO2+和UO2(s)共存于复合物表面。此外,结合本实验各表征分析数据,nZVI@CA/ZIF-8 吸附 U(VI)主要涉及 U(VI)被nZVI 颗粒还原为U(IV)并以UO2形式赋存于复合物表面,以及与Zn形成Zn-O-U配位键。综上研究,绘制可能的 nZVI@CA/ZIF-8 吸附 U(VI)机理图(图10)。

图9 nZVI@CA/ZIF-8吸附U(VI)的热力学分析曲线Fig.9 Thermodynamic fitting curves for U(VI)adsorption by nZVI@CA/ZIF-8
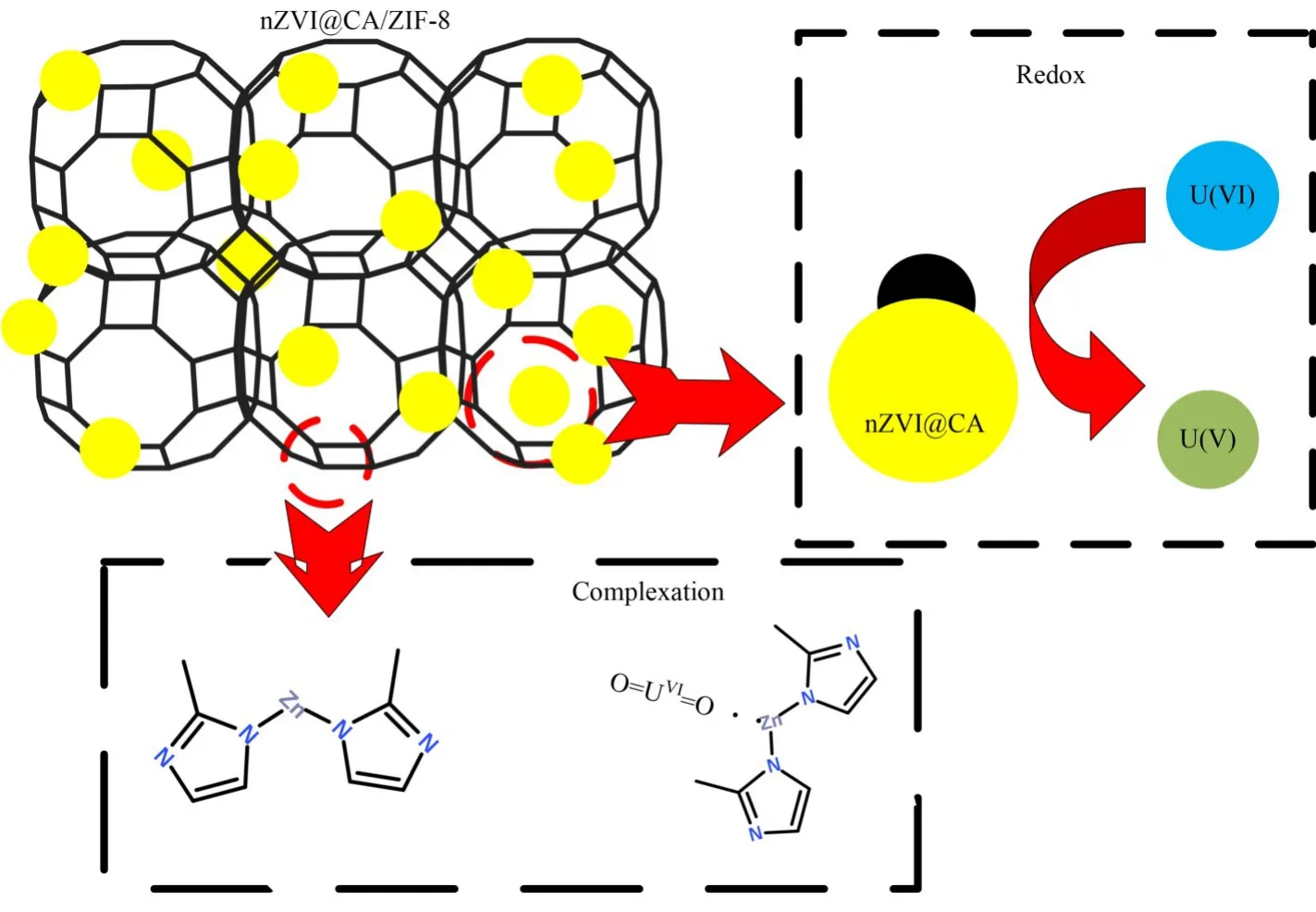
图10 nZVI@CA/ZIF-8吸附U(VI)机理示意图Fig.10 Schematic plot of mechanisms for U(VI)adsorption by nZVI@CA/ZIF-8
3 结语
1)成功制备了一种具有高比表面积(1 271 m²∙g−1)的 ZIF-8 负载柠檬酸包覆的 nZVI 复合材料(nZVI@CA/ZIF-8)。XRD和SEM-EDX结果表明:nZVI@CA/ZIF-8 具有 ZIF-8 和 nZVI 的晶体结构及显微形貌,并表现出对U(VI)良好的吸附性能。FTIR和XPS分析表明,U(VI)能被nZVI颗粒还原为U(IV)并以UO2形式赋存于复合物表面,并可能和nZVI@CA/ZIF-8形成Zn-O-U表面配位键。
2)静态实验表明,nZVI@CA/ZIF-8 对U(VI)吸附量随着初始pH、U(VI)初始浓度和温度的升高而增加。在pH 为4.0、反应温度为25 ℃、铀初始浓度为50.00 mg∙L−1的条件下,复合物对U(VI)的平衡吸附量约可达115.0 mg∙g−1。此外,即使在较高钠离子强度(0.5 mol∙L−1)条件下,此种MOFs复合材料依然保持较好的吸附U(VI)能力。
3)动力学、等温模型和热力学分析结果表明:nZVI@CA/ZIF-8 对 U(VI)吸附过程为一自发吸热的单层表面化学吸附过程。
综上研究,nZVI@CA/ZIF-8 对 U(VI)具有良好的吸附性能,有望成为水溶液中U(VI)的提取或去除候选MOFs复合材料。
