燥邪对健康大鼠气管和肺内细小支气管黏膜组织肺泡表面活性物质相关蛋白-D表达的影响
2021-04-20刘姗姗王丽鑫张旺旺
刘姗姗,王丽鑫,张旺旺,史 红
(新疆医科大学中医学院,新疆 乌鲁木齐 830000)
燥邪为中医外感六淫邪气之一,具有“燥性干涩,易伤津液”等致病特点。我国以新疆为代表的西北部地区,地处沙漠边缘,干旱半干旱是其特有的气候特征。有研究指出,我国西北“燥发无时,非独秋有,燥气偏盛”,其民常罹患西北燥证而变生他疾[1]。肺泡表面活性物质(Pulmonary surfactant,PS)相关蛋白(Suractant-associated protein,SP)中的蛋白-D(SP-D)是肺先天防御系统的主要分子,也是肺组织抵御感染的一道防线[2]。又中医学认为肺与外界相通为“娇脏”,易为燥邪所伤,故本研究着眼于与外环境直接接触的气道黏膜以及肺内细小气道黏膜组织,在实验室营造秋燥之邪(以下简称轻度燥邪)和西北方域燥邪(以下简称重度燥邪),比较二者对健康大鼠气道和肺内细小支气管黏膜组织形态学及SP-D表达的影响,探讨燥邪犯肺或导致机体亚健康状态的微观机制,以期为研究西北燥证主证(又称肺卫孔窍皮肤燥证)的证候机制寻找线索。
1 材料与方法
1.1 实验材料
1.1.1 动物分组与实验干预:将60只SPF级SD雌鼠[动物生产许可证号SYXK(新)2011-0004,140~160 g,鼠]按体重随机均分为六组,即正常对照组(N-24 d和N-48 d)置于常温(21 ℃)常湿(相对湿度50%~55%)SPF级环境中;秋燥组(D-24 d和D-48 d)置于人工气候箱中予轻度燥邪;西北燥组(D&D-24 d和D&D-48 d)在人工气候箱和砂尘试验箱内予重度燥邪;全部大鼠普食饲喂,干预24 d和48 d。
1.1.2 主要仪器:改造后的PRX-1250B型程控智能人工气候箱(上海德洋意邦仪器有限公司),DSC-1000型砂尘试验箱(江苏博科)。
1.1.3 主要试剂:博士德兔抗SP-D抗体(1∶50)。Abcom兔抗SP-D抗体(1∶2000),3% H2O2(山东德新康)。兔二步法试剂盒、0.01 mol/L枸橼酸盐抗原修复液、羊血清封闭液、DAB显色试剂盒、苏木素染液、伊红染液、0.01 mol/L PBS缓冲液均使用中杉金桥产品。
1.1.4 标本的采集与制备:干预结束后禁食不禁水16 h以上,之后用10%水合氯醛腹腔注射保定大鼠,腹主动脉采血后迅速摘取上气道和右肺中叶组织,在4 ℃生理盐水中洗3遍,用4%多聚甲醛固定组织,常规脱水、石蜡包埋,制备石蜡切片。
1.2 实验方法
1.2.1 秋燥组(轻度燥邪)模拟:参考燥邪模拟方案[3],人工气候箱温度的设定采用方案中Ⅰ类和Ⅲ类参数(6~24 ℃和10~30 ℃)、相对湿度为5%~45%,日均相对湿度(24.33±11.29)%,风速3 m/s,光照度 5~20 LX且日照总时数递减,以此模拟轻度燥邪。
1.2.2 西北燥组(重度燥邪)模拟:参考燥邪模拟方案[3],人工气候箱温度的设定采用方案中Ⅰ-Ⅳ类温度参数,日温差也随Ⅰ-Ⅳ类温度参数的不同分别进行设定;光照度设定为5~20 LX,但适时递增和递减日照总时数以模拟四季日照;同时使用砂尘试验箱进行风沙干预,设定风速为6~8 m/s,粒径小于10 μm浮尘吹尘20 min/次,浮尘量300 g/(m3·次),两次吹尘间隔10 min,干预强度1 h/d,以此模拟重度燥邪。
1.2.3 HE染色:石蜡切片,60 ℃温箱烤片40 min,常规脱蜡,苏木素染色2 min,自来水洗去多余染液,伊红染色1 min,自来水洗去多余染液,后用1%盐酸乙醇分化3 s,0.01 mol/L PBS反蓝1 min,后依次放入80%乙醇、95%乙醇Ⅱ、95%乙醇Ⅰ和无水乙醇、两组透明液中各5 s,自然晾干后封片按1.1.4免疫组化染色,60 ℃温箱烤片,常规脱蜡,0.01 mol/L PBS缓冲液清洗5 min,连续3次;浸入3% H2O2中10 min,之后入0.01 mol/L PBS缓冲液洗3次,置于0.01 mol/L枸橼酸盐溶液中煮10 min(92~98 ℃),自然放凉,切片甩干,滴羊血清封闭液(80 μl/标本),30 min后甩干并滴加一抗,其中肺组织使用兔抗SP-D抗体(Abcam,浓度1∶2000,80 μl/标本),气道使用兔抗SP-D抗体(博士德,浓度1∶50,40 μl/标本);湿盒中4 ℃过夜,次日复温1 h后甩干,入0.01 mol/L PBS缓冲液洗3次,滴加二抗(100 μl/标本)后室温反应40 min,甩干后入0.01 mol/L PBS缓冲液洗3次,DAB显色。自来水洗后入苏木素复染2 min,用自来水洗3遍,再入1%盐酸乙醇中分化1 s,自来水反蓝1 min,依次放入80%乙醇、95%乙醇、95%乙醇、无水乙醇、两组透明液中各5 s,晾干后用中性树胶封片备用。
1.3 统计学方法 采用Image-Pro Plus 6.0 分析免疫组化图像图像并记录积分光密度(IOD),采用SPSS 23.0进行统计分析,两组间比较采用t检验(方差齐时)或近似t检验(方差不齐时);多组组间平均IOD值进行单因素方差分析(One-Way ANOVA),当组间方差齐时,用最小显著性差异法(LSD),当组间方差不齐时用多元Tamhane’s T2。以P<0.05为差异有统计学意义。
2 结 果
2.1 燥邪对健康大鼠气道组织形态学的影响 镜下N-24 d组和N-48 d组大鼠气管结构完整,假复层纤毛柱状上皮细胞排列有序,未见黏膜肿胀、充血、增生、断裂脱落及炎性改变。D-24 d组假复层纤毛柱状上皮部分脱落、分布稀疏,出现局灶性增生、充血和炎性浸润。相较于D-24 d组,D-48 d组大鼠气管增生、充血明显伴多发炎性病灶,并见黏膜断裂缺失,假复层纤毛柱状上皮细胞排列紊乱。D&D-24 d组黏膜显著增生、充血肿胀明显,黏膜及黏膜下层大面积炎性浸润,黏膜表层见尘土颗粒。D&D-48 d组气管,假复层纤毛柱状上皮损伤有所修复,细胞增殖,上皮层加厚,呈指状突出样改变,黏膜层结构不完整,纤毛量有所恢复。气管腺处依旧可见炎性细胞。提示重度燥邪干预下,随着干预时间的延长,气道组织形态学损伤有所修复(图1)。
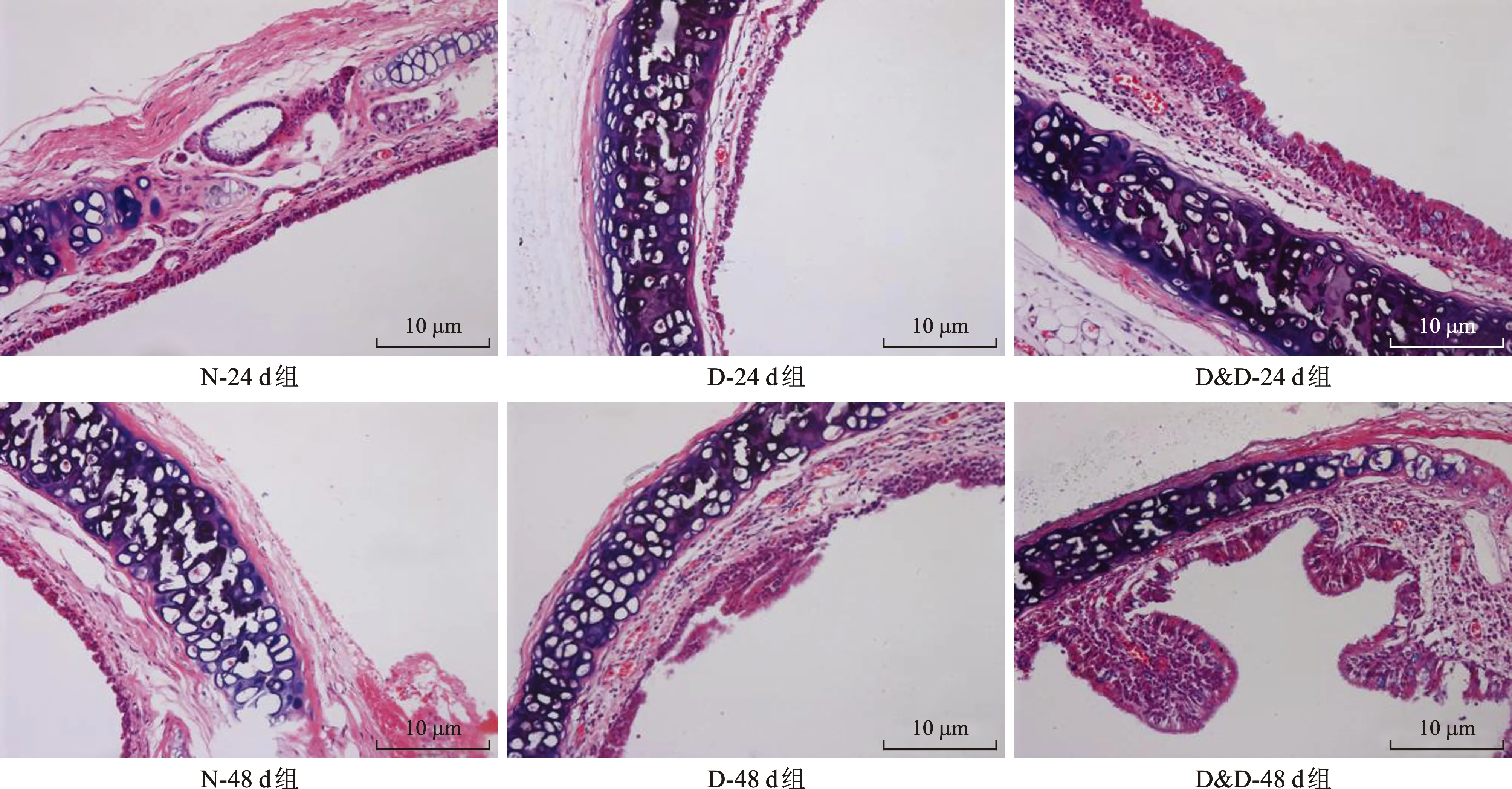
图1 各组SD大鼠气管组织形态学改变(HE染色,×200)
2.2 燥邪对健康大鼠气道黏膜SP-D的表达 各组大鼠气道黏膜组织SP-D表达的IOD均值见表1。气道黏膜SP-D表达量在N-24 d组和N-48 d组组间、在N-24 d组、D-24 d组和D&D-24 d组组间所显现的差异均无统计学意义。但N-48 d组、D-48 d组和D&D-48 d组大鼠气道黏膜SP-D表达的组间两两比较结果显示,D-48 d组气道黏膜SP-D表达量分别高于N-48 d组(P<0.05)和D&D-48 d组(P<0.05)。而对N-24 d组、D-24 d组和D-48 d组气道黏膜SP-D表达进行组间两两比较,结果亦显示D-48 d组气道黏膜SP-D表达量分别高于N-24 d组(P<0.05)和D-24 d组(P<0.05)。但N-48 d组、D&D-24 d组和D&D-48 d组大鼠气道黏膜SP-D表达的组间两两比较结果显示,上述三组组间差异均无统计学意义。提示长期处于轻度燥邪干预下大鼠气道黏膜SP-D表达出现升高的现象,但重度燥邪干预下大鼠气道黏膜SP-D的表达却未出现上述现象(图2)。

表1 轻度燥邪和重度燥邪干预下健康大鼠气道黏膜SP-D表达

图2 各组SD大鼠气道黏膜SP-D表达(免疫组化染色,×200)
2.3 燥邪对健康大鼠肺内细小支气管SP-D的表达 表2所示为各组大鼠肺内细小支气管黏膜组织SP-D表达的IOD均值。肺内细小支气管黏膜SP-D表达在N-24 d组和N-48 d组组间、N-24 d组、D-24 d组和D&D-24组三组之间、N-48 d组、D-48 d组和D&D-48 d组组间、N-24 d组、D-24 d组、D-48 d组三组组间、在N-48 d组、D&D-24 d组和D&D-48 d组三组组间的差异均无统计学意义。

表2 轻度燥邪和重度燥邪干预下健康大鼠肺内小支气管SP-D的表达
3 讨 论
PS是由脂质和疏水性表面活性物质相关蛋白组成的复合物[3],主要由Ⅱ型肺泡上皮细胞产生。PS分布于肺泡内且具有降低气液界面表面张力、维持气道稳定性及气道内液体平衡的作用[4-5]。PS是肺和气道固有免疫功能的重要组成部分,肺泡表面PS可形成防止吸入性物质扩散的屏障,保护气道免受外来药物、变应原的刺激,还可通过改善颗粒和细菌从外周气道向中央气道的运输来提高支气管的清除率[6-9]。 SP-D是胶原凝集素家族的亲水性大分子糖蛋白,主要由肺泡Ⅱ型上皮细胞分泌,占PS总重量的1%,属于模式识别分子(Pattern recognition molecules,PRMS)[2]。SP-D不仅在肺和气道表达,更可广泛表达在体内其他组织的上皮表面,SP-D同时具有固有免疫蛋白的全部特性,它不仅可以调节肺泡表面张力,稳定肺泡内压,增加肺的顺应性,减少肺组织液生成而防止肺水肿,亦可通过与黏膜束内的上皮细胞及适应性免疫细胞、先天免疫细胞的受体相互作用以发挥其免疫调节功能,并结合细菌和真菌,募集病毒,促进巨噬细胞的吞噬功能,在宿主防御和炎症调节过程中起关键作用,是呼吸系统疾病病理机制和药理机制研究的常用研究指标[10-14]。
本研究结果显示,燥邪可引起气道组织形态学的异常改变。轻度燥邪干预下,大鼠气道假复层纤毛柱状上皮部分脱落、局灶性增生、充血和炎性浸润,损伤程度随干预时长增加加重。此现象可能与燥邪性质相关,中医学认为,燥邪致病多有干燥收敛,清肃之特性,属阴中之阳,多为秋季燥热之气转化而成。其性干涩,易伤津耗液,最易伤肺,当气道受燥邪侵犯,气道内津液损耗,失于濡养从而更易引发并加重气道炎症反应。与气道组织形态学改变相同,气道黏膜SP-D表达随着干预时间的延长亦出现增高的趋势,此与云南春燥环境可使小鼠气道内SP-D含量上升的研究结果相一致[15-18]。依据血清SP-D水平升高可以作为气道炎症的生物标志物,尤指慢性气道炎症的生物标志物[19];急性肺损伤时肺组织SP-D升高考虑为保护性因素等研究结果[20-21]。本研究推断当机体感受秋燥之邪进行免疫自主调节,通过上调气道黏膜SP-D表达以促进巨噬细胞的分泌来吞噬病原体,调节机体炎症反应以增强对秋燥之邪的抵抗力。与轻度燥邪相比,重度燥邪干预下大鼠气道增生、充血明显,可见大面积炎性浸润,黏膜表层可见尘土颗粒,干预后期有所修复。但气道黏膜SP-D表达未发生明显改变,两种不同程度燥邪干预下出现的差异,提示秋燥之邪和西北方域燥邪不同干预条件下气道黏膜的固有免疫机制可能有所区别。与气道黏膜SP-D表达的变化不同,肺内细小气道黏膜SP-D表达在各组组间的差异无统计学意义,说明燥邪对健康机体肺内细小气道黏膜SP-D表达未造成直接影响。此外,本研究中西北方域燥邪干预下大鼠气道损伤状况于后期有所修复,但此现象与气道黏膜SP-D表达不相关,可推测该现象或与其他蛋白通路相关,但其具体的病理机制还有待进一步的研究探索。本研究据此推断,气道黏膜SP-D异常表达可能是燥邪致病亚健康状态的微观机制之一,或可用于阐释“肺为娇脏”和“燥易犯肺”之中医学理论;而秋燥之邪和西北方域燥邪对气道黏膜SP-D表达影响的差异性则提示,气道黏膜SP-D表达可作为西北燥证证候机制研究的线索之一。
