血清APN、25(OH)D、糖脂代谢指标与2 型糖尿病患者下肢血管病变的关系
2021-04-20修岩
修岩
梅河口市中心医院内分泌科,吉林通化 135014
下肢血管病变是2 型糖尿病患者最常见的周围血管并发症之一,是导致下肢坏疽、糖尿病组的主要病因,动脉粥样硬化是主要病理基础[1]。脂联素(APN)通过与相应受体结合能够增加胰岛素敏感性,改善胰岛素抵抗,具有保护血管内皮、抗动脉粥样硬化等作用[2]。相关研究显示[3],脂肪细胞因子-血管轴可能介导了动脉硬化的形成,而APN 在其中发挥桥梁作用。25 羟维生素D [25(OH)D]与胰岛素分泌和糖脂代谢明显相关,在血管并发症的发生与发展中具有重要作用[4]。该研究经医院伦理委员会批准后,对2018 年2月—2019 年5 月选取的97 例2 型糖尿病患者进行分析,检测血清APN、25(OH)D、糖脂代谢指标的水平变化,旨在为下肢血管病变的早期防治提供参考。现报道如下。
1 对象与方法
1.1 研究对象
选取该院收治的2 型糖尿病患者97 例,均自愿参与并签署知情同意书。入选标准:①符合世界卫生组织1999 年颁布的糖尿病诊断标准; ②肝肾功能正常,理解和沟通能力正常。排除标准:①合并糖尿病家族史、吸烟史、长期大量饮酒史;②Ⅰ型糖尿病,合并恶性肿瘤,心血管疾病、血液系统疾病以及其他内分泌疾病的患者。根据踝肱指数分为合并下肢血管病变组(踝肱指数≤0.9)44 例,单纯糖尿病组 53 例。合并下肢血管病变组中男性25 例,女性19 例;年龄46~68 岁,平均年龄(51.93±5.60)岁;糖尿病病程 3~11年,平均病程(6.27±0.85)年。单纯糖尿病组中男性 30例,女性 23 例;年龄 48~66 岁,平均年龄(52.41±5.28)岁;糖尿病病程 4~11 年,平均病程(6.57±0.91)年。另收集在该院体检的健康志愿者40 名为对照组,男性23 名,女性 17 名;年龄 45~65 岁,平均年龄(51.20±4.85)岁。3 组间性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
采集患者清晨空腹外周静脉血4 mL,2 000 r/min离心10 min,收集血清,酶联免疫吸附法检测APN 水平,化学发光法检测25(OH)D 和空腹胰岛素水平;己糖氧化酶法检测空腹血糖水平,高效液相色谱法测定糖化血红蛋白水平,计算胰岛素抵抗指数 (HOMAIR);全自动生化分析仪及配套试剂检测血脂指标;患者餐后2 h 指尖采血,检测2 hPG 水平。
1.3 统计方法
采用SPSS 21.0 统计学软件对数据进行分析,计量资料用均数±标准差 (±s) 表示,进行 t 检验,以Pearson 相关系数及Logistic 回归模型进行相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清APN、25(OH)D 及糖脂代谢指标比较
合并下肢血管病变组患者的血清APN、25(OH)D明显低于单纯糖尿病组和对照组,糖化血红蛋白、TC、TG、LDL-C 明显高于单纯糖尿病组和对照组,差异有统计学意义(P<0.05)。见表1。
2.2 相关性分析
Pearson 相关性分析显示,合并下肢血管病变组患者血清APN 水平与25 (OH)D 呈正相关 (r=0.738,P<0.001),与空腹血糖、餐后 2 h 血糖、糖化血红蛋白、TC、TG、LDL-C 呈 负 相关 (r=-0.716、-0.658、-0.703、-0.682、-0.629、-0.755,P<0.01)。
2.3 2 型糖尿病患者下肢血管病变的多因素Logistic回归分析
以2 型糖尿病患者下肢血管病变情况为因变量,以血清APN、25 (OH)D 以及各糖脂代谢指标为自变量,多因素 Logistic 回归分析显示,APN、25(OH)D 是的保护因素,糖化血红蛋白、LDL-C 是独立危险因素。见表2。
表1 3 组血清 APN、25(OH)D 及糖脂代谢指标比较(±s)

表1 3 组血清 APN、25(OH)D 及糖脂代谢指标比较(±s)
组别对照组(n=40)单纯糖尿病组(n=53)合并下肢血管病变组(n=44)F 值P 值APN(nmol/L)25(OH)D(ng/mL)空腹血糖(mmol/L)10.26±1.53(7.08±1.14)a(4.14±0.78)ab 18.072<0.001 28.29±3.65(21.73±2.21)a(16.15±1.93)ab 14.839 0.001 5.05±0.79(9.61±1.16)a(9.73±1.30)a 10.154 0.013 2 hPG(mmol/L) 糖化血红蛋白(%)7.33±0.92(12.87±1.80)a(13.24±1.69)a 11.918 0.008 5.15±0.74(7.60±0.48)a(10.27±0.95)ab 14.645 0.001
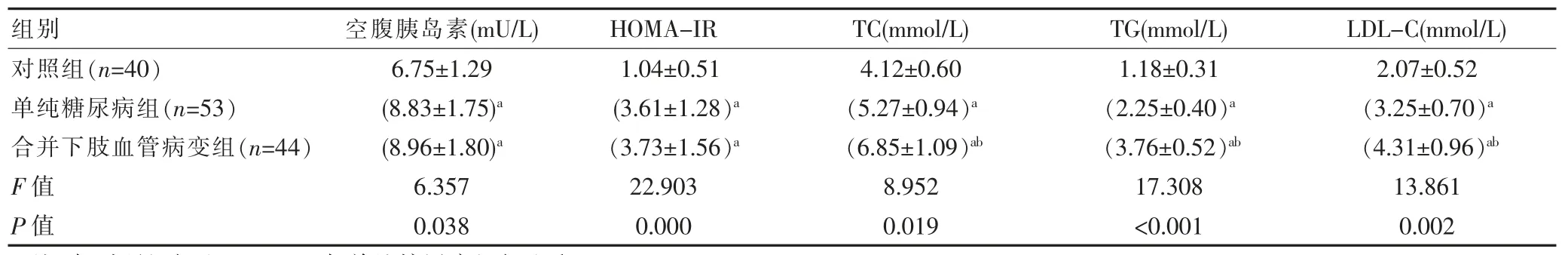
续表1

表2 2 型糖尿病患者下肢血管病变的多因素Logistic 回归分析
3 讨论
相关研究显示[5],25(OH)D 水平降低与糖化血红蛋白、空腹血糖水平升高明显相关,提示25(OH)D 在预防2 型糖尿病发生、发展过程中具有重要作用。该研究中合并下肢血管病变组患者血清APN(4.14±0.78)nmol/L、25(OH)D(16.15±1.93)ng/mL 水平明显低于单纯糖尿病组和对照组,与丁玉兰等[6]研究中糖尿病下肢血管病变患者血清 APN(4.27±0.51)nmol/L、25(OH)D(15.93±2.40)ng/mL 的结果基本一致;提示可能参与了下肢血管病变的发生与发展。相关性分析显示,血清APN 与25(OH)D 呈正相关,且均为2 型糖尿病患者下肢血管病变的保护因素。2 型糖尿病患者体内糖脂代谢紊乱主要与胰岛素分泌不足和胰岛素抵抗有关,长期高血糖状态提升了氧自由基和糖基化蛋白水平,造成血管壁损伤,慢性血管并发症发生率增加。
高血糖水平是2 型糖尿病患者血脂异常的危险因素,控制血脂代谢紊乱能够有效预防血管并发症。糖化血红蛋白能够反映2 型糖尿病患者血糖测定前3 个月的平均血糖水平,是反映血糖控制程度的常用指标;相关研究显示[7],糖化血红蛋白水平每下降1%,相关血管并发症的发生率降低15%。该研究显示,合并下肢血管病变组患者糖化血红蛋白 (10.27±0.95)%、TC、TG、LDL-C 明显高于单纯糖尿病组,与卜艳龙等[8]研究中下肢血管病变患者糖化血红蛋白水平 (10.41±1.26)%基本一致; 血清 APN 水平呈负相关,其中糖化血红蛋白和LDL-C 是下肢血管病变的独立危险因素。APN 对糖脂代谢的影响机制可能为:APN 通过提升骨骼肌对葡萄糖的摄取水平,增强骨骼肌对脂肪酸的氧化水平,降低LDL-C 水平,抑制葡萄糖输出和糖异生。
综上所述,血清APN、25(OH)D、糖脂代谢紊乱可能参与了2 型糖尿病下肢血管病变的发生与发展,临床中在纠正2 型糖尿病患者糖脂代谢紊乱的同时,应检测血清APN 和25(OH)D 水平,早期预测下肢血管病变的发生。
