SHR 并高尿酸血症降低尿酸血脂水平变化
2021-04-19飞张春李
田 飞张 春李 江
(1.乌鲁木齐市友谊医院内科,乌鲁木齐 830049; 2.新疆医科大学北校区动物实验中心, 乌鲁木齐 830011;3.中国科学院新疆分院图书馆,乌鲁木齐 830011)
高血压因其高发生率及同脑卒中的危险,心血管病,终末阶段肾疾病,影响全部人群的全部死亡率的强相关性,高血压成为全球重要的公共健康挑战。以前研究表明循环中的高尿酸水平同高血压的发生率增加和经常导致病人预后不良的心血管并发症的高危险情况相关[1]高尿酸是心血管危险的一个生物标记物[2]血中尿酸和高血压的相关性通过血脂调解[3]本研究观察自发性高血压大鼠(SHR)并高尿酸血症降低尿酸干预血脂水平的变化。
1 材料和方法
1.1 实验动物
50 只,SPF 级,近交系 SHR 雌雄各半,8 ~ 10 周龄,雄:180~260 g,雌:125~180 g,健康良好,购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。动物饲养在SPF 级动物房,饲养温度与湿度:22℃~24℃,45%~55%,动物模型制备及血脂检测均在新疆医科大学北校区动物实验中心屏障动物实验设施内进行[SYXK(新)2018-0003],整个动物实验被新疆医科大学第一附属医院动物实验医学伦理委员会批准(IACUC 20160414-08)。实验研究过程中按实验动物的使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
别嘌呤醇:化学名称:C5H4N40, 剂量:5 g,单位:瓶,纯度:>99%,批号:011M1681V,生产单位:美国Sigma 公司,货号:A8003;腺嘌呤:化学名称:C5H5N5,剂量:100 g,单位:瓶,纯度:>99%,批号:021Mol81v,生产单位: 美国 Sigma 公司, 货号:A8626;乙胺丁醇:化学名称:C10H24N202.2HCL,剂量:100 g,单位:瓶,纯度>99%,批号:109K1582V,生产单位:美国Sigma 公司,货号:E4630;UA 试剂盒:化学式:无,货号:C012,生产单位:南京建成,剂量:96T,单位:盒,纯度:无,批号:20180202;VLDL试剂盒:化学式:无,货号:CSB-E17088 r,生产单位:武汉华美,剂量:96T,单位:盒,纯度:无,批号:X320119953; LDL-C 试剂盒:化学式:无,货号:A113-1,生产单位:南京建成,剂量:96T,单位:盒,纯度:无,批号:20180128;TG 试剂盒:化学式:无,货号:110-1,生产单位:南京建成,剂量:96T,单位:盒,纯度:无,批号:20180128;HDL-C 试剂盒:化学式:无,货号:A112-1,生产单位:南京建成,剂量96T,单位:盒,纯度:无,批号:20180128;T-CHO 试剂盒:化学式:无,货号:A111-1,生产单位:南京建成,剂量:96T,单位:盒,纯度:无,批号:20180202;酶标仪:型号:XMarKTM,规格:无,生产单位:美国Bio-Rad,精密度或误差范围:0.010 D 值,范围:100~1000 nm。
1.3 实验方法
1.3.1 研究时间
2018.05.20 -2018.07.08。
1.3.2 研究设计
实验设计为完全随机设计。
1.3.3 药物配制使用
0.5% 羧甲基纤维素钠(CMC-Na)的配置:取1000 mL 的蒸馏水,加热至50℃~60℃,然后精密称取5 g CMC-Na,多次少量的加CMC-Na,边加边搅拌,然后在沸水浴上加热搅拌,到浑浊,再到澄清,然后冷却到室温,拿到离心机里面,离心,取上清液。
腺嘌呤混悬液的配置:用量筒量取25 mL 的0.5% CMC-Na 溶液,然后精密称取1 g 腺嘌呤,加入CMC-Na 溶液中,混匀得到腺嘌呤混悬液;
乙胺丁醇混悬液的配置:用量筒量取40 mL 的0.5% CMC-Na 溶液,然后精密称取2 g 乙胺丁醇,加入CMC-Na 溶液中,混匀得到乙胺丁醇混悬液;
别嘌呤醇混悬液的配置:用量筒量取25 mL 的0.5% CMC-Na 溶液,然后精密称取100 mg 别嘌呤醇,加入 CMC-Na 溶液中,混匀得到别嘌呤醇混悬液;
腺嘌呤:150 mg/kg,溶于0.5%CMC-Na,浓度为15 mg/mL。
乙胺丁醇:250 mg/kg,溶于0.5%CMC-Na,浓度为25 mg/mL。
别嘌呤醇:10 mg/kg,溶于0.5%CMC-Na,浓度为1 mg/mL。
药物使用: 给药剂量为1 mL/100 g,给药方法为每日早晨10 点灌胃一次。
1.3.4 动物模型制备
根据文献报道的方法[4-5]制备SHR 并高尿酸血症模型。根据文献报道的方法确定降低尿酸药物别嘌呤醇的剂量,SHR 别嘌呤醇剂量确定:人别嘌呤醇每日100 mg,体重按60 kg 计算,每公斤药物剂量为,动物之间给药剂量的计算按下面公式:A药量(mg/kg)×AKm 因子=B药量(mg/kg)×BKm 因子。式中:A和B分别代表两种不同动物,不同动物有不同的Km 因子。成年人Km 因子为 37,大鼠 Km 因子为 6。SHR 药量(mg/kg)×6=1.667×37;SHR 药量(mg/kg)= 10.28 mg/kg≈10 mg/kg。
1.3.5 实验分组
对照组(A1)(单纯SHR 组)n=20,雌雄各半用等体积0.5%CMC-Na 灌胃[6]两周。
SHR+高尿酸血症组(B1)n=30 雌雄各半用腺嘌呤(150 mg/kg 溶于0.5% CMC-Na)和乙胺丁醇(250 mg/kg 溶于0.5% CMC-Na)灌胃两周。继续造模对照组(A2)(单纯SHR 组)n=10(从对照组A1 随机选取),雌雄各半,在A1组干预完成后再用等体积0.5%CMC-Na 灌胃,继续灌胃5 周。SHR+高尿酸血症继续造模组(B2)n=10(从SHR+高尿酸血症组B1,随机选取),雌雄各半,在B1组干预完成后再用腺嘌呤(150 mg/kg 溶于0.5% CMC-Na)和乙胺丁醇(250 mg/kg 溶于0.5% CMC-Na)继续灌胃5 周。SHR+高尿酸血症+尿酸降低组(B3)n=10(从SHR+高尿酸血症组B1,随机选取),雌雄各半,在B1 组干预完成后再用腺嘌呤(150 mg/kg 溶于0.5% CMC-Na)和乙胺丁醇(250 mg/kg 溶于0.5%CMC-Na)和别嘌呤醇(10 mg/kg 溶于0.5%CMCNa)继续灌胃5 周。
1.3.6 UA、TC、TG、HDL-C、LDL-C、VLDL 的检测
在造模前,造模两周,造模四周,造模七周分别从大鼠收集1.5~2 mL 血到普通采血管离心,分离血清500 μL,在-80℃保存,按照试剂盒操作方法进行测定,用酶标仪检测 UA、TC、TG、HDL-C、LDL-C、VLDL.
1.4 统计学方法
2 结果
2.1 模型建立前大鼠血清中血脂指标水平
模型建立前SHR 组与SHR 并高尿酸血症组相比UA,TC,TG,HDL-C,LDL-C,VLDL 无明显差异,统计学处理为两独立样本t检验,P<0.05 表明有显著性差异,见表1。
2.2 造模两周大鼠血清中血脂指标水平
造模第二周SHR 并高尿酸血症组与SHR 组相比,VLDL,HDL-C 有明显差异。统计学处理为两独立样本t检验,P<0.05 表明有显著性差异,见表2。
2.3 造模4 周大鼠血清中血脂指标水平
造模第4 周,SHR 并高尿酸血症组与SHR 组相比TC 明显升高,统计学处理为单因素方差分析,P<0.05 表明有显著性差异,见表3。
2.3 造模7 周大鼠血清中血脂指标水平
造模第7 周,SHR 并高尿酸血症组与SHR 组相比VLDL,TC 明显升高,统计学处理为单因素方差分析P<0.05 表明有显著性差异,见表4。SHR 并高尿酸血症降低尿酸组与SHR 并高尿酸血症组相比,VLDL 明显降低,统计学处理为单因素方差分析,P<0.05 表明有显著性差异,见表4.
表1 模型建立前大鼠血清中血脂指标水平分析( ±s)Table 1 Before established animal model the analysis of serum lipids levels of SHR
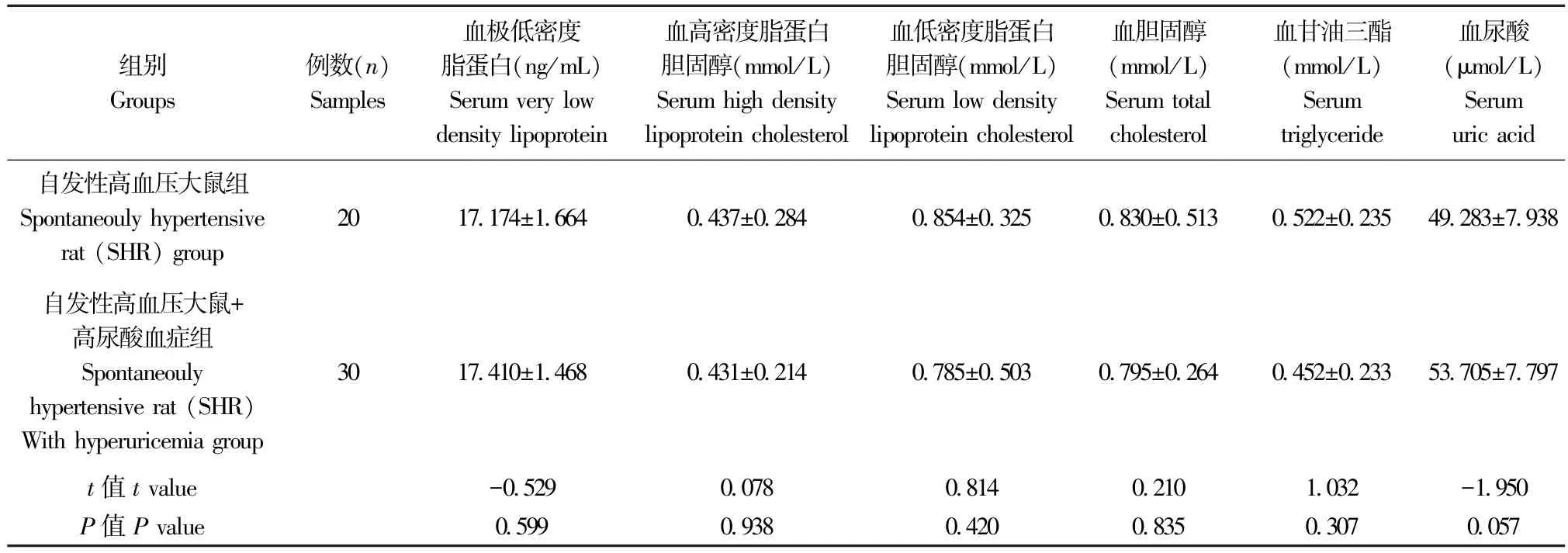
表1 模型建立前大鼠血清中血脂指标水平分析( ±s)Table 1 Before established animal model the analysis of serum lipids levels of SHR
注:两独立样本t 检验。下同。Note.Two independent samples t-test.The same as below.
组别Groups例数(n)Samples血极低密度脂蛋白(ng/mL)Serum very low density lipoprotein血高密度脂蛋白胆固醇(mmol/L)Serum high density lipoprotein cholesterol血低密度脂蛋白胆固醇(mmol/L)Serum low density lipoprotein cholesterol血胆固醇(mmol/L)Serum total cholesterol血甘油三酯(mmol/L)Serum triglyceride血尿酸(μmol/L)Serum uric acid自发性高血压大鼠组Spontaneouly hypertensive rat (SHR) group 20 17.174±1.664 0.437±0.284 0.854±0.325 0.830±0.513 0.522±0.235 49.283±7.938自发性高血压大鼠+高尿酸血症组Spontaneouly hypertensive rat (SHR)With hyperuricemia group 30 17.410±1.468 0.431±0.214 0.785±0.503 0.795±0.264 0.452±0.233 53.705±7.797 t 值t value -0.529 0.078 0.814 0.210 1.032 -1.950 P 值P value 0.599 0.938 0.420 0.835 0.307 0.057
表2 模型建立两周,大鼠血清中血脂指标水平分析( ±s)Table 2 Established animal model for two week,the analysis of serum lipids levels of SHR
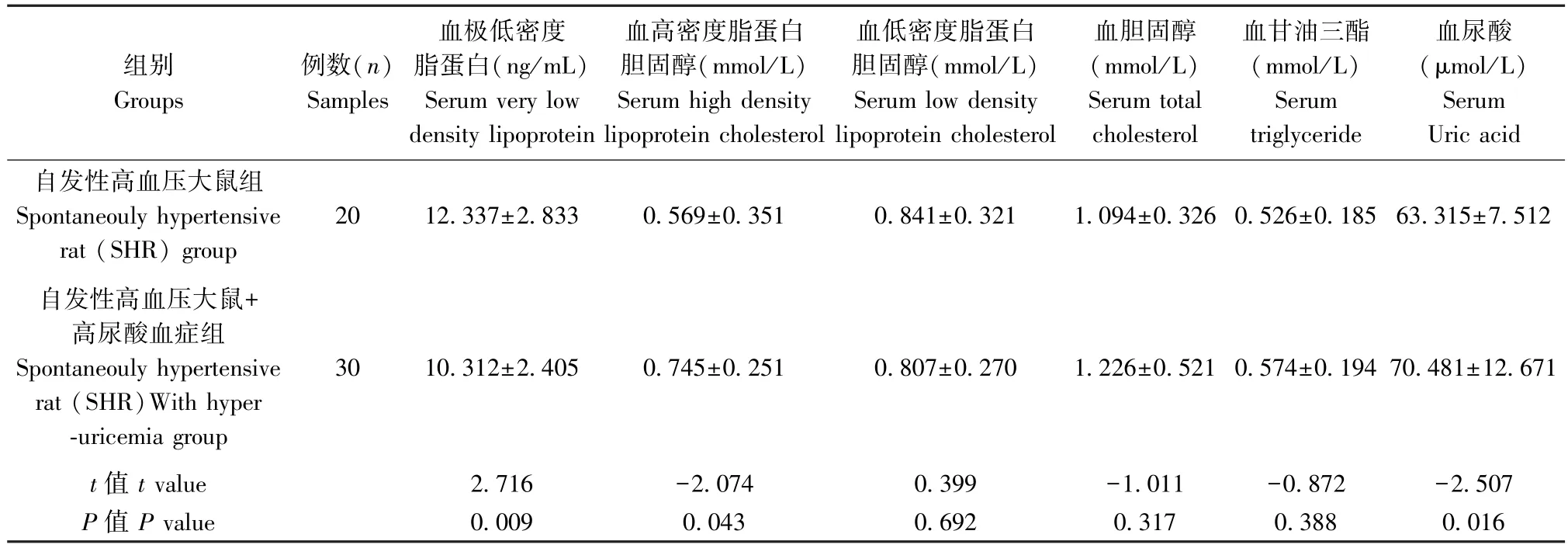
表2 模型建立两周,大鼠血清中血脂指标水平分析( ±s)Table 2 Established animal model for two week,the analysis of serum lipids levels of SHR
组别Groups例数(n)Samples血极低密度脂蛋白(ng/mL)Serum very low density lipoprotein血高密度脂蛋白胆固醇(mmol/L)Serum high density lipoprotein cholesterol血低密度脂蛋白胆固醇(mmol/L)Serum low density lipoprotein cholesterol血胆固醇(mmol/L)Serum total cholesterol血甘油三酯(mmol/L)Serum triglyceride血尿酸(μmol/L)Serum Uric acid自发性高血压大鼠组Spontaneouly hypertensive rat (SHR) group 20 12.337±2.833 0.569±0.351 0.841±0.321 1.094±0.326 0.526±0.185 63.315±7.512自发性高血压大鼠+高尿酸血症组Spontaneouly hypertensive rat (SHR)With hyper-uricemia group 30 10.312±2.405 0.745±0.251 0.807±0.270 1.226±0.521 0.574±0.194 70.481±12.671 t 值t value 2.716 -2.074 0.399 -1.011 -0.872 -2.507 P 值P value 0.009 0.043 0.692 0.317 0.388 0.016
表3 模型建立4 周,大鼠血清中血脂指标水平分析( ±s)Table 3 Established animal model for four weeks, the analysis of serum lipids levels of SHR

表3 模型建立4 周,大鼠血清中血脂指标水平分析( ±s)Table 3 Established animal model for four weeks, the analysis of serum lipids levels of SHR
注:与SHR 组相比,▲P<0.05;与SHR+高尿酸血症组相比,1P<0.05。单因素方差分析。下同。Note.Compared with the group of SHR, ▲P<0.05.Compared with the group of SHR with hyperuricemia, 1P<0.05.Analysis of variance of completely random design.The same as below.
组别Groups例数(n)Samples血极低密度脂蛋白(ng/mL)Serum very low density lipoprotein血高密度脂蛋白胆固醇(mmol/L)Serum high density lipoprotein cholesterol血低密度脂蛋白胆固醇(mmol/L)Serum low density lipoprotein cholesterol血胆固醇(mmol/L)Serum total cholesterol血甘油三酯(mmol/L)Serum triglyceride血尿酸(μmol/L)Serum uric acid自发性高血压大鼠组Spontaneouly hypertensive rat (SHR) group 10 10.062±2.723 0.714±0.329 0.863±0.190 0.848±0.362 0.575±0.156 69.762±13.460自发性高血压大鼠+高尿酸血症组Spontaneouly hypertensive rat (SHR) With hyperuricemia group 9 9.484±3.386 0.560±0.531 0.921±0.271 1.273▲±0.351 0.710±0.261 83.796▲±11.152自发性高血压大鼠+高尿酸血症+尿酸降低组Serum Uric acid-Lowering therapy of Spontaneouly hypertensive rat (SHR)with hyperuricemia group 10 11.741±2.257 0.663±0.286 0.903±0.194 1.161±0.534 0.588±0.119 72.556±9.5951
表4 模型建立7 周,大鼠血清中血脂指标水平分析( ±s)Table 4 Established animal model for seven weeks,the analysis of serum lipids levels of SHR

表4 模型建立7 周,大鼠血清中血脂指标水平分析( ±s)Table 4 Established animal model for seven weeks,the analysis of serum lipids levels of SHR
组别Groups例数(n)Samp-les血极低密度脂蛋白(ng/mL)Serum very low density lipoprotein血高密度脂蛋白胆固醇(mmol/L)Serum high density lipoprotein cholesterol血低密度脂蛋白胆固醇(mmol/L)Serum low density lipoprotein cholesterol血胆固醇(mmol/L)Serum total cholesterol血甘油三酯(mmol/L)Serum triglyceride血尿酸(μmol/L)Serum uric acid自发性高血压大鼠组Spontaneouly hypertensive rat (SHR) group 10 11.857±1.713 0.921±0.565 1.128±0.143 1.084±0.401 0.734±0.248 70.178±12.542自发性高血压大鼠+高尿酸血症组Spontaneouly hypertensive rat (SHR) With hyperuricemia group 9 8.937▲±0.953 0.630±0.422 1.172±0.163 1.574▲±0.266 0.813±0.275 97.761▲±10.739自发性高血压大鼠+高尿酸血症+尿酸降低组Serum uric acid-Lowering therapy of Spontaneouly hypertensive rat (SHR) with hyperuricemia group 10 11.1751±1.748 0.909±0.365 1.108±0.092 1.462±0.545 0.694±0.289 76.092±7.8951
3 讨论
本研究构建SHR 并高尿酸血症降低尿酸动物模型观察血脂水平变化,在造模第二周SHR 并高尿酸血症组与 SHR 组相比 VLDL、HDL-C 有明显差异,在造模第四周,SHR 并高尿酸血症组与SHR 组相比TC 明显升高,在造模第七周时SHR 并高尿酸血症组与 SHR 组相比 VLDL、TC 明显升高,SHR 并高尿酸血症降低尿酸组与SHR 并高尿酸血症组相比VLDL 明显降低。
高尿酸是一个在脂肪组织中,内分泌不平衡的促炎介质,其是血脂不正常及导致动脉粥样硬化的炎性过程的重要因素之一[7]。
血中尿酸水平与高身体脂肪之间的相关性机制不清楚,一个可能的解释是果糖摄入,过多的果糖的消耗是饮食导致高尿酸血症的原因。有证据果糖引起细胞内ATP 消耗,核苷酸转换。并且尿酸产生。果糖诱发尿酸产生引起线粒体过氧化应激其另外有利于引起脂肪蓄积,有些研究表明,脂肪组织有丰富的黄嘌呤过氧化酶活性并且能产生和分泌尿酸;一些研究观察到血中尿酸水平同TG 呈正相关。同HDL-C 呈负相关。血中尿酸水平和TG相关性不清楚。但有些可能的解释,根据这些解释之一,在肝尿酸能诱发脂质机制,并且能阻止脂肪酸过氧化。其他研究者提出脂肪酸肝合成同嘌呤从头合成相关伴随加速尿酸产生;根据 Johnson等[2]的研究表明尿酸可占有脂肪细胞在这里诱发过氧负荷,产生炎症介质和抑制脂联素合成[8]。
高血尿酸水平明显同收缩压相关,高TG 水平同舒张压和收缩压相关;高TG 或血中尿酸水平导致高血压机制不明,几个研究报道:高血尿酸水平在胰岛素诱发的No 产生通过血管阻抗,诱发内皮功能失调,可能导致高血压,另外高TG 水平也同胰岛素抵抗强相关,通过增强交感神经系统反应性,激活肾素血管紧张素系统,并且刺激肾小管钠重吸收,肾素血管紧张素系统激活不仅通过高血尿酸水平也通过高TG 水平,这两个因素相互作用影响血压,血中尿酸水平同炎症,氧化应激强相关[9]。
有几个研究报道了高尿酸血症同血脂的相关性,在印度,意大利,美国成年人群,人血中尿酸水平同脂质谱有明显的相关性[7]。Ferreira 等[8]所做的研究为:在健康年轻人和中年成年人中评估血尿酸水平同心血管代谢危险因素的相关性,入选样本149 个,Brazilian 成年人年龄 20 ~ 55 岁,男、女两性均调整混杂因素,血尿酸水平同低密度脂蛋白胆固醇,甘油三酯呈正相关,同高密度脂蛋白胆固醇呈负相关。研究表明:血中高尿酸水平同身体过多脂肪细胞和脂质谱代谢异常呈相关性。
Cheng 等[10]所做的研究为检查在没有糖尿病的人群中,血中尿酸水平同心血管病危险的相关性。入选样本8252 人,年龄为大于40 岁。没有糖尿病的来自于中国上海嘉定区,研究结果表明:较高四分之一尿酸水平与最低四分之一尿酸水平相比,对于较高的血脂代谢异常发生有预测价值。Zhang 等[11]所做的研究为回顾性分析体检数据,入选样本中国开封24438 人,男 12557 人,女 11881人。结果表明:在男女两性中高甘油三脂同高尿酸血症呈正相关。这种相关性,尤其在与年龄相关的妇女中明显。Shi 等[12]所做的研究为横断面研究在中国东北,入选样本6466 人,结果表明:甘油三酯-血糖指数和高尿酸血症危险性呈线性和强有力相关。在高尿酸血症的防治中,血糖和血脂同时控制是重要的,甘油三酯一血糖指数优化危险分层和防治高尿酸血症有重要价值。
Cheng 等[10]研究为在没有糖尿病的中国成人中,10 年Framingham 冠心病危险研究和10 年动脉粥样硬化心血管病研究血中尿酸水平同肥胖,高血压,脂质异常发生率的危险性增加相关。
Cao 等[3]所做的研究为:通过人群纵向研究在中国人群中代谢混杂因素调整后,升高的血中尿酸浓度独立的与新发生的高血压相关。肥胖,血脂,血糖在高尿酸血症所致高血压的发生发展通路中起重要的调节作用。
血中高尿酸水平增加血脂异常,尿酸可归于血脂异常的进展,血中尿酸水平升高明显同血脂异常和它的成分相关,这种关系受年龄和性别影响[13]。
血脂异常与无症状的高尿酸血症相比在痛风的病人中更常见。在痛风中,HDL-C 是血中尿酸水平的保护性预测因子[14]。
研究表明调整可能的混杂因素:整个血胆固醇、甘油三酯、LDL-C 水平的血脂异常成份同血中尿酸水平呈正相关。血HDL-C 水平同血中尿酸水平呈负相关[15]。
年龄3 ~19 岁的高血压儿童中,一年前瞻性观察研究。通过横断面纵向研究探索血尿酸水平同心血管危险因素相关性。血中尿酸水平升高的高血压儿童有与心血管病危险因素相关的较高的肥胖发生率。较低高密度脂蛋白胆固醇同基线升高的血尿酸水平明显相关[16]。
横断面研究样本:144856 年龄20 ~79 岁,比老年人超重或肥胖的个人,年轻人更易发展成高尿酸血症。超重/肥胖一般被认为是高尿酸血症的危险因素,较高的体重指数(BMI)是同血尿酸水平升高相关,临床研究发现较高体重指数(BMI)也同升高的血尿酸水平相关。重量减少伴随血中尿酸浓度减少。在流行病学研究中,血中尿酸水平同BMI 的关系已建立[17]。
在2 型糖尿病病人中,高尿酸血症发生率同升高的甘油三酯浓度,高甘油三酯/高密度脂蛋白胆固醇比值相关[18]。
在许多研究中,在成年人和儿童中高血中尿酸浓度同较高的血压的相关已报道,高血中尿酸浓度同血脂异常相关已表明是低HDL-C 水平而不是增加LDL 或VLDL 水平的结果。研究证实升高的血中尿酸同低HDL-C 和高甘油三酯相关[19]。
人群群体研究表明血中尿酸水升高与血脂异常相关。血中尿酸水平同TC、TG、LDL-C 呈正相关与HDL-C 呈负相关。在SHR 并高尿酸血症降低尿酸动物模型构建过程中观察血脂变化,TC 的变化与人群群体研究的变化相一致,这为原发性高血压合并高尿酸血症,降低尿酸,降低血脂提供理论依据,造模第七周时SHR 并高尿酸血症组与SHR 组相比VLDL 升高,别嘌呤酸降低血中尿酸水平VLDL 也降低。今后需在人群群体中做随机对照研究,观察原发性高血压并高尿酸血症,降低血中尿酸水平,血脂水平的变化。为原发性高血压并高尿酸血症脂质代谢异常参与发生机制提供理论依据。
麻醉深度是动物实验过程中造成偏倚的因素,在动物实验第4 周SHR 并高尿酸血症组一只大鼠因麻醉过深导致死亡,造成对动物实验结果的影响,这是本动物实验的局限性。
替换、减少、优化3R 原则是世界范围内动物实验共同遵守的原则,在本动物实验中保定大鼠遵循温和保定、善良抚慰,减少动物病痛和应激反应,优化改进,完善动物实验程序。
任何一种动物模型都不能全部复制人类疾病的所有表现,动物毕竟不是人体,模型实验只是一种间接性研究。只可能在一个局部或一个方面与人类疾病相似,所以模型实验结论的正确性是相对的,最终还必须在人体上得到验证,复制过程中一旦发现与人类疾病不同的现象,必须分析差异的性质和程度,找出异同点,以正确评估[20]。
