3种水生植物组合对双酚A胁迫的响应
2021-04-19聂显光
聂显光 王 琳
(中国海洋大学环境科学与工程学院/海洋环境与生态教育部重点实验室,山东 青岛 266100)
双酚A[2,2-双(4-羟基苯基)丙烷,bisphenol A,BPA],具有内分泌干扰特性,主要用于生产环氧树脂、聚碳酸酯和聚砜树脂等聚合物材料[1-2]。2013年至2019年,全球BPA 产量以每年4.6%的速度增长[3]。由于BPA 的大量生产和广泛使用,导致其在自然环境中的释放和积累也随之增加,日本在垃圾填埋场渗滤液中检测出的BPA 浓度高达17.2 mg·L-1,德国高达25 mg·L-1,远超出饮用水安全浓度(1.5 mg·L-1)[4-6]。生物学和毒理学试验证实BPA 对环境和暴露的生物体均有不利影响[7-10]。因此,有必要研究BPA 污染对生态系统功能的影响。
由于植物是生态系统的主要生产者,污染物对植物所引起的生长和代谢紊乱等影响,可以直接或间接影响生态系统功能的正常运转,进而威胁整个生态系统的安全。已有较多研究证实BPA 对植物有毒性,高剂量BPA 可以抑制种子发芽、植物生长以及花粉管的形成和伸长[11-14],BPA 还可以通过干扰光合系统、氮循环和激素合成来影响植物的生长发育[15-16]。另外,BPA 还会引起植物的抗氧化应激反应,其中包括马齿苋[17]、番薯[18]、桉树[19]、凤眼兰[20]、烟草[21]、鼠尾草[22]和巴西龙血树[23]等。这些研究均集中于单一植物,然而单一物种的生态系统在现实中难以存在,多植物系统更贴近自然生态环境。多植物系统中存在不同的生态位需求和养分吸收途径,可导致植物组合对资源利用的互补性或其他“互补性”机制的形成,同时也能提高水生态系统的养分循环[24]。大型水生植物物种之间的生长形式和季节变化给予了物种在调节植物总生物量和养分吸收等方面及时互补的能力[25-26]。研究发现,多种植物组合一般较单一植物有较强的净化水体污染物的能力,植物多样性越高,生态系统功能越稳定,净化效应越强[27-28]。为了提高植物组合去除污染物效率,有必要研究多种植物组合内各植物的生理生化状态,进一步了解植物组合提高净化效能的机制。
本研究通过外施BPA 分析芦苇(Phragmites australis)、香蒲(Typha orientalis presl)和荻(Triarrhenasacchariflora)3 种湿地植物及其组合的生长情况及其光合色素含量、H2O2含量、MDA 含量、抗氧化酶活性、抗氧化物质含量和渗透调节物质含量等生理指标的变化,以揭示BPA 胁迫对植物组合内各植物的影响,以及组合植物较单一植物在修复BPA 污染过程中潜在的生理优势。
1 材料与方法
1.1 试验材料
供试材料为采摘自河道两侧的芦苇、香蒲和荻幼芽,随后在实验室中培养1 个月。试验所用BPA 购自美国Sigma 公司,BPA 标准品购自国家标准网。
1.2 试验设计
按照全因素设计,设置芦苇(A0)、香蒲(B0)、荻(C0)、芦苇+香蒲(A1+B1)、芦苇+荻(A2+C1)、香蒲+荻(B2+C2)、芦苇+香蒲+荻(A3+B3+C3)7 种组合方式,并根据环境中的BPA 浓度0 ~25 mg·L-1,每组合设置0、15、30、45 μmol·L-14 个浓度梯度,如表1 所示。
选取长势均一的繁殖体栽入试验装置(试验装置为倒梯形圆柱形,高38 cm,底径27 cm,口直径30 cm,内部填装直径为1~2 cm 火山岩颗粒基质至装置高33 cm 处,出水管距基质底部2 cm)上层火山岩颗粒基质内,深度约为8 cm。向每个试验装置中注入10 L 霍格兰营养液(含945 mg·L-1四水硝酸钙、506 mg·L-1硝酸钾、80 mg·L-1硝酸铵、136 mg·L-1磷酸二氢钾、493 mg·L-1硫酸镁、2.5 mL·L-1铁盐溶液,其中铁盐溶液由2.78 g 七水硫酸亚铁、3.73 g 乙二胺四乙酸二钠,经蒸馏水定容至500 mL 配制而成),每2 d 排空装置内营养液,重新注入新鲜10 L 霍格兰营养液,培养1个月后,按照表1,每2 d 更换添加BPA 的10 L 霍格兰营养液进行处理,其中添加0 μmol·L-1BPA 处理的植物为对照组。每个处理3 次重复。于处理第10 天取材测定相关生理指标;分别在第8 天和第10 天取水样用于测定水中BPA 含量。

表1 BPA 胁迫多种植物及其组合Table 1 BPA stress in multiple plants and their combinations /株
1.3 测定项目与方法
1.3.1 水中BPA 含量的测定 BPA 浓度参考文献[34]采用高效液相色谱法测定,并稍作改动。每次取0.3 mL 水样,加入1.7 mL 70%乙腈溶解,过0.22 μm尼龙膜后注射进液相瓶中,并放入超低温冷冻冰箱进行冷冻保存,重复以上操作,直至各处理组均完成。测定条件:流动相乙腈﹕超纯水(60:40),色谱柱为C18反相柱(5 μm×40 cm,美国Waters 公司),检测波长217 nm,流速0.6 mL·min-1,进样量20 μL。每个样品重复测定3 次,根据BPA 标样保留时间和峰面积,计算各处理组水中的BPA 含量。
1.3.2 植株质量测定 将整个植株用去离子水清洗干净,用吸水纸吸干表面水分,将地上部和地下部分开,用万分之一天平称取鲜重,然后于105℃杀青30 min 后,80℃烘干至恒重,称干重。
1.3.3 光合色素、过氧化氢(H2O2)、MDA 含量 光合色素含量的测定采用无水乙醇浸提法[29],记录665 nm、649 nm 波长处的吸光度值并计算叶绿素a、总叶绿素含量。过氧化氢 ( H2O2)、丙二醛(malondialdehyde,MDA)含量采用试剂盒(南京建成生物工程研究所)测定,分别在405 nm(H2O2)、532 nm(MDA)波长处记录吸光度值,按照说明书中的公式计算H2O2和MDA 含量,结果以mmol·g-1prot 和nmol·mg-1prot 表示。
1.3.4 抗氧化酶活性以及抗氧化物质、渗透调节物质含量的测定 抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑法测定[30],反应液在荧光灯下反应30 min 后记录560 nm 波长处的吸光度值,以抑制氮蓝四唑光化还原的50%为一个酶活性单位;过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定[31],记录470 nm 波长处的吸光度值并计算酶活;过氧化氢酶(catalase,CAT)活性采用紫外分光光度法测定[32],记录240 nm 波长处的吸光度值并计算酶活; 抗氧化物质还原型谷胱甘肽(reduced glutathione,GSH)含量采用试剂盒(南京建成生物工程研究所)测定;渗透调节物质游离脯氨酸(proline,Pro)含量采用酸性茚三酮法测定[33],在520 nm 波长处记录吸光度值,并通过标准曲线计算Pro 含量。
1.4 数据分析
试验数据采用Excel 2019 统计,并使用Origin 2019b 软件绘图。使用SPSS 20.0 统计分析软件对试验数据进行分析,所有数据均以平均数±标准差表示,采用单因素方差方法(ANOVA) 分析显著性(P<0.05)。
2 结果与分析
2.1 BPA 在进水和出水中的含量
由图1 可知,BPA 浓度为15 μmol·L-1时,出水中BPA 含量在12.95~13.97 μmol·L-1之间;BPA 浓度为30 μmol·L-1时,出水中BPA 含量在25.70 ~26.79 μmol·L-1之间;BPA 浓度为45 μmol·L-1时,出水中BPA 含量在38.65~41.00 μmol·L-1之间,且各处理出水中BPA 含量差异不显著。因此保证了试验植物在一个恒定的BPA 含量环境中,其可使3 种不同物种及其组合表现出最佳的生理生化状态。

图1 BPA 在进水和出水中的含量Fig.1 The amount of BPA in and out of the water
2.2 BPA 对3 种不同物种及其组合的生物量的影响
由图2 可知,同一BPA 处理浓度下,A 组的各对照组(CK-A0、CK-A1、CK-A2、CK-A3)之间干重均无显著性差异(P<0.05),同样,B、C 组各对照组间也无显著性差异(P<0.05)。与CK-A0 相比,添加低剂量(15 μmol·L-1)BPA 的A 组干重均显著增加(P<0.05),B、C 两组的趋势一致,其中各组又以A1、B1、C1 增加最多,另外,A1、B1、C1 干重分别为相同处理浓度的A0、B0、C0 的1.08、1.20、1.06 倍,且除C 组外均达到显著差异(P<0.05)。添加高剂量(30和45 μmol·L-1) BPA 的A(除30 μmol·L-1BPA 处理的A1 外)、B、C 三组的干重均较各自对照组显著降低;但处理组中A1、B1、C1(除45 μmol·L-1BPA 处理)干重分别较相同处理浓度的A0、B0、C0 显著增加,分别最高达到1.08、1.23、1.18 倍。鲜重趋势相同,数据未列。
2.3 BPA 对3 种不同物种组合叶片叶绿素含量的影响
由图3 可知,正常生长条件下,植物组合有提高叶绿素含量的能力。随着添加BPA 浓度的增加,A、B、C 三组内各处理组的叶绿素a 和总叶绿素含量总体均呈降低趋势。其中,低剂量BPA 处理时,A0、B0、C0 的叶绿素a 含量和总叶绿素含量分别较其对照组(CK-A0、CK-C0、CK-B0)显著增加1.08 和1.10倍、1.08 和1.08 倍、1.07 和1.09 倍(P<0.05),而高剂量BPA 处理时,叶绿素a 和总叶绿素含量则显著降低(P<0.05)。但是,全浓度(0 ~45 μmol·L-1)BPA 处理组合内存在处理组叶绿素a 和总叶绿素含量高于较A0、B0、C0 的现象,其中A1、B1、C1 较A0、B0、C0 的叶绿素a 和总叶绿素含量显著增加,最高达到1.13 和1.15 倍、1.04 和1.13 倍、1.10 和1.16倍。
2.4 BPA 对3 种不同物种组合叶片H2O2 和MDA含量的影响

图2 BPA 对3 种不同物种及其组合地上干重的影响Fig.2 Effects of BPA on the dry weight of three different species and their combinations
由图4 可知,随着BPA 浓度的增加,3 种植物及其组合叶片中H2O2和MDA 含量也随之增加。低剂量BPA 处理时,A0、B0、C0 叶片的H2O2含量与其各自对照(CK-A0、CK-B0、CK-C0)均无显著差异(P>0.05);高剂量BPA 处理时,A0、B0(除30 μmol·L-1BPA 处理)、C0 均较其各自对照(CK-A0、CK-B0、CK-C0)显著增加(P<0.05)。全浓度(0 ~45 μmol·L-1)BPA 处理植物组合内存在处理组叶片H2O2和MDA 含量显著低于A0、B0、C0 的现象,组合植物处理的H2O2和MDA 含量较单一植物处理具有缓解趋势,其中A1、B1、C1 叶片的H2O2和MDA 含量较A0、B0、C0 缓解最高,分别为0.82 和0.87 倍、0.91 和0.88 倍、0.93 和0.88 倍。
2.5 BPA 对3 种不同物种组合叶片抗氧化酶活性的影响
由图5 可知,随着BPA 浓度的增加,A、B、C 三组处理组叶片的SOD、POD、CAT 活性均呈增加趋势,其中各BPA 浓度处理组中A0、B0、C0 叶片的SOD、POD、CAT 活性分别较CK-A0、CK-B0、CK-C0 显著增加(P<0.05)。但是植物组合A1、B1、C1 进一步显著增加了叶片的SOD、POD、CAT 活性,其中同一BPA 处理浓度下,A1、B1、C1 的SOD 最多增加为A0、B0、C0的1.07、1.09、1.19 倍,POD 活性最多增加为1.13、1.08、1.23 倍,CAT 活性最多增加为1.30、1.17、1.10倍。
2.6 BPA 对3 种不同物种组合叶片抗氧化物质和渗透调节物质含量的影响
由图6 可知,随着BPA 浓度的增加,A、B、C 三组处理组的GSH 和Pro 含量也均呈增加趋势,其中各BPA 浓度处理组A0、B0、C0 的GSH 和Pro 含量分别较CK-A0、CK-B0、CK-C0 显著增加(P<0.05),而植物组合后的处理组中A1、B1、C1 的GSH 和Pro 含量分别较同一BPA 处理浓度的A0、B0、C0 进一步显著增加(除45 μmol·L-1处理A 组的Pro 含量),最高分别为相应A0、B0、C0 的1.19 和1.09 倍、1.25 和1.16 倍、1.36 和1.12 倍。

图4 BPA 对3 种植物及其组合叶片H2O2 和MDA 含量的影响Fig.4 Effects of BPA on H2O2 and MDA content in leaves of three plants and their combinations

图5 BPA 处理对3 种植物及其组合叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性的影响Fig.5 Effects of BPA treatment on SOD,POD and CAT activity in leaves of three plants and their combinations
3 讨论
3.1 BPA 在进出水中的含量和对3 种不同物种及其组合的生长影响
经过连续更换BPA 处理液,7 种植物组合经BPA处理后的出水BPA 含量虽然有波动,但无显著差异,所以这种波动可忽略不计[35]。因此,添加BPA 培养10 d 进行测定时,结果显示BPA 对植物的影响达到了稳定状态。
研究表明,BPA 胁迫可以影响植物的株高、茎和叶的生物量、叶面积等[36-38]。本研究结果显示,A、B、C 三组内处理组中单一物种的鲜重和干重,在0 ~45 μmol·L-1BPA 胁迫下表现出低促高抑的现象。这种现象与Qiu 等[38]和Kim 等[39]的研究结果类似。这可能是因为低剂量(15 μmol·L-1)的BPA 具有类似细胞分裂素的作用,可以诱导细胞的伸长和增殖,从而促进植物地上部器官生物量的积累,而高剂量的BPA 可使根中吲哚-3-乙酸和玉米蛋白减少、脱落酸(abscisic acid,ABA)含量升高;并导致叶片中IAA 含量降低,ABA 和乙烯(ethylene,ETH)水平升高,从而抑制根和叶的生长[37,40]。
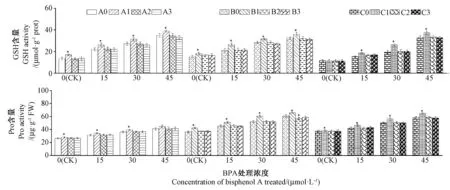
图6 BPA 处理对3 种植物及其组合叶片还原型谷胱甘肽(GSH)、脯氨酸(Pro)含量的影响Fig.6 Effects of BPA treatment on reduced glutathione (GSH) and proline (Pro) contents in leaves of three plants and their combinations
植物的多样性不仅与生产力存在正相关关系,且能增加地上部生物量,并增强对干旱、铵态氮等胁迫的抵抗力[27,41]。本研究中,随着BPA 浓度的增加,芦苇+香蒲组合中的芦苇、香蒲以及芦苇+荻组合中的荻较同种单一物种的地上生物量(鲜重/干重)增加最为显著。可见,植物组合可以减轻BPA 对植物的毒害作用。这可能是因为植物组合后,植物的多样性使植物物种之间产生了生态位分化,或物种间产生了互相促进的作用[33,42-43]。
3.2 BPA 对3 种不同物种组合叶片叶绿素含量的影响
植物光合作用对植物体的有机物积累和生长有促进作用,因此,当光合系统受到环境污染物的破坏或改变时,会影响植物的正常生长[44]。本研究中,随着BPA 胁迫浓度的增加,A、B、C 三组内单一植物处理组植物的光合色素含量呈现低促高抑现象。这可能是因为低浓度BPA 增加了叶绿素合成过程中关键酶的活性,导致其合成速率加快,进而提高了叶绿素的含量[13,32];而高浓度BPA 可诱导活性氧(reactive oxygen species,ROS)的生成,进一步破坏叶绿体膜,同时使参与光合作用的mRNA 下调,抑制叶绿体蛋白的表达,从而导致叶绿素含量降低[45-46]。有研究表明,增加植物物种的丰富度可以提高生物生产力,同时增强对复杂养分和污染物的吸收[47-48]。本研究中,BPA 胁迫下A、B、C 三组内存在植物组合较单一植物显著提高植物光合色素含量的现象,可能是因为植物组合较单一植物提升了植物物种的丰富度,从而加快了植物对BPA 的吸收和降解,同时减缓了光合色素的降解,促进了光合色素的合成。因此,植物组合具有缓解BPA 胁迫所导致的植物光合色素降解现象的潜能,从而减缓BPA 对植物光合色素的破坏,降低BPA 对植物生长的影响。
3.3 BPA 对3 种不同物种组合叶片H2O2 和MDA含量的影响
植物在正常生长环境下,体内ROS 的产生和清除保持着动态平衡。但环境胁迫可导致ROS 代谢紊乱,当ROS 积累到超过植物抗氧化清除能力的程度,会在叶绿体、质膜、线粒体和过氧化物酶体中产生氧化应激[49-50],引起植物细胞膜脂质过氧化损伤[51]。其中,H2O2是ROS 的重要代表物质,MDA 是膜脂质过氧化损伤的重要代表产物[49-51]。本研究中,低剂量的BPA使A、B、C 三组内单一物种处理组的H2O2含量较其相应对照组无明显变化,B 组内单一物种处理组的MDA含量较其对照组也无明显变化。这可能是因为低剂量BPA 诱导产生的ROS 具有降解少量BPA 的能力[52]。但高剂量BPA 处理的A、B(除30 μmol·L-1BPA 处理的H2O2含量)、C 三组内,单一物种处理组的H2O2和MDA 含量较其对照组却显著增加,这是因为BPA 胁迫可以诱导植物细胞产生氧化应激,从而使H2O2和MDA 含量增加,加剧植物氧化损伤[53-54]。植物组合后,随着BPA 浓度的升高,芦苇+香蒲组合中的芦苇、香蒲及芦苇+荻组合中的荻较同种单一物种处理组的H2O2和MDA 含量相比,表现为无明显变化或显著降低。可能是植物进行组合后,加强了BPA 的降解转化,减少了BPA 对细胞的毒性[21,55-56],从而减缓H2O2、MDA 的积累,进而减轻植物本身的氧化损伤,增强植物本身耐BPA 胁迫能力。
3.4 BPA 对3 种不同物种组合叶片抗氧化酶的影响
在进化过程中,植物形成一种保护性抗氧化系统(包括抗氧化酶系统和抗氧化物质)来处理这种外部胁迫产生的ROS,即植物通过维持较高的抗氧化酶活性以及非酶抗氧化剂的浓度来响应氧化应激[57]。SOD 是一种主要的超氧化物自由基清除剂,可催化超氧化物转化为O2和H2O2,而H2O2可通过CAT 和POD 的作用进一步降解[40,58]。本研究中,A、B、C 三组内单一植物在处理组的SOD、POD、CAT 活性较其对照组显著增加,表明植物为了清除BPA 胁迫条件下产生的过量ROS,启动了抗氧化系统,提高了抗氧化酶活性。然而进行植物组合后,A、B、C 三组内存在植物组合处理组的SOD、POD、CAT 活性较单一植物处理组进一步增强的现象。这是因为,植物进行组合有可能通过提高抗氧化酶的表达,增强清除ROS 的能力,进一步将残留的BPA 降解为醌[20],增加了植物对BPA的耐受力。
3.5 BPA 对3 种不同物种组合叶片抗氧化物质和渗透调节物质含量的影响
GSH 作为植物体主要的抗氧化物质,通过自身氧化为氧化型谷胱甘肽去除ROS,是自由基清除系统的重要组成部分[33]。游离Pro 能够调控和维持植物细胞的渗透势,协调细胞内代谢过程,提高植株耐BPA胁迫能力[59]。本研究中,A、B、C 三组内单一植物在处理组的GSH 和Pro 含量较其对照组显著增加,表明植物本身抗氧化系统已被激活。然而进行植物组合后,存在植物组合处理组的GSH 和Pro 含量较单一植物处理组显著提高的现象,表明植物进行组合可以增强植物叶片的ROS 清除能力和渗透调节能力,从而减轻氧化应激损伤,提高植物耐BPA 胁迫能力。
4 结论
低剂量(15 μmol·L-1)的BPA 可以促进3 种植物及其组合的鲜重、干重、光合色素含量、抗氧化酶活性、抗氧化物质含量和渗透调节物质含量。高剂量(30 和45 μmol·L-1)BPA 胁迫下,芦苇、香蒲、荻单一植物处理组会产生氧化应激反应,从而降低光合色素含量,提高H2O2活性氧积累量、SOD、POD、CAT 活性、MDA 含量、GSH 含量和Pro 含量。进行植物组合可以有效地增加组合内同种植物的光合色素含量,降低H2O2和MDA 含量,并通过进一步提高抗氧化酶活性、抗氧化物质含量和渗透调节物质含量来增强组内植物抗BPA 胁迫的能力,缓解BPA 胁迫带来的氧化损伤,从而促进植物的生长,其中最优植物组合为芦苇和香蒲,其次为芦苇和荻。
