结球甘蓝BoFBX117基因的克隆与表达分析
2021-04-19鲁正钊夏冬健姜书涵宋江华
许 涛 鲁正钊 夏冬健 万 菁 姜书涵 宋江华
(安徽农业大学园艺学院,安徽 合肥 230036)
结球甘蓝(Brassica oleraceavar.capitataL.)属于十字花科芸薹属,又称甘蓝、包菜等,是在全国各地广泛栽培并可周年供应的重要蔬菜作物之一[1-2]。近年来,由于甘蓝种植区已扩大到北方保护地,生产上对耐低温的品种需求逐渐提高[3-4]。而目前耐寒甘蓝材料的筛选主要以人工在低温条件下筛选,该方法易受环境影响,选择效率较低,给生产带来巨大的损失,因而开展甘蓝耐寒基因的鉴定及标记其连锁分子的辅助选择,将大大提高耐寒甘蓝的育种效率[5-6]。
F-box 基因家族是植物中最大的基因家族之一,根据其蛋白C 末端结构域的不同被划分为不同的亚家族[7-9]。F-box基因编码的蛋白能够调节多种多样的生命活动,如延缓植物衰老、调控植物开花以及响应生物胁迫、低温和干旱等逆境胁迫[9-11]。潘樱等[12]研究发现,F-box基因BlAFB2 可能在光皮桦(Betula luminifera)低氮胁迫响应中发挥调控功能。尹恒等[13]成功从谷子中克隆到与早期耐旱响应相关的F-box基因SiFBX。Liu 等[14]克隆了2 个F-box基因,发现其为sy-2 候选基因,可能与辣椒(Capsicum annuum)的温敏性密切相关。Song 等[15]在苜蓿(Medicago sativa)中发现了部分F-box基因表达响应热胁迫诱导。然而,关于F-box基因参与甘蓝对温度胁迫抗逆反应方面的研究却鲜有报道。
本研究从结球甘蓝中克隆了BoFBX117 基因cDNA 全长,分析结球甘蓝BoFPB7 序列特征及BoFBX117 基因在低温胁迫下的表达模式,以期为进一步研究BoFBX117 基因在结球甘蓝耐寒性调节方面的功能及作用机制奠定基础。
1 材料与方法
1.1 材料
以结球甘蓝BoJF-16-1(JF)为试验材料,用于克隆基因及分析基因在不同组织器官中的表达。以耐低温品种BoZG-16-1(ZG)和低温敏感品种BoYC-16-1(YC)为低温胁迫处理的试验材料。试验材料均来自安徽农业大学园艺植物育种工程实验室。
1.2 试验方法
1.2.1 低温胁迫处理和取材 结球甘蓝3 个品种分别采用穴盘育苗培养,培养条件为12~16℃,光照时间为16 h/8 h(光照/黑暗)。对JF 品种的幼叶和莲座期叶片、根、茎分别取样,用于组织器官表达试验。对ZG和YC 品种进行低温处理,当植株长至6~7 片真叶时,将处理温度设为4、2、0、-2℃,处理6、12、24 h 分别取叶片为样品。以未处理(0 h)常规培养的ZG 和YC 植株叶片作为对照组(CK)。将样品包裹在锡箔纸内,迅速置于液氮中并储存于-80℃冰箱备用。
1.2.2 结球甘蓝BoFBX117 基因克隆 本研究前期已完成对结球甘蓝F-box基因家族的鉴定,从中筛选出一个可能与低温胁迫相关的基因BoFBX117。利用Primer Premier 5.0 设计全长引物,上 游 引物BoFBX117-F 为:ATGACTTCAGATGCTCTCAA,下游引物BoFBX117-R:TCAACTTGCCTCTTCGAACG。样品总RNA 提取采用TRIzol 法根据RNA 快速提取试剂盒(成都百菲特科技有限公司)操作进行,并按照反转录试剂盒(东洋纺生物科技有限公司)操作步骤合成双链cDNA。以cDNA 为模板进行PCR 扩增,反应程序:94℃预变性30 s,98℃变性10 s,53℃退火30 s,72℃延伸1 min,72℃终延伸2 min,30 次循环。反应体系(50 μL):2×Accurate Tap Master Mix 酶26 μL,cDNA 模板4 μL,上、下游引物各1 μL,补足ddH2O 18 μL。采用1%琼脂糖凝胶进行电泳,使用DNA 凝胶回收试剂盒(湖南艾科瑞生物工程有限公司)回收扩增产物,并与克隆载体pMD19-T 连接。得到的连接产物转化至大肠杆菌感受态细胞DH5α,挑取单菌落培养,获得重组体,用质粒DNA 提取试剂盒(湖南艾科瑞生物工程有限公司)提取质粒并进行质粒PCR 鉴定,鉴定正确后的阳性菌液送北京擎科生物有限公司测序。
1.2.3 结球甘蓝BoFBX117 基因序列分析 将测序得到的基因序列与BrassicaDatabase ( http:/ /brassicadb.org/brad/)网站中下载的序列进行比对;利用在线软件 ProtParam ( https:/ /web. expasy. org/protparam/)分析BoFBX117 基因编码蛋白质的氨基酸组成和蛋白质理化性质;利用DNAMAN 软件进行蛋白质的多序列比对,并通过MEGA6.0 进行蛋白质系统发育进化树的构建。
1.2.4 结球甘蓝BoFBX117 基因表达分析 通过实时荧光定量PCR(quantitative real-time PCR,RTqPCR)检测BoFBX117 在结球甘蓝JF 不同组织器官中的表达情况;检测分析ZG、YC 随着处理温度的不同(4、2、0、-2℃,处理时间为24 h)以及在4℃条件下不同处理时间(0、6、12、24 h)该基因的表达量差异。以GAPDH为内参基因,按照qPCR 引物设计原则设计引物,上游引物BoFBX117-F:CACAAGCAGTAAACCACA GTTC,下游引物BoFBX117-R:TGCTCTGCCAAGGTCA TAAG;上游引物GAPDH-F: GCTAACTGCCTTGCTCCA CTT,下游引物GAPDH-R:CGGCTCTTCCACCTCTCCAG T。
以结球甘蓝低温处理叶片cDNA 为模板,进行RT-qPCR 表达差异分析。20 μL 反应体系如下:10 μL KOD SYBR qPCR Mix、1 μL Forward Primer、1 μL Reverse Primer、2 μL cDNA 溶液(已稀释)、6 μL ddH2O。RT-qPCR 反应程序:98℃预变性,2 min;98℃变性,10 s;55℃退火,10 s;72℃延伸,1 min;循环40次。循环结束后从55℃上升至95℃,每10 s 上升0.5℃,绘制融解曲线,以检测引物扩增的特异性。采用2-ΔΔCt法计算各样品基因表达量。
1.2.5 数据统计与分析 采用Origin 8.0 和SPSS 17.0 统计软件对试验数据进行统计分析并作图,用Duncan 新复极差法进行方差分析(P<0.05)。
2 结果与分析
2.1 结球甘蓝BoFBX117 基因克隆
以结球甘蓝JF 叶片cDNA 为模板,利用RT-PCR技术克隆获得了大小为936 bp 的条带(图1)。经测序验证后,获得了目的基因的cDNA 全长。该基因位于结球甘蓝5 号染色体上,命名为BoFBX117。GenBank 登录号为XM_013731217.1。

图1 BoFBX117 PCR 扩增电泳Fig.1 BoFBX117 PCR amplification electrophoresis
2.2 BoFBX117 编码蛋白的序列特征
BoFBX117 基因编码311 个氨基酸(图2),在第58~第105 氨基酸之间存在一个F-box 保守结构域,属于F-box 蛋白家族。该氨基酸序列与已登录的其他植物的FBP7 相似性较高,命名为BoFBP7。利用ProtParam 在线工具对BoFBP7 蛋白的理化性质预测分析,结果表明,化学式为C1620H2521N451O451S11,不稳定指数为51.01,大于40,属于不稳定蛋白[16]。分析BoFBP7 蛋白序列可知,氨基酸残基含量最高的是Arg(R),占比9.6%;Lev(L)和Val(V)含量其次,依次分别为9.0%和7.7%,Cys(C)含量最低,占比为1.3%,预测编码蛋白的分子量为30.14 kDa,理论等电点为9.71。

图2 BoFBX117 基因序列及其编码的蛋白质氨基酸序列Fig.2 The BoFBX117 gene sequence and its amino acid sequence
2.3 结球甘蓝BoFBX117 同源性与系统进化分析
利用NCBI BLAST 检索得到其他植物已知的FBP7 蛋白与结球甘蓝BoFBX117 所编码BoFBP7 蛋白的氨基酸序列。BLAST 比对结果显示,BoFBX117所编码蛋白BoFBP7 与同属的芜菁(Brassica rapa)(RID58279.1)FBP7 蛋白亲缘关系最近,同源性高达99.36%。与同科的萝卜(Raphanus sativus) (XP _018437435.1)、山嵛菜(Eutrema salsugineum) (XP_006416265.2、)、拟南芥(Arabidopsis thaliana) (NP_564150.1)的FBP7 蛋白亲缘关系也较近,分别为98.39%、96.13%和92.26%。利用DNAMAN 软件对包括结球甘蓝BoFBP7 蛋白在内的13 种植物进行序列多重比对分析,发现不同植物的FBP7 之间具有较高的一致性,其一致性达到85.40%(图3)。系统进化树分析结果发现13 个物种的FBP7 蛋白分为三大分支,包括结球甘蓝在内的10 种植物为一个分支,其中结球甘蓝BoFBP7 与同属的芜菁FBP7 蛋白亲缘关系最近,属于同一分支(图4)。
2.4 结球甘蓝BoFBX117 基因的表达分析

图3 结球甘蓝BoFBP7 同源蛋白的多重比对分析Fig.3 Multiple comparative analysis of BoFBP7 homologous proteins in Brassica oleracea
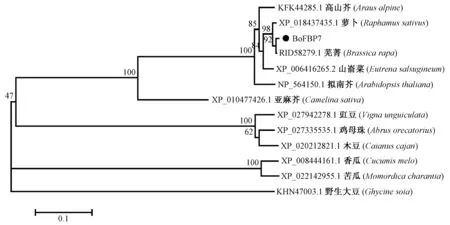
图4 结球甘蓝BoFBP7 蛋白系统进化树分析Fig.4 Phylogenetic tree analysis of BoFBP7 in Brassica oleracea
2.4.1BoFBX117 基因在不同组织中的表达 利用RT-qPCR 对BoFBX117 基因在结球甘蓝JF 不同组织中表达进行分析。结果表明,BoFBX117 基因的表达具有显著的组织特异性,其在莲座叶中的表达量最高,是幼叶中表达量的7.3 倍;根中的表达量次之,是幼叶中表达量的7.2 倍;其次是茎,是幼叶中表达量的3.3倍;而在幼叶中表达量最低(图5)。
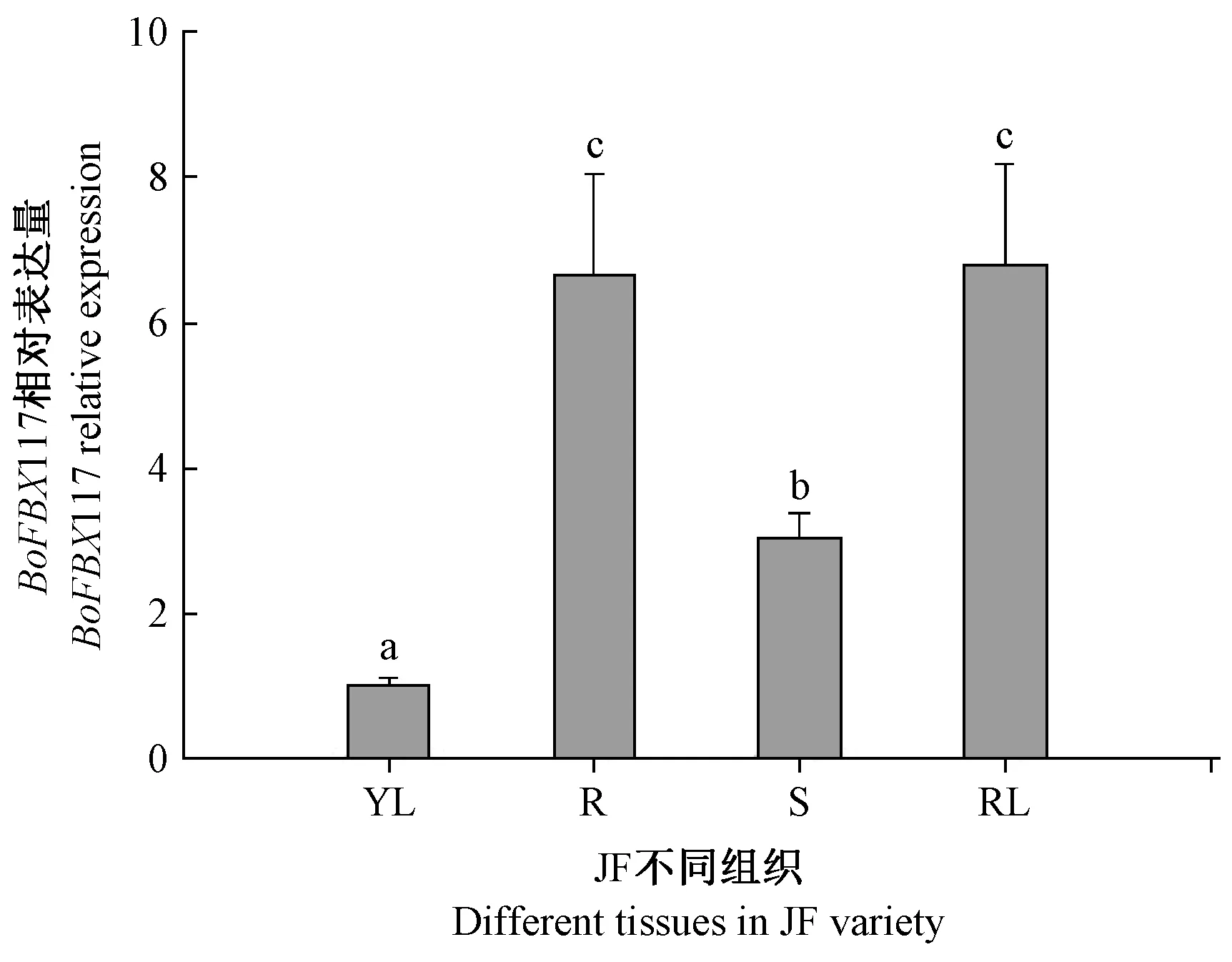
图5 BoFBX117 基因在不同组织器官中的表达Fig.5 Expression of BoFBX117 gene in different tissues and organs
2.4.2BoFBX117 基因低温处理的表达模式分析为研究BoFBX117 基因在低温胁迫条件下的表达特性,采用不同低温和不同时间对结球甘蓝幼苗进行处理,并对BoFBX117 基因的表达情况进行分析(图6)。在不同低温处理下,BoFBX117 在品种YC 中的相对表达量随温度降低逐步增加,在-2℃达到最大值,其表达量是对照组的4 倍。品种ZG 除2℃处理外,其余处理表达量均显著升高,在0℃达到最大值,是CK 表达量的19.2 倍。对比分析两品种,在CK 和-2℃处理中,ZG 的表达量显著低于YC;而在4℃和0℃处理中,ZG 表达量显著高于YC。结果表明,结球甘蓝BoFBX117 基因的表达受低温胁迫的诱导,随着温度降低BoFBX117 基因的表达量总体呈上升趋势。
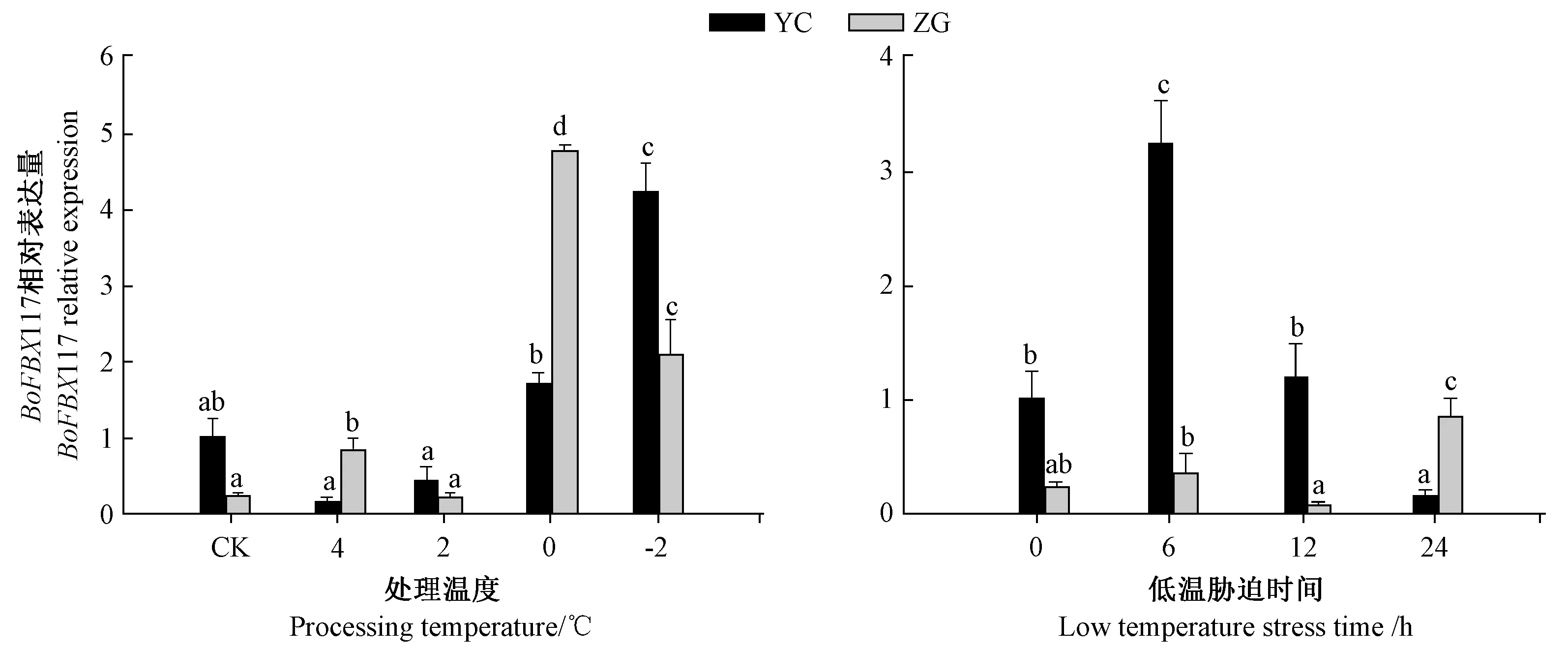
图6 BoFBX117 基因在低温胁迫处理下的表达Fig.6 Relative expression of BoFBX117 gene under low temperature
在不同胁迫时间下,品种YC 中BoFBX117 的相对表达量先增后减,在胁迫6 h 最高,是CK 表达量的3.6 倍,胁迫12 h 时表达量是CK 的1.2 倍,而胁迫24 h 时表达量较CK 下降了84%。在品种ZG 中,除胁迫12 h 基因相对表达量较CK 有所下降外,其他处理组相对表达量逐步上升,并在胁迫24 h 达到最高,是CK的3 倍。将两品种对比分析时,YC 在胁迫6、12 h 条件下,表达量均高于ZG,而处理24 h 时,表达量显著低于ZG。结果表明,该基因在耐胁迫品种和低温敏感品种中存在表达差异,而在这两个品种中的表达差异反映该基因与结球甘蓝不同品种耐寒性强弱可能有密切联系。
3 讨论
在自然条件下,植物的生长会受到内部或外部的胁迫刺激,面对这些胁迫,生物体已经进化出多种调节机制来协调其生命活动,其中F-box 蛋白酶体途径是最重要的生物调节体系之一[9,17-18]。本研究应用RTPCR 技术克隆得到BoFBX117 基因的cDNA 全长为936 bp,编码311 个氨基酸,分子量为30.14 kDa,理论等电点为9.71。该基因编码的BoFBP7 蛋白在N 端含有典型的F-box 结构域,属于F-box 蛋白家族,这种结构域通常介导蛋白质-蛋白质相互作用,其保守序列较少,仅有几个位置的氨基酸残基比较保守[19-20]。此外,结球甘蓝BoFBP7 蛋白与同属芜菁的FBP7 亲缘关系最近,同源性达到99.36%。与同科的拟南芥AtFBP7 同源性也高达92.26%,这表明结球甘蓝BoFBX117 所编码FBP7 蛋白与其他植物的FBP7 蛋白有密切的遗传关系。据报道,拟南芥AtFBP7 是响应温度胁迫的F-box 蛋白,在寒冷和高温条件下,该蛋白表达量变化明显[21]。推测,结球甘蓝BoFBP7 蛋白可能也发挥着相似的生物学功能。
已有关于F-box基因参与拟南芥、番茄(Solanum lycopersicum)和小麦(Triticum aestivum)等植物非生物胁迫调控的研究报道。小麦中F-box基因TaFBA1 能够响应多种非生物胁迫[22-24],能在植物不同器官中调控多个靶位点来优化植物生长发育。在干旱、氧化及盐胁迫条件下,超表达TaFBA1 的转基因烟草生长发育情况优于野生型。在拟南芥中MAX2 是一种多功能的F-box 蛋白,它不仅在多种信号传导中起调节作用,还能调控光形态发生、响应生物及非生物胁迫[25-27]。但在结球甘蓝中相关的研究还非常有限。本研究对BoFBX117 基因在低温胁迫诱导下表达情况进行了分析,发现该基因响应低温胁迫诱导,这为进一步了解该基因在响应结球甘蓝非生物胁迫中所发挥的作用奠定了一定的基础。
研究发现,F-box基因在植物叶片发育中起作用。Baute 等[28]研究发现,玉米(Zea mays)F-box基因ZmFBX92 在拟南芥中异位表达能够导致拟南芥的叶片增大,而拟南芥中同源基因AtFBX92 超表达后,则观察到相反的作用,推测可能与F-box 蛋白FBX92 影响细胞分裂导致细胞数量不同有关。Liu 等[29]研究发现,番茄中F-box基因SlGID2 的转基因株系叶片细胞更小更紧凑,而当其沉默后植株便出现矮化。本研究中,BoFBX117 基因在结球甘蓝JF 幼叶和莲座叶中的相对表达量存在显著差异,推测在植株的生长过程中,结球甘蓝BoFBX117 基因可能在调控叶片细胞分裂数量和大小方面发挥重要功能。
已有研究结果表明,低温胁迫会诱导F-box基因的表达。据报道,辣椒(Capsicum annuum)F-box基因CaF-box受低温胁迫诱导[30]。对杂草稻和栽培水稻低温处理时发现,F-box基因OsF-BOX28 被诱导表达[31];Wang 等[32]研究发现拟南芥F-box 蛋白CPR1与UBC13 相互作用以响应低温胁迫。本研究中,结球甘蓝BoFBX117 基因受低温诱导,表达量随处理温度的降低而呈现上升趋势,且在耐低温品种和低温敏感品种中表达量存在显著差异,暗示BoFBX117 基因可能在结球甘蓝耐寒机制中具有重要功能,这将为后续结球甘蓝耐寒生理及分子机制研究提供线索和思路。
4 结论
本研究应用RT-PCR 技术克隆得到BoFBX117 基因cDNA,全长为936 bp,编码311 个氨基酸,属于Fbox 蛋白家族,该基因在结球甘蓝莲座叶中的表达量最高,根次之,在幼叶中的表达量最低,表现出明显的组织特异性,且受低温胁迫诱导表达,说明该基因可能参与植株抵御低温胁迫的过程。本研究结果为进一步研究F-box基因在结球甘蓝抵御低温胁迫中的调控机制奠定了基础,为抗逆品种筛选及提高结球甘蓝等作物对低温胁迫的适应能力提供了思路和方向。
