敲低程序性死亡配体1抑制人乳腺癌细胞生长与转移
2021-04-17陆丽峰周雷升刘跃贞陈鹏业
陆丽峰,周雷升,刘跃贞,陈鹏业
在过去的几十年中,通过研究已经确定了涉及乳腺癌发生和转移进展的分子改变,从而使得乳腺癌的治疗取了里程碑式的进展,如靶向雌激素受体(ER)的激素疗法和针对致癌蛋白(ERBB2,EGFR,VEGF和PI3K/AKT/mTOR途径)的靶向疗法。然而,由于癌细胞的高诱变性和适应能力,在大多数情况下出现抗性克隆,使得肿瘤反应仅暂时出现。由于免疫反应的适应性,癌症免疫疗法理论上可以解决这个问题[1]。但乳腺癌的免疫原性低于黑色素瘤或肾细胞癌,这使得过继免疫治疗(白细胞介2,干扰素和疫苗)的结果一直不理想。但在过去十年中出现了免疫的作用证明了肿瘤浸润淋巴细胞(TILs)存在的良好预后影响及免疫应答的基因表达特征。
免疫反应代表一种复杂现象,其基于调节TIL活性的激活剂和抑制剂途径之间的平衡。这种平衡可能在某些病理条件下受到干扰,例如癌症,其中免疫系统的抑制将有利于肿瘤进展[2]。一种关键的抑制剂是程序性细胞死亡1(PD1)-程序性死亡配体1(PDL1)途径。实际上,有来自不同部位的肿瘤细胞表达PDL1,因此可以抑制免疫应答。目前已经在不同的癌症中研究了PDL1的表达,如肾、肺、胰腺、食管、卵巢、结肠直肠、头颈部和鳞状细胞癌、黑素瘤和神经胶质瘤[3-5],表明了与临床病理学肿瘤特征相关。在乳腺癌中,PD1-PDL1途径的研究非常少。本研究采用MTT、划痕实验及Taswell侵袭实验检测PDL1在乳腺癌MDA-MB-231细胞中的生物学行为,为乳腺癌的靶向治疗提供实验依据。
1 材料与方法
1.1 材料、设备来源 研究材料主要包括正常状态下的乳腺细胞系及癌细胞系,实验材料与实验过程所需相关硬件设备、试验耗材均于美国购回。
1.2 qRT-PCR检测PDL1的表达 为实现PDL1的准确表达,研究过程中,研究人员借助于RNA抽提试剂对研究过程中涉及到的3种细胞分别进行RNA的提取。在整个研究过程中,为保证提取的有效性,将提取试剂盒保存在-70 ℃环境内。同时研究人员好需要对循环体系、扩增反应体系进行梳理、完善及优化,在明确循环体系、循环梳理的基础上,对循环的温度要素等进行控制,确保检测结果的有效性。
1.3 MTT实验 实验过程中,培养的乳腺癌细胞,按照相关操作说明进行转染处理,为后续研究活动的开展提供参考借鉴,确保研究活动的有效性。为保证实验的准确性,降低实验误差,将转染后的细胞放置于孔板之中,每个组别设置5个复孔,并通过霉菌液进行饱和处理,饱和处理过程中,使用设备仪器进行低速震荡处理,震荡周期控制在10 min,震荡后的实验对象使用检测仪器进行指标测定,并记录测定结果,采用重复实验的方式,排除误差。
1.4 划痕实验 细胞培养与分组同MTT实验。将细胞接种于6孔板中培养,待长至临近饱合,用PBS缓冲液将板中细胞洗涤2遍,用无菌10 μl Eppendorf Tip在细胞板上划痕。倒置显微镜下分别观察各组细胞0 h,48 h的划痕距离,并摄像。软件测量各孔细胞任意3个部位的不同划痕距离,计算各组伤口愈合率,计数3组实验的平均值,并进行统计分析。
1.5 Transwell侵袭实验 在进行侵袭实验过程中,借助于Transwell等设备,对实验条件、实验场景等主要参数进行调控。在实际的操作环节,研究人员将已经根据实验需求稀释好的基质胶放置到Transwell小室,并静置一段时间。静置完成后,选择100 μl细胞稀释液,放入到Transwell上层,在下层放入一定体量、一定浓度的细胞培养液,并将整个实验的温度控制在37 ℃,保温36 h,在完成上述操作后,随机选择上层未发生迁移的细胞作为观察对象,使用光学显微镜等设备进行观察,并进行记录,为保证观察结果的准确性,可以进行重复实验,并开展数据分析。
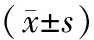
2 结 果
2.1 人乳腺癌细胞中PDL1表达水平的检测 从整个研究的结果来看,人乳腺细胞系表的PDL1表达与正常细胞系的相关表达水平之间的差异较为明显,分别为4.615-5.743、0.733-0.831,差异有统计学意义(t=235.878,264.906,P<0.01)。
2.2 敲低PDL1对人乳腺癌MDA-MB-231细胞增殖的影响 MTT结果显示,在人乳腺癌MDA-MB-231细胞中,转染si-PDL1组的OD值为(0.514±0.007),与si-control组(0.762±0.012)相比,差异有统计学意义(t=174.908,P<0.05)。提示在人乳腺癌MDA-MB-231细胞干扰PDL1后能抑制癌细胞的增殖。
2.3 敲低PDL1对人乳腺癌MDA-MB-231细胞迁移的影响 划痕实验结果显示,si-PDL1组48 h后伤口愈合率分别为(56.2±7.4)%,与si-control组(74.8±8.6)%相比,差异具有统计学意义(t=16.063,P<0.05)。提示在人乳腺癌MDA-MB-231细胞干扰PDL1后能抑制癌细胞的迁移。
2.4 敲低PDL1对人乳腺癌MDA-MB-231细胞侵袭的影响 Transwell结果显示,si-PDL1组穿过基质胶的人乳腺癌MDA-MB-231细胞数量为(105±9)与si-control组(196±15)相比,差异有统计学意义(t=50.970,P<0.05)。提示在人乳腺癌MDA-MB-231细胞干扰PDL1后能抑制癌细胞的侵袭。
3 讨 论
研究显示,与其他癌症相比,乳腺癌中出现了免疫的重要性。一些免疫应答相关变量对乳腺癌患者的生存和化疗反应具有良好的预测影响[6]。免疫反应是激活剂和抑制剂途径之间平衡的复杂现象。癌细胞可以维持有利于肿瘤进展的免疫抑制微环境。PD1受体—配体相互作用是主要的抑制剂途径。PD1是由包括T细胞在内的各种免疫细胞表达的细胞表面膜蛋白质。它被其配体PDL1和PDL2激活,其由抗原呈递细胞如巨噬细胞或B细胞表达。PDL1或CD274是PD1的配体之一,在许多癌症和免疫细胞如抗原呈递细胞的表面表达。它与PD1的结合抑制了T细胞迁移,细胞毒性介质的增殖和分泌,以及限制肿瘤细胞杀伤[7]。PD1在与其配体结合后,PD1能减弱淋巴细胞活化并促进T-调节细胞发育和功能,从而终止免疫应答。最近,通过对抗癌免疫反应抑制的研究发现PD1可能成为癌症进展的主要参与者[7]。PDL1在许多不同的癌症中上调,阻断PDL1增强抗癌免疫能力。目前临床试验测试通过抗PD1或抗PDL1药物以恢复抗癌免疫力并具有持久的反应,结果较为理想,特别是在黑素瘤和肾、肺、前列腺、膀胱癌中,并且Ⅲ期研究正在进行中[8-12]。目前研究已证明肿瘤和(或)浸润性免疫细胞的PDL1表达与治疗反应具有相关性[13-15]。
为系统、全面掌握乳腺癌细胞的PDL1表达特性,在研究过程中,设计了相关研究与实验,以测定其具体的细胞表达方式,整个研究更为具体、更为直观。通过MTT实验发现在人乳腺癌MDA-MB-231细胞中干扰PDL1后,细胞的增殖能力明显减弱。划痕实验与Transwell实验结果显示在人乳腺癌MDA-MB-231细胞中干扰PDL1后,细胞的迁移与侵袭能力亦明显被抑制。目前,PDL1在乳腺癌中的分子调控机制研究还处于起始阶段,继续深入PDL1在乳腺癌中的研究,将为乳腺癌潜在治疗靶点的挖掘提供新的思路。
