人肝细胞癌中OY-TES-1和PKM2的表达及调控关系初探*
2021-04-17李晓莹葛盈盈薛春红张庆梅谢小薰
徐 涛 ,刘 畅,李晓莹,陈 芳,葛盈盈,3,薛春红,李 鑫,张庆梅,3,谢小薰,3,罗 彬,3△
(广西医科大学 1.基础医学院组织学与胚胎学教研室;3.基础医学院基础医学中心实验室,南宁 530021;2.广西医科大学第一附属医院神经外科,南宁 530021)
原发性肝癌是常见的恶性肿瘤之一,其90%以上为肝细胞癌(hepatocellular carcinoma,HCC)[1-2]。目前,手术切除、放疗和化疗是治疗HCC 的主要手段,由于术后残余病灶复发、放化疗抵抗,患者预后效果依旧不理想[3-4],因此迫切需要探索新的辅助治疗方法。近年来,基因靶向治疗和免疫治疗等显示出良好的应用前景,但治疗靶点的选择及其功能机制仍需进一步探索。
癌-睾丸抗原(cancer-testis antigen,CTA)是一类在多种肿瘤组织中表达,在除睾丸以外的正常组织中几乎不表达的肿瘤相关抗原,因而被认为是肿瘤免疫治疗的理想靶点[5]。OY-TES-1 是CTA 家族成员之一,又称顶体素结合蛋白(acrosin binding protein,ACRBP)[6]。前期研究发现,OY-TES-1于包括HCC在内的多种肿瘤中高表达,其表达与患者的预后不良相关[7]。在HCC 细胞株中干扰OY-TES-1表达,能够抑制细胞增殖、迁移和侵袭能力,导致细胞周期阻滞,促进肿瘤细胞凋亡[8-9]。目前,OY-TES-1 影响HCC 恶性生物学行为的分子机制尚不明确。本研究通过生物信息学分析,探讨OY-TES-1 潜在的生物学功能和可能参与的信号通路,从中筛选关键分子进行实验验证,为探索HCC治疗靶点的选择及其功能机制提供依据。
1 材料与方法
1.1 组织标本 36例HCC 及配对癌旁正常组织,均来源于广西医科大学第一附属医院肝胆外科手术患者,组织离体后取材置于液氮保存,标本于术后经病理确诊。标本收集经患者知情同意和广西医科大学伦理委员会批准。
1.2 细胞 人源HCC 细胞株BEL-7404、HepG2、BEL-7402、SMMC-7721 购自中国科学院上海细胞生物学研究所,使用含10%胎牛血清(FBS,加拿大Wisent公司)的DMEM(加拿大Wisent公司)于37 ℃恒温培养箱培养。
1.3 生物信息学分析 LinkedOmics数据库(http://www.linkedomics.org/)筛选OY-TES-1 表达正相关基因集。DAVID 数据库(https://david.ncifcrf.gov/)进行GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes)功能富集分析。GEPIA数据库(http://gepia.cancer-pku.cn/)用于分析HCC 样本中OY-TES-1和丙酮酸激酶M2型(PKM2)的表达及表达相关性。
1.4 总RNA提取及实时荧光定量PCR(qPCR) 采用RNA 提取试剂盒(南京诺唯赞公司,#RC101-01)提取标本和细胞株RNA。分光光度计(北京天根公司)检测RNA 浓度和吸光度值。cDNA 逆转录试剂盒(南京诺唯赞公司,#R323-01)将RNA 逆转录成cDNA。使用SYBR 染料法行qPCR(南京诺唯赞公司,#Q711-02)检测,反应条件如下:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火和延伸30 s,共计40 个循环反应。Fold Change=2-△△Ct法分析结果数据。引物序列见表1,引物由生工生物(上海)股份有限公司合成。
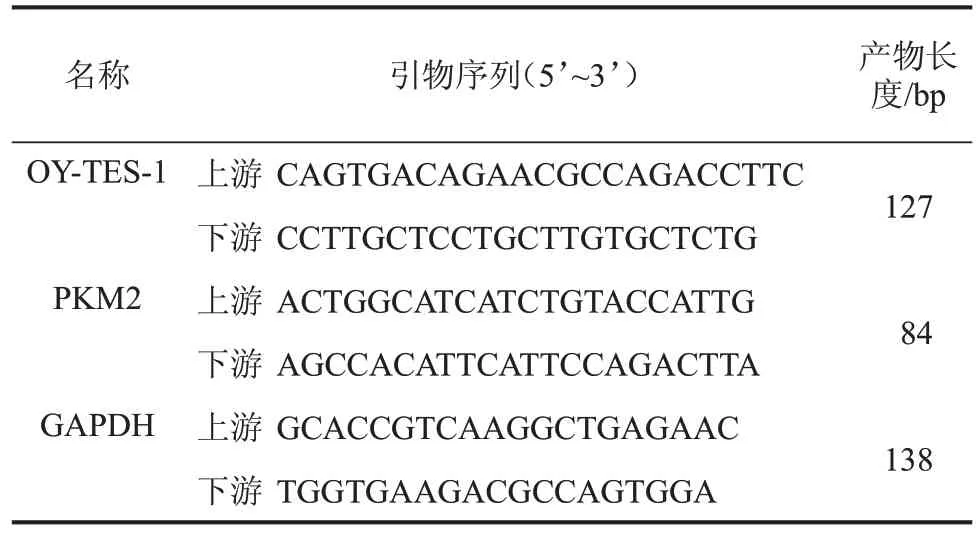
表1 PCR扩增引物序列
1.5 细胞转染 按照LipofectamineTM3000(美国Invitrogen 公司)转染试剂说明书,将siRNA(阴性对照、OY-TES-1 siRNA)分别转染至HCC 细胞,48h 后收集细胞进行后续实验。OY-TES-1 siRNA 序列(sense:5’-CGUGGAAGAGCUCCUAGAATT-3’;antisense:5’-UUGUAGGAGCUCUUCCACGTT-3’)由苏州吉玛公司合成。
1.6 Western blotting 依照蛋白提取试剂盒(北京索莱宝公司)操作说明提取细胞株总蛋白,BCA 法进行蛋白浓度检测,样品经变性后上样。依次进行电泳、转膜、封闭、一抗孵育、二抗孵育和显影曝光。OY-TES-1 抗体(美国santa cruz 公司,#sc-390594)(1∶100 稀释),PKM2 抗体(美国cell signaling公司,#4053)(1∶1 000稀释),抗小鼠二抗(美国abcam公司,#ab6728)(1∶5 000稀释)。
1.7 统计学方法 采用SPSS 23.0统计软件行数据分析,计量资料以均数±标准差()表示,配对资料组间比较采用配对t检验;计数资料以百分率(%)表示,组间比较采用Fisher确切概率法;采用Spearman秩相关分析表达的相关性;以P<0.05 为差异有统计学意义。
2 结果
2.1 OY-TES-1可能影响HCC能量代谢相关通路 通过LinkedOmics 数据库查找371例HCC RNA-seq 测序数据,以表达相关系数大于0.3 为标准,筛选获得1 001个与OY-TES-1表达正相关的基因集。对此基因集进行GO 和KEGG 分析,结果显示OY-TES-1 主要富集于多糖合成、脂代谢和碳水化合物代谢等细胞能量代谢相关通路,见图1、图2。随后,在OY-TES-1 表达正相关的基因集中,寻找参与细胞能量代谢相关的关键调节基因,PKM2型基因成为潜在候选基因。
2.2 HCC中OY-TES-1和PKM2高表达且具有较强的表达相关性 利用GEPIA 数据库对369例HCC和50例正常肝组织的RNA-seq 进行分析,结果显示:OY-TES-1 和PKM2 在HCC 中的表达均显著高于正常肝组织,且两者在HCC组织中表达呈正相关关系(r=0.3,P<0.001),见图3。
为验证上述结果,本研究收集36例HCC 及其配对癌旁组织行qPCR检测,结果显示:HCC组织中OY-TES-1(癌组织:0.58±0.95vs癌旁组织:0.36±0.61)(t=2.339,P<0.05)和PKM2(癌组织:0.14±0.17vs癌旁组织:0.08±0.14)(t=2.622,P<0.05)的表达都高于癌旁组织,且两者的表达呈正相关关系(r=0.482,P<0.001),见图4。
随后,为了了解OY-TES-1 和PKM2 mRNA 表达与患者临床参数的关系。以OY-TES-1 和PKM2在36例HCC组织中mRNA 表达的中位数为标准(高于中位数为高表达组,否则为低表达组),对两者的mRNA表达与患者性别、年龄、WHO分级等临床病理参数进行分析,统计学分析尚未发现有显著相关性,见表2。
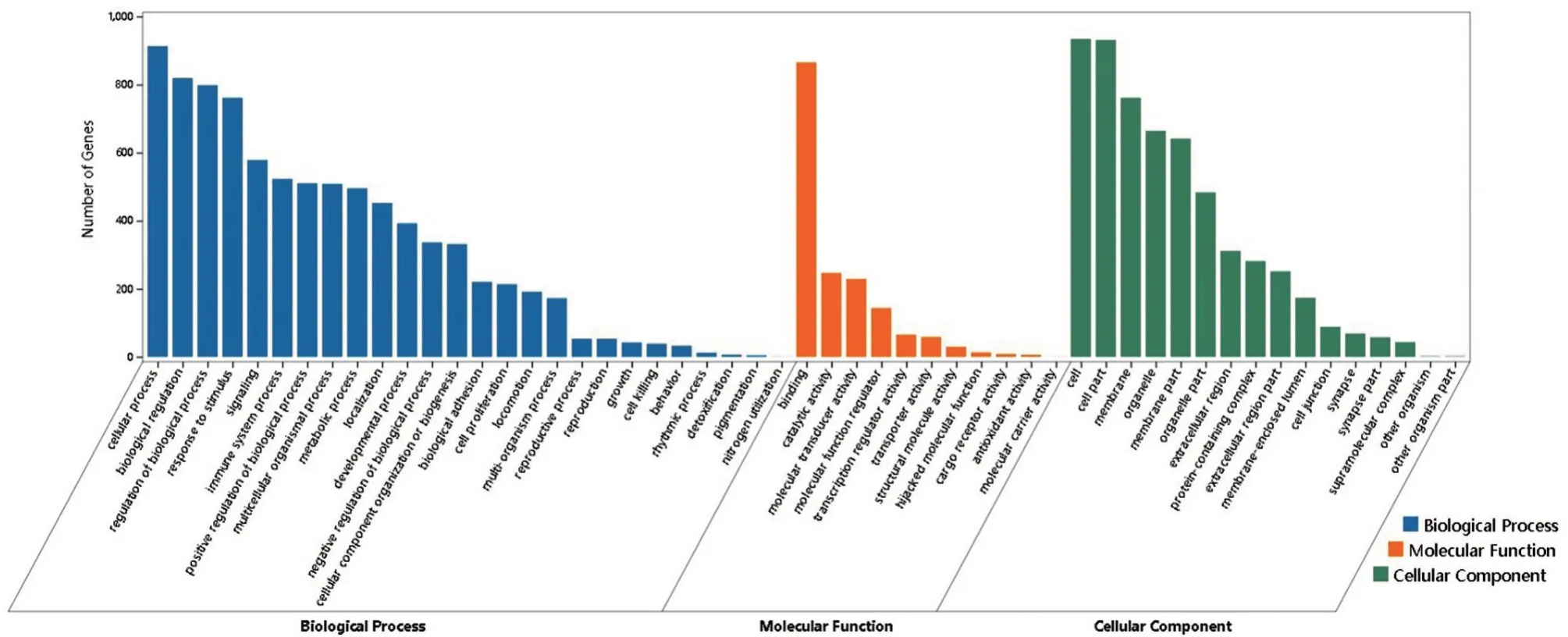
图1 OY-TES-1表达正相关基因集GO分析

图2 OY-TES-1表达正相关基因集KEGG分析

图3 GEPIA数据库分析HCC中OY-TES-1和PKM2 mRNA的表达及表达相关性

图4 qPCR检测HCC中OY-TES-1和PKM2 mRNA的表达及表达相关性
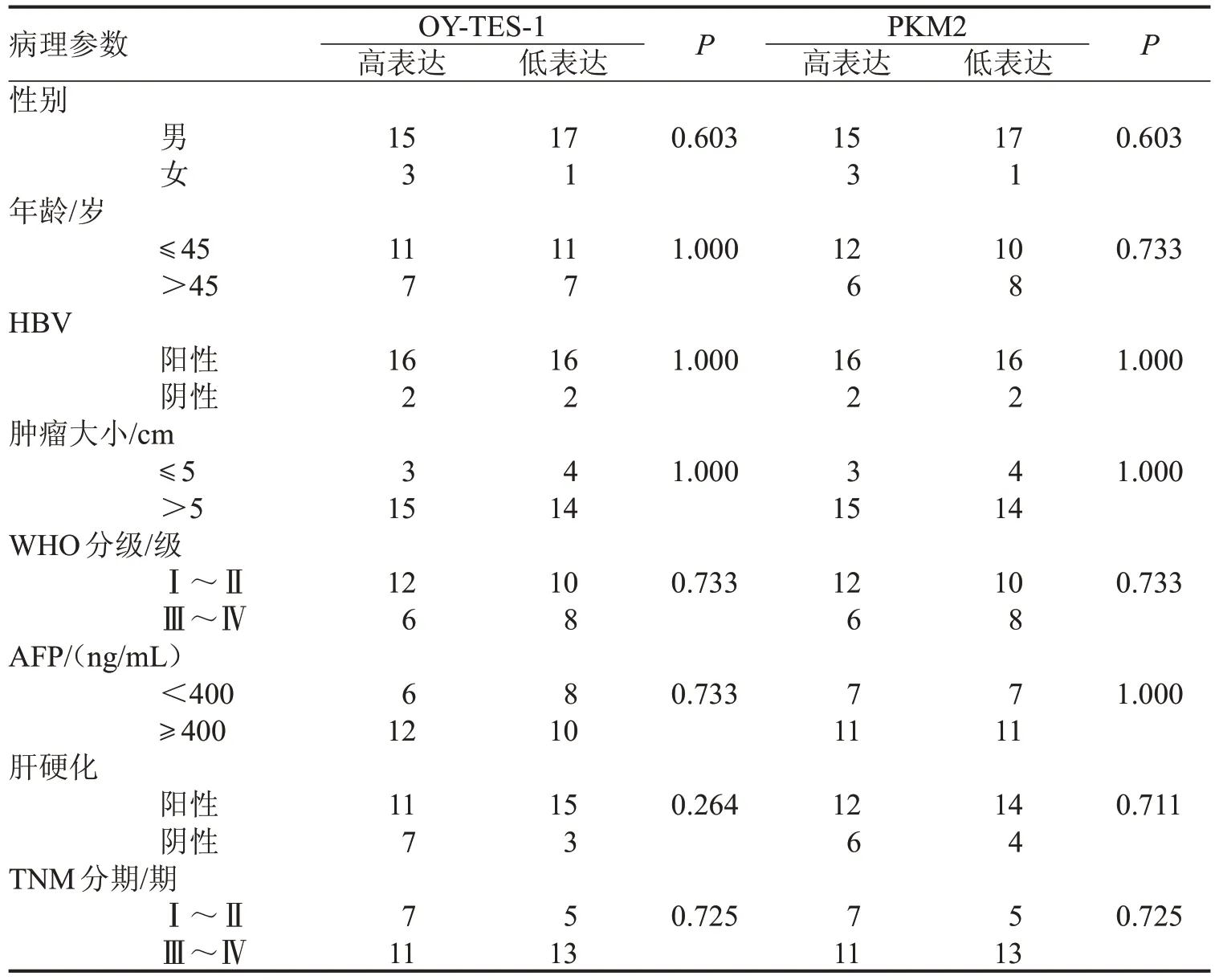
表2 OY-TES-1和PKM2 mRNA的表达与HCC患者临床参数的关系n
2.3 下调OY-TES-1表达对PKM2表达的影响 为筛选合适的细胞株进行干扰实验,本研究通过qPCR和Western blot分别检测HCC细胞株BEL-7404、HepG2、BEL-7402、SMMC-7721 中OY-TES-1 和PKM2 的表达情况。结果显示:OY-TES-1 和PKM2在HepG2和BEL-7404中mRNA和蛋白表达相对较高,见图5。因此,选择这两株细胞进行干扰试验。
将OY-TES-1 siRNA 转 染HepG2 和BEL-7404细胞48 h 后进行检测,qPCR 结果显示:OY-TES-1 mRNA表达量在HepG2和BEL-7404细胞中分别为0.69±0.06、0.62±0.07,下调至60%左右;PKM2 mRNA表达量在HepG2 和BEL-7404 细胞中分别为0.73±0.09、0.75±0.07,下调至70%左右。Western blot结果显示:随着OY-TES1-1 表达下调,两株HCC 细胞中PKM2蛋白表达也随之明显下调,见图6。以上结果提示HCC 中OY-TES-1 对PKM2 表达具有调节作用。
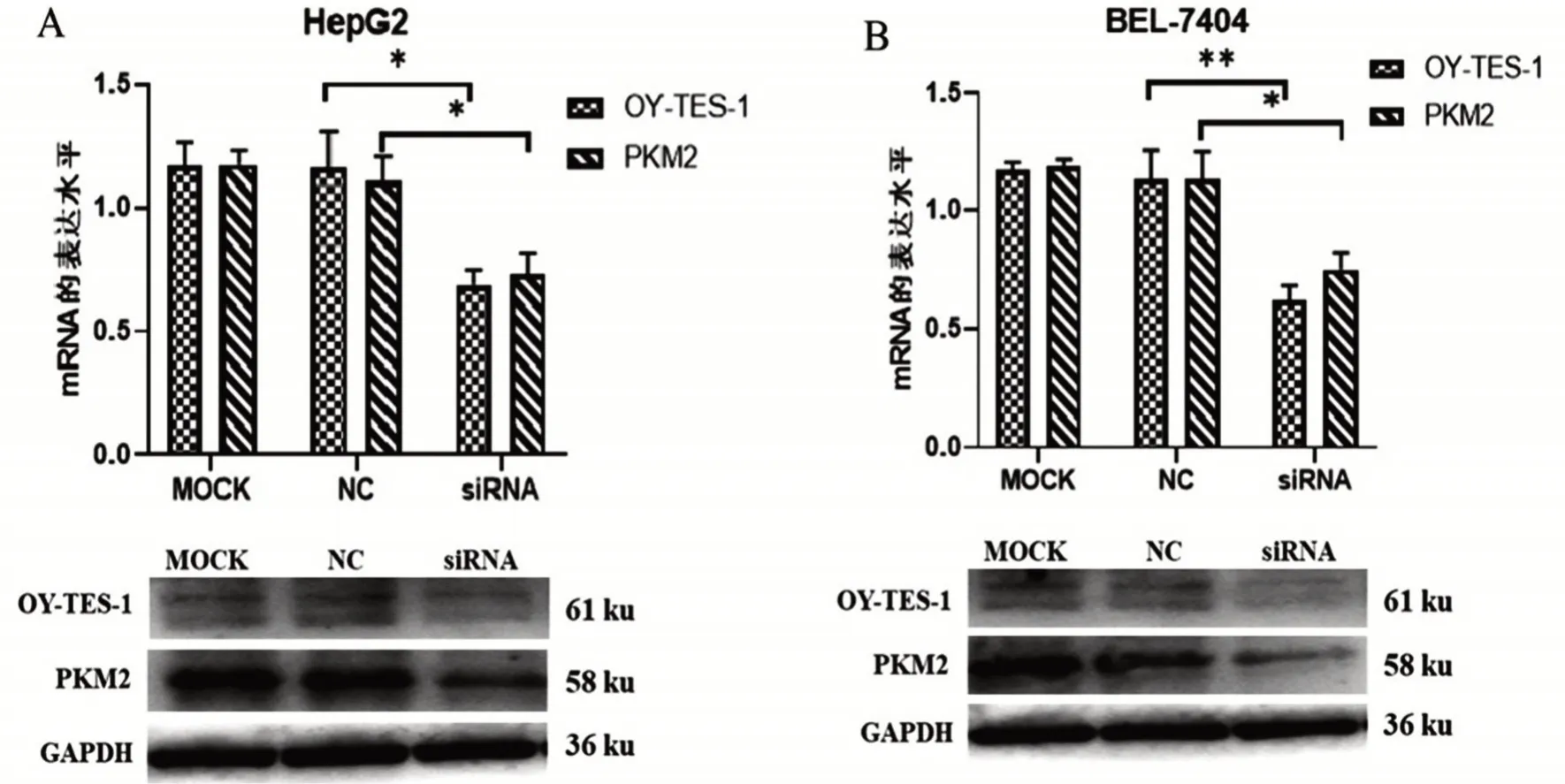
图6 HCC细胞株中下调OY-TES-1影响PKM2的表达
3 讨论
近年来,HCC的发病率和病死率在全球范围内呈上升趋势,据统计全球每年约有70万例新发HCC患者,其中我国约占一半[10],为此迫切需要寻找新的HCC 辅助治疗靶点。目前一些CTA 疫苗(如NYESO-1、MAGE)已用于临床试验阶段并取得一定疗效,显示CTA具有临床应用前景[11]。OY-TES-1作为CTA 家族成员之一,前期研究发现OY-TES-1 具有免疫原性,在部分HCC患者血清中检出抗OY-TES-1抗体[12],但是OY-TES-1影响HCC恶性生物学行为的具体机制及调控分子目前还未见报道。
生物信息学是近年来生命科学领域迅速发展的新兴学科,它通过对基因序列中表达的结构功能信息进行检索和分析,为后继实验提供理论指导。在本研究中,我们首先通过LinkedOmics 数据库中HCC 样本的测序结果,获得与OY-TES-1 表达显著正相关的1 001 个基因集。随后,通过DAVID 数据库研究OY-TES-1 潜在的生物学功能,发现该基因主要富集于多糖合成、脂代谢和碳水化合物代谢等细胞能量代谢通路。结合LinkedOmics数据库分析结果,进一步筛选出参与细胞能量代谢的关键调节基因PKM2。
PK是糖酵解途径中三大关键限速酶之一,能够催化磷酸烯醇式丙酮酸转化为丙酮酸[13],对细胞生长和增殖具有重要的调节作用[14]。PK 包括L 型和M型,M型又分为M1和M2亚型。PKM2特异性表达于干细胞和肿瘤细胞等,因此也被称为肿瘤特异性丙酮酸激酶。研究发现,HCC 中高表达的PKM2能够调节HCC细胞能量代谢进而影响HCC的恶性生物学行为[15]。为此推测,OY-TES-1 也可能通过PKM2 影响HCC 细胞能量代谢从而影响HCC 的恶性生物学行为。
为证实上述推测,本研究首先利用GEPIA数据库进行分析,结果发现,HCC组织中OY-TES-1 和PKM2 都呈高表达,两者具有较强的表达相关性。随后,收集36例HCC和配对癌旁组织进行qPCR验证,结果显示HCC组织中OY-TES-1 和PKM2 的表达都显著高于癌旁组织,且两者的表达呈正相关关系(P<0.05)。统计学分析未发现OY-TES-1 和PKM2的表达与HCC患者临床参数有显著相关性,可能与研究样本数量偏少有关,仍有待进一步探索。
本研究中,在HCC 细胞株HepG2 和BEL-7404中干扰OY-TES-1 的表达,结果显示,PKM2 的mRNA 和蛋白表达也随之下调。已知肿瘤细胞为了维持自身的生长和增殖,对葡萄糖的摄取远大于正常细胞,更偏向于利用糖酵解途径生成乳酸而取代正常细胞的有氧氧化,这种现象被称为瓦博格效应(warburg effect)[16]。已有研究表明,HCC 中PKM2 表达升高能够促进HCC 瓦博格效应的发生[17]。本研究的实验虽然证实OY-TES-1 可影响PKM2的表达,但是OY-TES-1是否通过调节PKM2的表达从而影响HCC 细胞的能量代谢,导致HCC瓦博格效应的发生仍有待研究。
