MMP2介导Sonic hedgehog信号通路对糖尿病内皮祖细胞功能的影响
2021-04-17赵小亚江如钞肖青
赵小亚,江如钞,肖青*
(1.广州医科大学药学院 广东省分子靶标与临床药理学重点实验室;2.广州医科大学药学院药理教研室,广东 广州 511436)
内皮祖细胞(endothelial progenitor cells,EPCs)是一种能够形成血管内皮细胞的前体细胞,亦称为成血管细胞,对心血管疾病中内皮损伤的修复从而改善血管功能起着重要的作用。内皮祖细胞在修复与更新过程中迁移至受损血管处,通过分化成为功能性内皮细胞,并通过分泌促血管因子改善受损内皮细胞的再生从而有效促进内皮功能恢复,维持血管的稳态[1, 2]。相关动物和临床实验都证明EPCs对血管的再生具有重要的作用。在大鼠心肌梗死模型中,心肌内转移外周血来源的EPCs,促进内皮再生和新生血管形成,改善左心室功能[3],在缺血性心力衰竭患者中阿托伐他汀治疗通过调动和提高外周血循环内皮祖细胞的数量促进内皮功能的修复[4]。由此可见,EPCs在内皮细胞的生成和维持内皮完整性方面具有重要作用,可应用于缺血性疾病的治疗。但是,在糖尿病阶段,EPCs的动员数量明显减少、功能受损,导致血管修复能力下降,降低如受损伤口的愈合和缺血组织中血管侧支的形成,大大增加糖尿病血管并发症的发病率与死亡率[5, 6]。
Sonic hedgehog(Shh)是一种分泌蛋白属于Hedgehog(Hh) 家族的重要成员,在缺血损伤中可通过激活Shh信号通路促进血管新生和损伤组织的修复。在缺血模型中转染Shh基因,可促进血管新生,产生对缺血心肌的修复作用[7]。而在糖尿病动物模型研究中发现,Shh信号可以明显改善糖尿病的血管病变。给予Shh蛋白治疗,可以通过诱导动脉生成和调节神经血流量明显地改善糖尿病引起的神经血管病变[8]。我们之前的研究证明,糖尿病EPCs的Shh信号通路中Ptch和Gli的表达下调,说明该通路受损,给予Shh信号激动剂SAG后,糖尿病EPCs的功能包括增殖、迁移、粘附、小管形成能力得到明显的改善,从而改善1型糖尿病小鼠后肢缺血损伤[9],然而,激活Shh通路改善糖尿病EPCs功能的作用机制尚不明确。基质金属蛋白酶(MMPs)超家族是锌依赖性内肽酶几乎能够降解所有的细胞外基质成分,包括20多种蛋白酶成员,在肿瘤侵袭和转移中具有重要作用。研究证明,抑制MMP2的表达阻碍EPCs的小管形成能力[10]。那么Shh通路改善糖尿病EPCs功能是否与MMP2有关,目前尚不清楚。因此本研究通过基因修饰激活Shh通路,探讨其对糖尿病EPCs功能的改善,并明确改善作用的机制,为糖尿病合并心血管疾病的治疗提出新的治疗靶点。
1 材料与方法
1.1 实验动物
SPF近交系C57BL/6雄鼠,6~8周龄,平均体质量(20±2)g,来源于广东省医学动物实验中心。
1.2 实验试剂
EGM-2培养基购自美国Lonza公司;M199培养基、胎牛血清、0.25%胰酶购自美国Gibco公司;Shh蛋白购自美国R&D公司;链脲佐菌素(STZ)购自美国Sigma公司;Matrigel胶、人纤维粘连蛋白购自美国BD公司。
1.3 实验方法
1.3.1建立1型糖尿病小鼠模型 将6~8周C57BL/6雄鼠随机分为注射STZ糖尿病组与柠檬酸缓冲液对照组,糖尿病组连续5 d给予禁食的小鼠腹腔注射小剂量链佐霉素STZ 45 mg/kg/d,对照组给予等量的柠檬酸缓冲液。STZ注射结束后第三天,当小鼠随机血糖高于16.7 nmol/L,说明成功建立糖尿病小鼠模型。
1.3.2骨髓EPCs的分离培养 糖尿病小鼠经麻醉后脱颈处死,无菌解剖分离四肢长骨,M199培养基反复轻缓冲洗骨髓腔,将骨髓细胞全部冲洗到培养皿中。用枪头将细胞团吹打分散,收集到15 mL无菌离心管中,4 ℃条件下400 g(1 300 RPM)离心20 min。倒掉上清液,剩下细胞沉淀,加入红细胞裂解液1 mL,用枪头吹打均匀,放置1 min,使红细胞充分裂解,加入6 mLPBS离心洗涤2次。加适量EGM培养基混悬细胞,分种于包有纤连蛋白的培养皿中培养。在37 ℃培养箱中培养7 d,其中每隔三天全量换液一次。
1.3.3EPCs迁移实验 0.25%胰酶消化收集贴壁细胞,EBM培养基混悬细胞,将100 μL的5×105/mL细胞悬液加入Transwell小室的上室、下室加入500 μL含10%FBS的EBM培养基,在37℃培养箱中培养16 h后,移去上室培养液进行检测,PBS冲洗3遍,用棉签抹去Transwell小室上室内膜上面未迁移的细胞。下室上表面用甲醇室温固定20 min,于37 ℃暖箱中,用0.1%结晶紫染色30 min,PBS多次冲洗晾干,在100倍光学显微镜下观察并拍照,选取相同的5个视野计数迁移的细胞数量。
1.3.4EPCs 小管形成实验 48孔培养板每孔缓慢加入200μL Matrigel胶,避免气泡的产生,之后将其放置37℃培养箱中孵育30 min。每孔加入400 μL EBM培养基细胞悬液,轻拍使细胞均匀分布,于37 ℃培养箱培养16 h,40倍光学显微镜下观察并拍照。
1.4 统计学分析
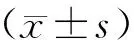
2 结果
2.1 糖尿病EPCs的鉴定
从糖尿病模型8~12周的小鼠中分离出骨髓内皮祖细胞培养,于第七天先后给予Dil标记的乙酰化低密度脂蛋白(Dil-acLDL)与FITC标记的荆豆凝集素1(FITC-UEA-1)各孵育1 h,激光共聚焦观察EPCs摄取染料的情况。如图1显示,EPCs同时摄取FITC-UEA-1和DiL-acLDL,显示双荧光阳性(橙黄色)的细胞则被认为是EPCs。

图1 激光共聚焦鉴定糖尿病小鼠骨髓内皮祖细胞(×200)
2.2 Adv-Shh转染糖尿病EPCs的最佳滴度选择
已知Adv-Shh滴度为2.0×1010pfu/mL,糖尿病EPCs以1×107、2×107、4×107、1×108滴度转染Shh腺病毒12 h后继续培养至48 h。图2显示,滴度为1×107、2×107、4×107的转染效率明显低于滴度为1×108;图3显示,与Adv-GFP组相比,腺病毒以滴度1×108过表达Shh组的Shh 表达水平明显升高(P<0.05),过表达效率达18.79倍。
2.3 糖尿病EPCs的小管形成与迁移能力
糖尿病EPCs以滴度为1×108的Adv-Shh转染12 h后换为完全培养基继续培养至48 h,用Matrigel建立小管形成实验,计算形成的管腔长度。用Transwell小室建立迁移实验,计算迁移至下室表面的细胞数。图4A显示,与Adv-GFP组相比,Adv-Shh组的糖尿病EPCs小管形成能力明显增加(P<0.05)。图4B显示,与Adv-GFP组相比,Adv-Shh组的糖尿病EPCs迁移数量明显增加(P<0.05)。
2.4 Sonic hedgehog通路激活糖尿病EPCs的MMP2和Gli1蛋白表达
糖尿病EPCs给予Shh蛋白(0.5 μg/mL)作用24 h后检测MMP2、Gli1的表达,结果显示,给予Shh蛋白后,其下游蛋白Gli1表达明显上调,说明Shh通路被活化。图5显示,与正常对照组相比,糖尿病EPCs中MMP2、Gli1蛋白表达明显下调(P<0.05),给予Shh蛋白处理后,MMP2、Gli1的表达明显回升(P<0.05)。
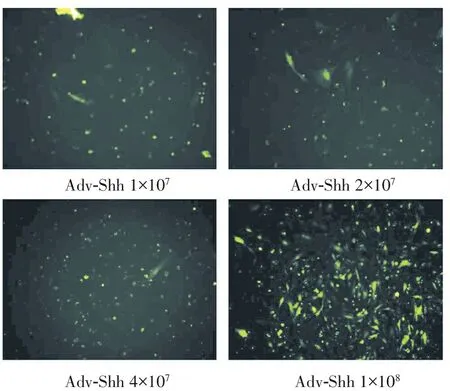
图2 荧光成像技术观察糖尿病内皮祖细胞转染效率(×100)

图3 Western blot 检测糖尿病内皮祖细胞Shh蛋白表达水平(*P<0.05, n=3)
2.5 小分子MMP2-siRNA沉默效率的检测
糖尿病EPCs给予MMP2-siRNA转染6 h后换为完全培养基继续培养至48 h,以加入NC-siRNA作为阴性对照组,以转染MMP2-siRNA-1, 2, 3作为实验组(siRNA序列分别为:siRNA-1:GGAATGCCA TCCCTGATA;siRNA-2:CCACAACCAACTACGATGA;siRNA-3:TGAGAAGGATGGCAAGTAT)。图6显示,与阴性对照组比较,siRNA-1和siRNA-2均可显著减少MMP2蛋白表达水平,其中siRNA-2抑制效果最显著(P<0.05)。

图4 糖尿病内皮祖细胞小管形成与迁移能力检测4A小管形成;4B 迁移能力(*P<0.05, n=3)

图5 Sonic hedgehog通路激活上调糖尿病内皮组细胞MMP2和Gli1蛋白表达(*P<0.05, n=3)
2.6 干扰MMP2表达抑制Shh通路对糖尿病EPCs的MMP2、小管形成与迁移能力的改善
给予MMP2-siRNA-2转染6 h后换为完成培养基继续培养至24 h,给予Shh蛋白(0.5 μg/mL),继续培养24 h。图7显示,MMP2-siRNA-2显著抑制糖尿病EPCs 中Shh蛋白引起的MMP2表达增加(P<0.05)。图8显示,给予Shh蛋白(0.5 μg/mL)显著增加糖尿病EPCs的小管形成和迁移能力,而在此基础上给予MMP2-siRNA-2明显抑制Shh蛋白对EPCs功能的改善(P<0.05)。

图6 siRNA-1和siRNA-2减少MMP2蛋白表达水平(*P<0.05, n=3)
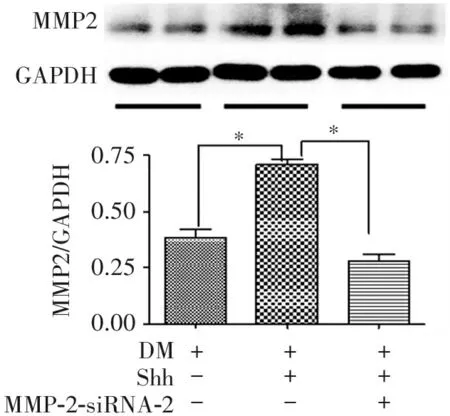
图7 干扰MMP2表达抑制Shh通路引起的糖尿病内皮组细胞MMP2表达上调(*P<0.05, n=3)
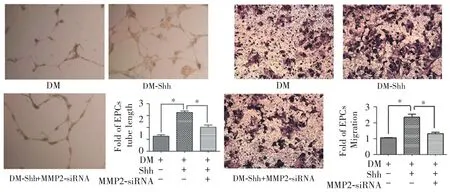
图8 干扰MMP2表达抑制Shh通路对糖尿病内皮组细胞小管形成与迁移能力的改善(*P<0.05, n=3)
3 讨论
EPCs存在于骨髓和体循环中,可分化为内皮细胞参与血管新生,又可以整合到内皮表层,刺激内皮细胞的增殖和功能的活化。因此,EPCs在缺血组织中参与血管的新生,对缺血引起的损伤具有重要的改善作用。然而,EPCs的数量与其功能的稳定是维持其血管新生作用的关键因素。在糖尿病的病理状态下时,EPCs的循环数量减少,功能受损,对刺激反应的敏感性降低;旁分泌行为异常,主要表现为失去分泌促血管因子的能力,分泌抗血管因子。为了证明EPCs在糖尿病模型中是否受损,我们通过小剂量多次注射链脲佐菌素(STZ)建立小鼠1型糖尿病模型,8周后分离骨髓内皮祖细胞培养,用小管形成及迁移实验证明,与正常小鼠相比糖尿病EPCs的小管形成和迁移能力明显下降[9],这些结果表明在糖尿病中,EPCs的功能明显下降,这与之前的相关研究相一致[11-12]。
Sonic Hedgehog(Shh)在胚胎时期对血管的形成有直接的导向作用,在成年时期对心血管功能的维持和损伤后的修复具有重要,激活Shh信号通路可以促进缺血组织的血管新生。已有研究显示,Shh信号可以促进多种干细胞的增殖分化,如间充质干细胞、内皮细胞、CD34+等,因此可参与组织损伤的细胞填充及血管新生。最近,我们的研究表明,糖尿病内皮祖细胞中的Shh、Ptch和Gli的表达下调,而给予Shh通路激动剂能显著改善糖尿病EPCs功能障碍,为了进一步证明激活Shh通路是否改善糖尿病EPCs的功能,本研究使用Adv-Shh对骨髓分离培养的糖尿病内皮祖细胞进行基因修饰,以期望观察Shh基因修饰过后的糖尿病EPCs的受损功能得到改善。首先验证腺病毒过表达效率,以滴度为1×108的腺病毒Adv-Shh感染内皮祖细胞,结果显示Shh表达明显增加,提示其对Shh通路具有显著激动作用。随后,采用小管形成与细胞迁移实验证明EPCs的功能,结果显示,Shh基因修饰的EPCs与对照组相比,其小管形成与迁移能力得到明显的改善,说明Shh基因修饰的糖尿病EPCs的功能得到显著改善。
新血管的形成与胞外蛋白水解作用紧密相关,而大部分相关的细胞外蛋白水解酶属于两大家族,其中包括基质蛋白酶家族,MMP2是基质蛋白酶(MMPs)家属中的一种明胶酶A,与血管的新生密切相关[13]。在EPCs中,血管生长因子(VEGF)可以刺激MMP2的分泌与激活,特定的抑制或者基因消除MMP2的表达阻碍了内皮祖细胞的小管形成[14]。但在糖尿病EPCs中,MMP2的表达如何,以及是否与糖尿病EPCs功能相关还未可知。本研究结果显示,糖尿病EPCs中的MMP2表达下降,给予Shh蛋白可以促进MMP2蛋白表达,小分子RNA干扰MMP2表达翻转Shh蛋白对MMP2的激动作用。本研究还进一步证明干扰MMP2表达抑制Shh蛋白对糖尿病内皮祖细胞小管形成和迁移的提高,说明Shh-MMP2通路受损与糖尿病内皮祖细胞功能障碍密切相关。
综上所述,激活Shh通路通过MMP2改善糖尿病EPCs功能受损,为发展糖尿病患者自体细胞疗法提供新治疗靶点和理论基础。
