慢性肾病患者血清Klotho,HE4,UMOD表达水平与疾病预后的相关性研究
2021-04-17赵智凝第四军医大学西京医院检验病理科西安710054
赵智凝,武 易,刘 芳,何 莹,杨 荣,景 涛(第四军医大学西京医院检验病理科,西安 710054)
慢性肾病(chronic kidney disease,CKD)以肾脏结构、功能改变为主要特征,导致肾功能损害,全球发病率为8%~16%[1-2]。目前常采用肾小球滤过率(glomerular filtration rate,GFR)、尿清蛋白、肌酐作为评估肾功能的指标或者肾损伤标志物,但一些干扰因素会影响结果的稳定性和可靠性[1-3],如MISCHAK 等[4]研究发现采用血清肌酐水平评估患者肾功能状态,超过50%患者肌酐水平处于正常状态,因此仍需要寻找可靠、有效的肾损伤标志物来评估CKD患者疾病的发生发展情况。虽然有很多血清指标可反映CKD的肾损伤程度,但其临床价值仍未得到充分确证,如Klotho 蛋白主要在肾脏生成和代谢,肾脏结构功能的改变均可影响Klotho的表达[5,6],人附睾蛋白4(human epididymis protein,HE4)可在人肾脏纤维化状态中高表达,通过抑制蛋白酶而调节肾纤维化组织重塑过程[7],尿调节素(uromodulin,UMOD)作为T-H 糖蛋白,其水平变化与CKD 有关[8]。目前关于血清Klotho,HE4,UMOD表达水平与CKD的预后关系报道尚不多见,因此本文将通过实例进行探讨,从而为临床诊治提供参考价值。
1 材料和方法
1.1 研究对象 选取我院2017年4月~2019年4月期间收治的120例CKD患者,CKD患者病程4~15年,其中男性72例,女性48例,年龄57.24±2.34岁,体质指数(BMI)22.05±2.27 kg/m2。选取同时段于我院体检中心检查健康者100例作为对照组,其中男性65例,女性35例,年龄56.81±2.27岁,体质指数(BMI)22.47±2.34 kg/m2,两组患者入组前的性别、年龄、BMI比较差异均无统计学意义(χ2=0.580,P=0.446;t=1.376,P=0.170;t=1.347,P=0.179)。患者入组前均签署知情同意书,且该研究已获得伦理委员会批准。
纳入标准:①肾小球滤过率(GFR)<60 ml/min,CKD 病史不低于6个月;②具备认知、读写能力,病历资料完整,依从研究方案。
排除标准:①有免疫、血液、神经系统疾病;②急性肾损伤、肿瘤;③每日糖皮质激素用量超过10mg;④GFR<60 ml/min;⑤胃肠道、肺部、其他软组织感染。
1.2 仪器与试剂 Klotho,HE4,UMOD检测试剂盒购自美国默沙克生物;酶标仪采用赛默飞Varioskan LUX;电化学发光仪采用Roche E601。
1.3 方法 患者入组后,于随访前以及随访结束后清晨空腹抽取外周肘静脉血约5 ml,3 000r/min 离心10min,取上层血清于-80℃冻存待用。采用赛默飞Varioskan LUX 酶标仪测定血清Klotho,HE4水平,采用罗氏E601 电化学发光仪检测血清UMOD水平。所有步骤严格按照试剂盒操作说明书进行。以患者随访前血清水平均值为临界值,分为高水平组、低水平组,比较不同组患者预后情况。
两组患者均随访12个月,随访过程中均行常规排毒、降压等对症治疗,随访前、结束后计算GFR值,计算所有患者GFR 下降幅度的均值,若超过均值则判为肾功能恶化,若低于均值则判为肾功能稳定[9]。若随访12个月内患者死亡,则提前终止随访,以死亡前的随访结果为最终结果,并判定为恶化。随访结束共有45例患者死亡,11例患者出现GFR 下降幅度超过均值。
1.4 统计学分析 采用SPSS 19.0 软件分析所有数据,其中独立样本计量资料以均数±标准差(±s)表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验。指标间相关性评估采用Pearson 相关性分析,用KaplanMeier 生存分析血清因子与预后的关系,以P<0.05为差异有统计学意义。
2 结果
2.1 研究组和对照组血清Klotho,HE4,UMOD以及GFR水平 见表1。研究组血清Klotho,GFR和UMOD 显著低于对照组,HE4水平显著高于对照组,差异均有统计学意义(P<0.001)。
表1 研究组和对照组血清Klotho,HE4,UMOD 以及GFR水平比较(±s)
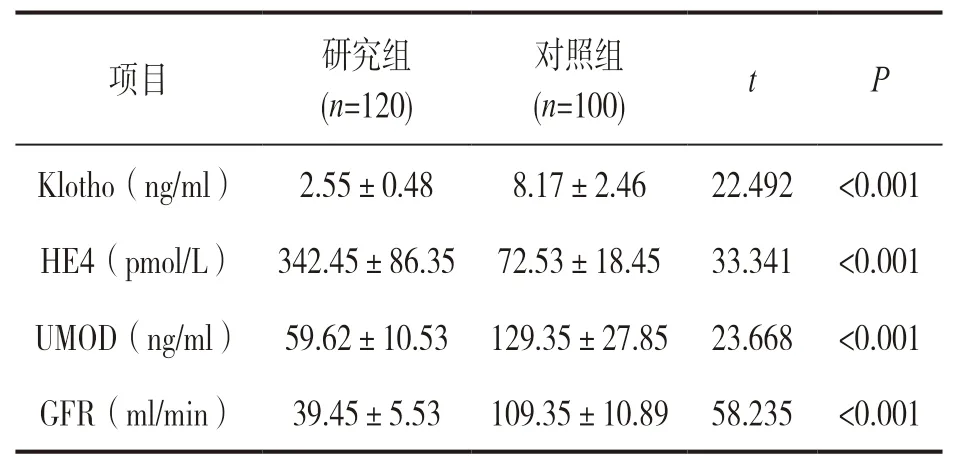
表1 研究组和对照组血清Klotho,HE4,UMOD 以及GFR水平比较(±s)
项目 研究组(n=120)对照组(n=100) t P Klotho(ng/ml) 2.55±0.48 8.17±2.46 22.492 <0.001 HE4(pmol/L) 342.45±86.35 72.53±18.45 33.341 <0.001 UMOD(ng/ml) 59.62±10.53 129.35±27.85 23.668 <0.001 GFR(ml/min) 39.45±5.53 109.35±10.89 58.235 <0.001
2.2 血清Klotho,HE4,UMOD 与GFR的关系 对患者血清Klotho,HE4,UMOD 与GFR 进行Pearson 相关性分析,结果显示Klotho,UMOD 与GFR呈正相关性,r=0.682,0.582,HE4与GFR呈负相关性,r=0.627,均P<0.001。
2.3 恶性组、稳定组患者血清Klotho,HE4,UMOD变化程度 见表2。随访结束时血清Klotho,UMOD水平明显低于随访前,HE4水平明显高于随访前,恶性组患者的变化幅度均明显高于稳定组患者,差异均有统计学意义(均P<0.001)。
2.4 不同血清水平患者的预后情况比较 见表3。随访12个月死亡45例(37.50%),不同血清因子水平组患者死亡率统计学差异显著。Kaplan-Meier曲线发现高Klotho,UMOD水平组不良肾脏预后风险低于低Klotho,UMOD水平组,高HE4水平组不良肾脏预后风险高于低HE4水平组,见图1~3。
表2 恶性组、稳定组患者血清Klotho,HE4,UMOD 变化程度比较(±s)
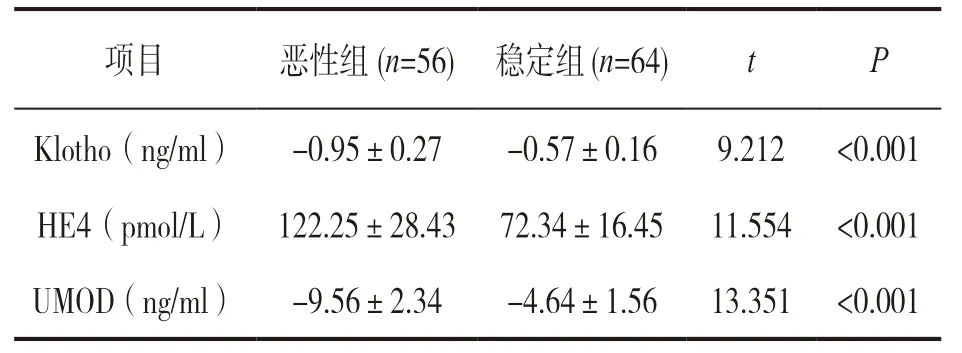
表2 恶性组、稳定组患者血清Klotho,HE4,UMOD 变化程度比较(±s)
项目 恶性组(n=56) 稳定组(n=64) t P Klotho(ng/ml)-0.95±0.27-0.57±0.16 9.212 <0.001 HE4(pmol/L) 122.25±28.43 72.34±16.45 11.554 <0.001 UMOD(ng/ml)-9.56±2.34-4.64±1.56 13.351 <0.001
表3 血清Klotho,HE4,UMOD水平与患者预后情况比较(±s)
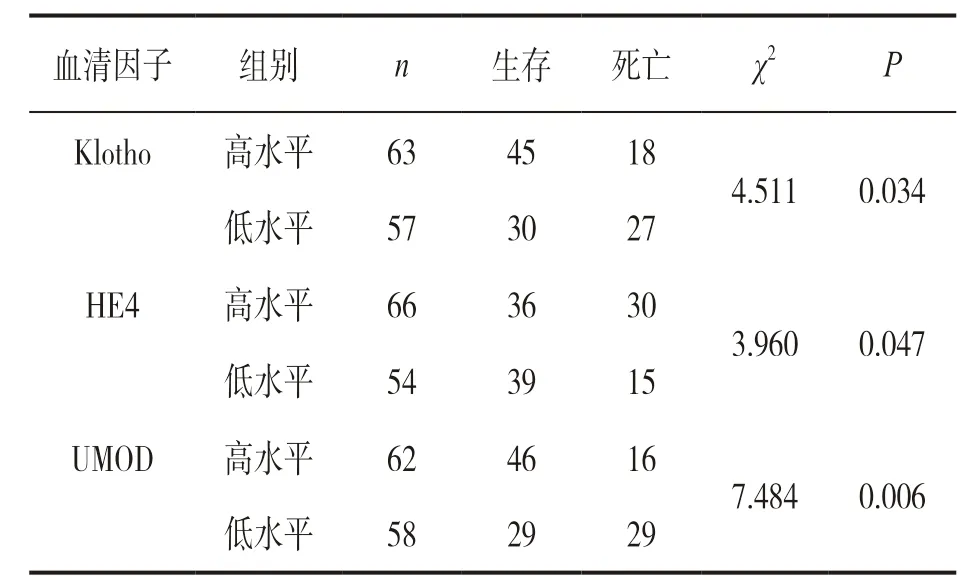
表3 血清Klotho,HE4,UMOD水平与患者预后情况比较(±s)
血清因子组别 n 生存 死亡 χ2 P Klotho 高水平 63 45 18 4.511 0.034低水平 57 30 27 HE4 高水平 66 36 30 3.960 0.047低水平 54 39 15 UMOD 高水平 62 46 16 7.484 0.006低水平 58 29 29
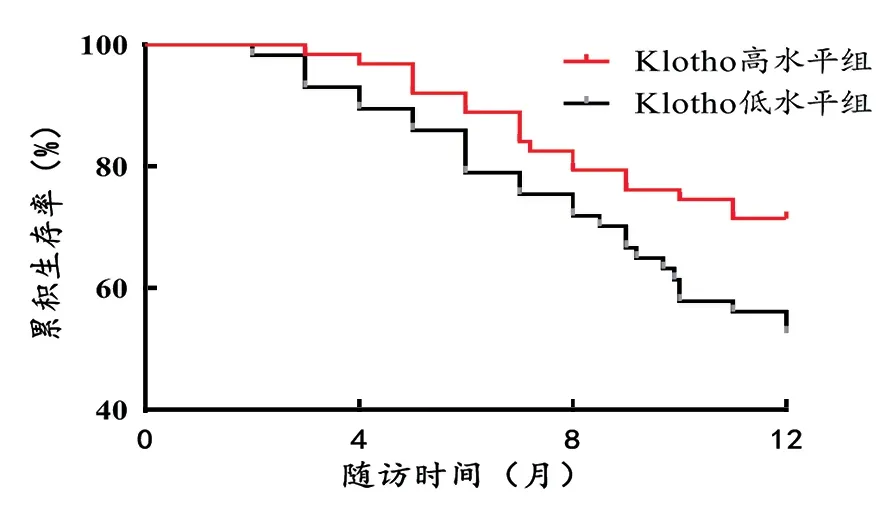
图1 Kaplan-Meiser曲线分析不同Klotho表达水平与患者预后的关系
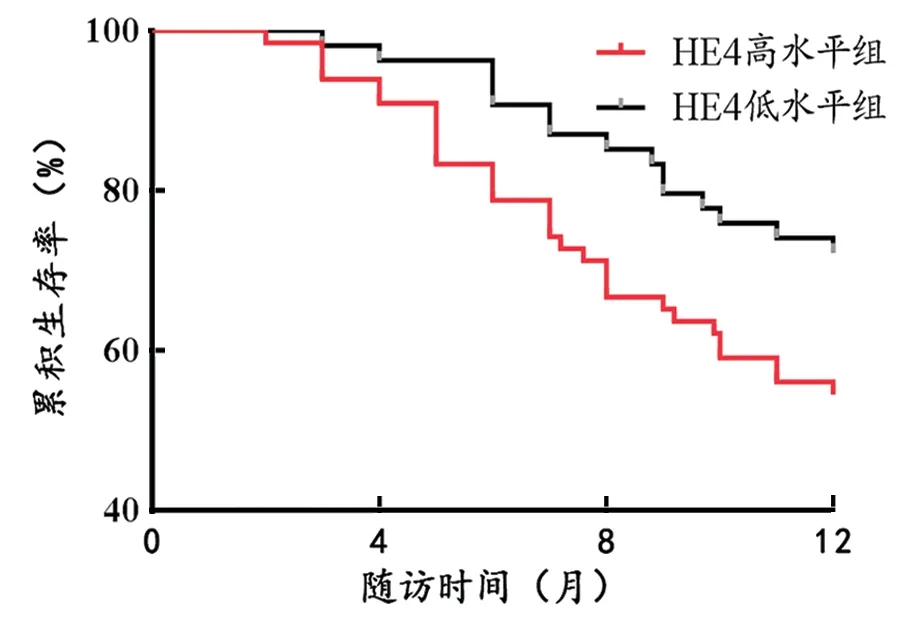
图2 Kaplan-Meiser曲线分析不同HE4表达水平与患者预后的关系
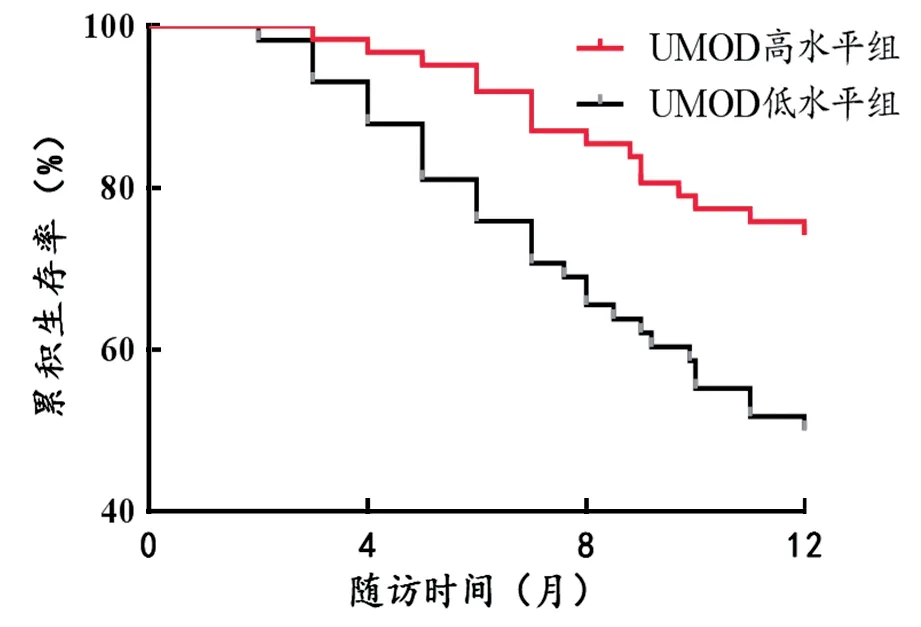
图3 Kaplan-Meiser曲线分析不同UMOD表达水平与患者预后的关系
3 讨论
随着人口老龄化以及生活习惯的改变,CKD 已成为临床常见病、多发病,我国CKD患病率约为10.8%,其中64岁以上人群发病率23.4%~35.8%[3]。目前尚无有效的防治手段,因此早发现、早干预以及预后评估对于提高CKD的存活率至关重要,同时开展针对预后的生物标志物研究尤为迫切。2012年全球改善肾脏病预后组织指南推荐通过计算GFR评估肾功能,但越来越多研究发现脂质代谢异常、贫血、脑卒中、冠心病、衰老等均可降低GFR,从而影响评估准确性,造成假阳性结果[10-11]。Klotho是近年来发现的肾脏保护因子,其血清水平的降低与肾脏损伤的程度密切关联。此外,分子遗传学检查发现UMOD 基因突变可导致合成后的尿调节素多肽链失去正确的折叠能力,沉积在内质网,无法合成具有调节功能的尿调节素,同时尿调节素异常沉积可加速肾小管细胞凋亡,导致肾单位丧失和引起肾衰竭[12]。HE4是WAP-4 二硫化物核心结构域2 基因编码的产物,可通过编码丝氨酸蛋白激酶抑制剂而抑制肾脏纤维化,延缓CKD 进展[13]。本次研究发现研究组患者血清Klotho,GFR,UMOD显著低于对照组,且通过Pearson 相关性分析显示Klotho,UMOD 与GFR 呈正相关性,HE4 与GFR呈负相关性,表明Klotho,GFR,UMOD 均可评估CKD患者肾功能状态。杨晓霞等[14]研究发现外周血中HE4水平可随着CKD患者肾功能的下降而上升,且与GFR 呈负相关性,与本次研究结果相近,表明HE4 可能作为CKD 进展的血清生物学标志物,用于预测CKD患者的预后情况。QIAN 等[15]研究发现CKD患者的血清Klotho 下降幅度越大,患者肾功能状态越差,则随访期间肾脏替代治疗风险越高,这与本研究结果一致。Klotho的降低可导致氧化应激、炎性反应以及凋亡等因素损伤肾脏功能,加重疾病进展[16],血清Klotho水平降低幅度与肾功能的恶化程度相关,故而恶化组患者下降幅度明显高于稳定组患者。
本研究中120例受试者随访12个月后死亡45例(37.50%),且通过Kaplan-Meier曲线分析发现低Klotho,UMOD水平或者高HE4水平患者的预后较差,死亡风险较高,正如李莎莎等[16]报道认为血清Klotho的降低不仅仅与肾脏损伤程度关联,同时通过长时间随访发现其可增加CKD患者进展至终末期肾脏病风险和死亡风险。Klotho 功能多样,可通过自分泌或旁分泌的方式作用于肾脏,从而发挥抗炎、抗氧化以及抑制肾脏器官纤维化的作用,如Klotho 可抑制肾脏上皮细胞-间充质细胞转分化引起的肾间质纤维化,以及抑制组织内质网应激介导的远端小管上皮细胞凋亡。LIU 等[17]研究发现Klotho 通过调控核因子κB 通路抑制炎性反应,从而干扰转化生长因子β1,Wnt 信号通路,抑制肾间质纤维化,发挥肾脏保护作用。UMOD 广泛存在于尿液中,具有抗菌作用[18]。高UMOD 排泄导致机体血清水平较低,可激活机体免疫功能,或者大量进入组织间质后,特别是受损伤的肾小管,与嗜中性白细胞结合而促进IL-8的合成,可诱导单核细胞分泌IL-1β,TNF-α,可增加淋巴细胞表面IL-2 受体与HLA Ⅱ类分子的表达等,从而导致炎症反应,引起慢性肾病的恶化,影响CKD患者的预后[19]。杨丽霞等[14,20]认为HE4是α 平滑肌动蛋白的靶点,可在肾脏肌肉成纤维细胞中大量表达,在各种CKD患者血清中处于高表达状态,且与肾间质纤维化正相关。HE4 可抑制金属基质蛋白酶、丝氨酸蛋白酶等激酶活性,从而抑制胶原蛋白I的降解,使得I型胶原蛋白大量沉积于肾脏,从而引起肾脏纤维化,加速CKD 进展和肾功能的恶化,故而本次研究发现血清低HE4水平患者死亡风险更高。血清学标志物应用于临床仍存在一定局限性,容易受到多种因素的干扰(炎症、氧化应激、高磷血症等),同时肾脏以外的其他器官也可分泌血清因子,如血管、脑组织、甲状旁腺等组织器官可分泌Klotho,因此在实际肾脏功能以及预后评估过程中需结合多种指标共同检测,从而提高评估效能。
综上所述,Klotho,HE4,UMOD 均在慢性肾病患者血清中异常表达,其中血清Klotho,UMOD水平降低以及HE4水平增加可增加肾功能恶化风险,三种血清因子可为预后评估提供参考价值。
