基于Label-free技术探讨肌少-骨质疏松症与骨质疏松症患者骨组织差异蛋白的研究与分析
2021-04-16陈锦成朱国涛刘洪文余博飞陈彦丞罗骏秦晓飞徐杰
陈锦成 朱国涛 刘洪文 余博飞 陈彦丞 罗骏 秦晓飞 徐杰*
1.福建中医药大学中医骨伤及运动康复教育部重点实验室,福建 福州 350122 2.福建医科大学省立临床医学院(福建省立医院)骨科,福建 福州 350001
“肌少-骨质疏松症”(sarco-osteoporosis,SO)是当今世界各国老龄化社会正在面临的突出问题,肌少症(sarcopenia)的临床特征是的肌肉强度减退和(或)全身肌肉量占比减少或肌肉机能衰退[1-2],其病程与自然增龄密切相关。骨质疏松症(osteoporosis,OP)的临床特征是骨量逐步缩减、骨结构逐步退化和骨脆性事件增多,其属于系统性骨病的范畴,OP全身性退化常伴随的情况是骨折发生率的增高[3]。生物体是由蛋白质构成的,为了在蛋白水平更进一步研究肌少-骨质疏松症的病理机制,本研究团队从基因组学逐步深入到蛋白组学相关领域研究,重点开展差异蛋白之间的相互作用机制研究与功能信息分析;本研究团队采用Label-free定量蛋白组学手段对SO与OP患者骨组织样品蛋白定量和筛选差异蛋白以及差异蛋白功能分析[4],为SO致病机制研究奠定基础,以推动SO生物检测指标的确定、有效治疗药物和设备开发工作[5]。
1 材料和方法
1.1 纳入研究对象的基本资料
随机抽取在2017年8月至2018年8月期间于福建省医院骨二科行手术治疗的股骨颈骨折病人6例,自愿参与本临床研究,所有纳入的6例研究对象经告知研究方案后均能主动签署知情同意书;根据生物学重复原则选取SO组与OP组各3例,两个组的研究对象在族裔、性别和年龄等方面差异没有统计学意义。
1.2 临床病例纳入及排除标准
临床病例纳入及排除标准见表1。

表1 临床病例纳入及排除标准详情 Table 1 Details of inclusion and exclusion criteria of the clinical cases
1.3 样品取样
在手术台上切取两组研究对象骨组织样品(2~5 g),然后修剪成边长0.5 cm的小块(重量100 mg)装入小管中,液氮速冻5 min以上,保存于超低温-80 ℃(Eppendorf)冰箱中,样品用于后续上机定量蛋白检测与分析。术中采样统一由经验丰富的主任医师完成;本项目已申请并通过福建省立医院(本部)伦理委员会研讨与批准(审批编号:K2019-03-034)。
1.4 Label-free定量蛋白质组学分析
1.4.1试剂材料与设备:试剂材料与设备见表2。

表2 实验试剂材料与主要仪器设备 Table 2 Experimental reagent materials and main equipments
1.4.2提取总蛋白:骨组织样品从超低温(-80 ℃)冰箱的冻存盒中取出,先在液氮中研磨,然后用1.5 mL的EP 管将研磨好骨组织收集并标记好,加入蛋白裂解混合液(50 mmol/L Tris-HCl、8 mol/L尿素、0.2 %SDS、pH=8)以裂解骨组织样本;然后开启并预冷机器至4 ℃,12 000g离心至少15 min,收集上清,移液器吸取4倍上清体积的冷丙酮(含终浓度为10 mmol/L DTT)加入混合,沉淀2 h;再次4 ℃,12 000g离心时间为15 min,收集沉淀;加入800 μL 的冷丙酮(含终浓度为10 mmol/L DTT)重悬沉淀,清洗各种杂质;离心,收集沉淀,超净台内风干沉淀。加入600 μL 8 mol/L Urea(50 mmol/L Tris buffer,8 mol/L Urea,pH=8)溶解蛋白。骨组织蛋白样品进行BCA定量,科研笔记本记录实验定量结果。
1.5 蛋白质量检测
预制备好BSA标准品与待测样品液体,将G250工作液按试剂说明中微孔板法依次向标准品与待测样品孔中加入一定量,室温(37 ℃)孵育5 min,在酶标仪机器上的A595 nm波长位置检测吸光度值。准备好待测样品,取出20 μL稀释好的蛋白溶液,放置在96孔酶标板的其他位置,复孔3个。各组样品10 %SDS-PAGE电泳,用考马斯亮蓝对电泳后的凝胶进行处理、洗脱液反复洗脱、蛋白条带清晰后分析。
1.6 蛋白质酶解
从各实验样品中提取蛋白质约100 μg,加入2 μL胰酶(浓度:1 g/L)和500 μL TEAB(100 mmol/L)溶液;快速震荡和涡旋混匀,微量高速离心;放置在 37 ℃水浴中,过夜酶解16 h左右;次日取出,或冻存-20 ℃,或直接使用。
1.7 质谱上机进行液质检测
A液(100 %水+0.1 %甲酸)和B液(80 %乙腈+0.1 %甲酸)液体预制备;使用Q ExactiveTMHF-X(Thermo公司,型号:Easy nanoLC 1200)质谱仪进行原始数据质控并上机检测。
1.8 Uniprot蛋白质数据库检索
采用Proteome Discoverer线上软件(Thermo,版本2.2)开始蛋白质数据的检索与分析;将SO组和OP组之间蛋白定量差异显著的 (FC≥2.0,且P≤0.05时,标记为上调表达蛋白;当FC≤0.60,且P≤0.05时,标记为下调表达蛋白) 定义为差异表达蛋白。
1.9 差异蛋白信息分析
使用GO数据库(http://www.geneontology.org/)分别对SO组与OP组的细胞组分(CC)、分子功能(MF)和生物过程(BP)进行分析;在KEGG软件(http://www.genome.jp/kegg/)中进行差异蛋白的富集通路重点分析,旨在确定差异蛋白最主要参与哪些代谢途径和调控哪些相关的信号通路,还可以明确差异蛋白之间相互协调以启动其生物学行为发挥调控作用。
2 结果
2.1 Label-free质谱数据检测结果与差异蛋白分析
在SO组和OP组样品中共筛选出1 395个差异蛋白,定义为差异具有统计学意义的蛋白共30个,上调蛋白筛选出21个,下调蛋白筛选出9个(表3);对这30个蛋白进行差异分析可知有12个蛋白与代谢途径密切相关,还有一些重要的差异表达蛋白则参与了细胞氧化还原过程,部分差异表达蛋白可以通过氧化磷酸化途径激活氧化还原酶活性,这提示了提高机体成骨细胞和成肌细胞抗氧化活性对于延缓SO进程意义重大。此外,细胞骨架结构的重要成分如肌球蛋白轻链激酶2、骨调节蛋白前体微管蛋白β-1链,这些差异蛋白的激活在调节骨矿化、细胞外基质形成和调节细胞骨架组织以及在肌少症罹患骨质疏松症病程进展中扮演重要角色;根据SO组与OP组的蛋白差异分析结果绘制了火山图(图1);并运用聚类热图分析在组间比较的上调与下调差异蛋白表达水平(图2)。

表3 差异显著的蛋白质详细信息 Table 3 Details of significantly different proteins

续表3 差异显著的蛋白质详细信息Continued table 3 Details of significantly different proteins

注:横坐标log2值定为差异倍数,纵轴的-log10值则定为P-value,差异表达的阈值用黑色的虚线来表示(临界值=倍数变化>1.30或<0.83,P值<0.05);上调的蛋白则是红色散点来标记,下调的蛋白则是绿色散点来标记,还有差异无统计学意义的蛋白则用黑色散点来标记。图1 差异蛋白质火山图Fig.1 Volcano diagram of the differentially expressed proteins
2.2 GO功能富集分析
将筛选出的蛋白质运用GO数据库[6]进行重点分析其蛋白主要参与的生物过程、分子功能和细胞组分的作用;GO数据库注释结果显示,共3 322个蛋白质有GO注释结果,其中运用生物信息学方法和专业软件对鉴定到的差异表达蛋白进行GO富集分析,有856个属于BP,782属于CC,1 684个属于MF;通过注释结果可知这些差异蛋白可能参与细胞氧化还原稳态、氧化还原过程、氧化磷酸化过程及代谢过程等。
2.3 差异蛋白KEGG富集与功能分析
根据KEGG数据库[7]的注释结果,充分运用差异蛋白KEGG富集气泡图来梳理注释结果(图3);通过KEGG富集气泡图分析可知,SO组代谢途径与蛋白加工受到影响,从而影响蛋白质合成,最终可能会抑制成肌、成骨分化与增殖;此外,从SO组与OP组比较中得到的GO去除冗余结果的柱状图,经过分析也同样富集到差异蛋白的氧化还原途径与代谢途径相关的生物过程功能。
2.4 差异蛋白互作网络图分析
在基因测序的同时,越来越多的研究需要借助蛋白质组学来解释各种生物学现象。本研究团队使用String DB数据库系统分析了SO实验组(TB1)与OP对照组(CB1)之间的特征性蛋白互相关系与作用机制,并且以随机式互作网络图更直观和形象的呈现出来(图4)。
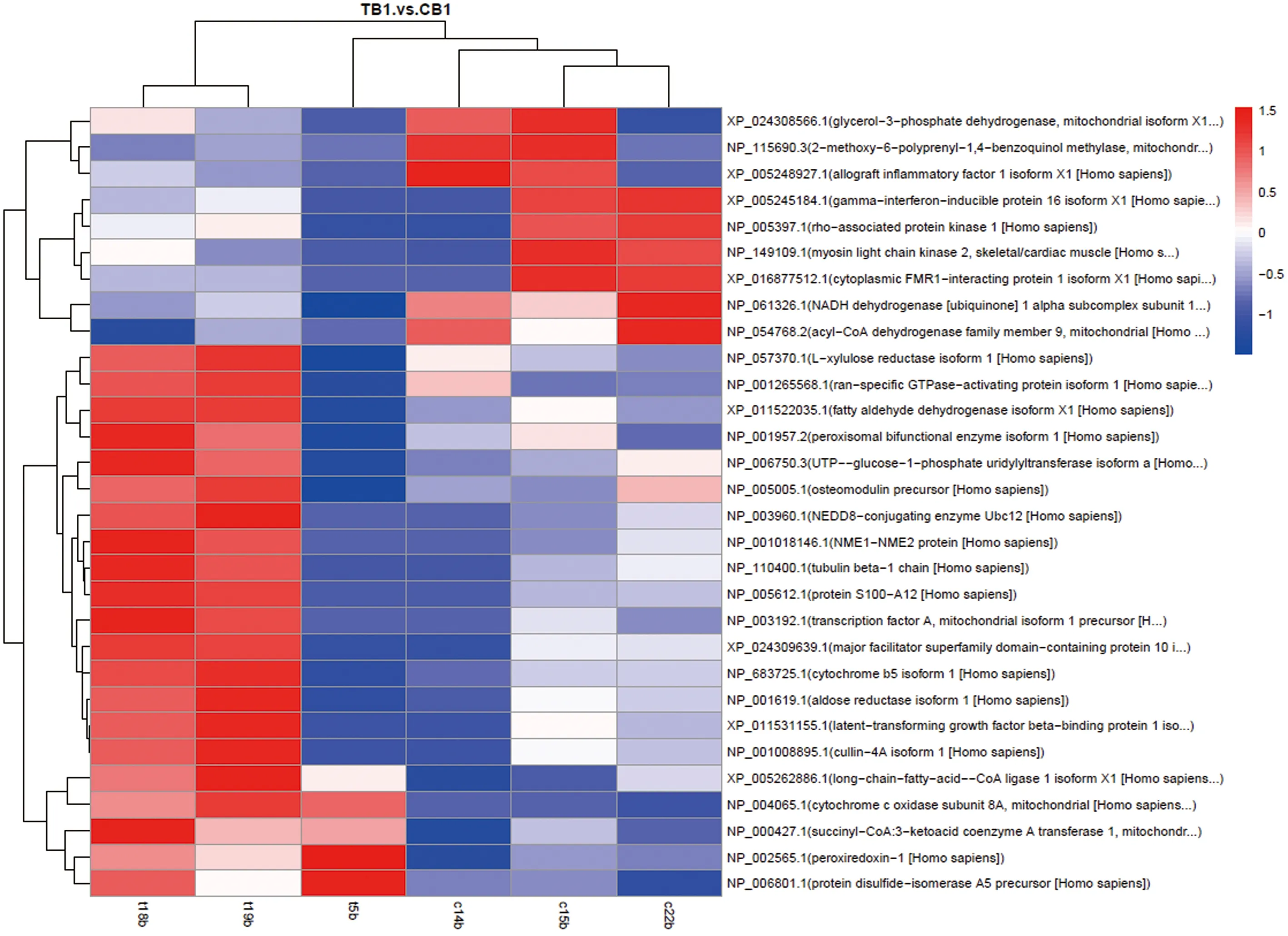
注:样品的聚类是纵向排列,蛋白的聚类则是横向排列,相似性越高则聚类枝越短;上调的蛋白对应红色标记,蓝色则表示下调的蛋白;蛋白质的表达水平则通过颜色强度来指示。图2 差异显著蛋白表达聚类热图Fig.2 Clustering heat map of significantly different protein expression

注:TB1表示:SO实验组;CB1表示:OP对照组;图中横坐标Ratio比值为所筛选的差异蛋白个数/共鉴定到总蛋白个数,差异蛋白在通路的富集程度的高低通过Ratio数值的大小反应;-log10(P-value)的值用不同颜色的小圆点表示,当检验越具统计学意义和可靠性越大时其值越小;相应通路中差异蛋白的数目通过点的大小来表示,当通路内差异蛋白越多则其相应的点越大。图3 KEGG富集气泡图Fig.3 KEGG enriched bubble chart

注:图中每一个蛋白用一个节点来表示,互作的蛋白越多则相应的节点越大;蛋白上调表达为红色节点,蛋白下调表达为蓝色节点。图4 蛋白相互作用网络图Fig.4 Diagram of the protein interaction network
3 讨论
本研究团队在SO与OP骨组织样品差异蛋白质谱研究中采用Label-free 技术(数据扫描模式:DDA)筛选与鉴定出过氧化物酶-1、潜在转化生长因子β结合蛋白1亚型X1、线粒体转录因子A (mitochondrial transcription factor A,TFAM)、细胞色素C氧化酶等4个差异蛋白,并通过结合文献资料梳理上述4个差异蛋白的具体作用机制和调控功能,旨在为进一步阐明肌少-骨质疏松症病理演变过程和临床诊治提供更多的基础研究数据。
颜晓芳等[8]研究发现当成骨细胞Wnt通路相关蛋白表达被抑制时,过氧化物酶增殖物激活受体γ(peroxisome proliferatorsa- ctived receptor γ,PPARγ)的活化水平会受到一定影响。老年性肥胖、高糖疾病状态下机体可引起PPARγ表达的上调,而PPARγ的激活伴随着Wnt相关蛋白的表达抑制,进而影响了成骨细胞骨形态发生蛋白等功能蛋白表达水平的降低,导致骨形成减少,最终加速OP的进程。自然增龄往往伴随着脂质氧化过程相关的PPAR基因调控功能的下调,机体成肌细胞的脂肪氧水平也随之下降,进而导致ATP合成缩减,最终影响肌肉的收缩功能[9]。邢丽等[10]也研究发现机体脂肪细胞的分化、胰岛素抵抗及骨代谢水平的变化和PPARγ表达水平密切相关。
转化生长因子-β1 (transforming growth factor-β1,TGF-β1)可以介导骨形态发生蛋白表达进而诱导成骨分化与骨形成,其可能是通过增强成骨细胞增殖能力与促进细胞分化成熟,以及增强机体基质钙化能力以加速修复骨损伤;TGF-β1的促细胞分裂与增殖作用的强弱会影响机体的间充质细胞、软骨细胞和成骨细胞数量的增减,这为骨组织再生修复提供了更多的物质基础[11]。Joyce等[12]研究发现TGF-β1可促进成骨细胞Ⅰ型胶原蛋白形成,以加快骨缺损机体自我修复。
线粒体转录因子A(mitochondrial transcription factor A,TFAM)与骨骼肌萎缩存在密切关系,TFAM的过表达对缓解肌萎缩有着积极的作用,宋银娟等[13]发现TFAM过表达会使线粒体内活性氧的产生减少,以保证线粒体的调控功能正常发挥[14]。Tasaki等[15]研究发现TFAM作为与骨骼肌萎缩重要的蛋白质分子之一,运动会促进TFAM表达,以提高线粒体的调控能力,从而防治肌少症。运动具体通过哪些分子机制以调控TFAM的表达,从而达到预防和治疗肌少症的问题仍有待深入研究。此外,欧阳剑锋[16]研究发现OP疾病状态下往往伴随氧化应激水平的高表达,此时OP患者体内TFAM 表达水平会有所降低,一但缺少TFAM保护,被氧化损伤的线粒体转录DNA在机体内的数量将会增加,此时,缺少了修复酶对损伤线粒体转录DNA的逐步修复,则线粒体调控作用失常,由此证明OP的演变过程可能和TFAM表达下调引起的线粒体转录DNA 拷贝数的多少有重要关联。
细胞色素氧化酶(cytochrome oxidase,COX)主要参与细胞的氧化磷酸化过程,并且在机体内会影响细胞氧化磷酸化对其相对应下游靶基因的调控作用[17]。众所周知,氧化代谢过程是维持骨骼肌功能所必需的,而这种代谢的重要成分是COX,即线粒体电子传输链的13个亚基末端复合物[18]。李颖等[19]研究骨骼肌与OP的关系,创新性提出肌肉线粒体内通透转换孔(MPTP)的表达水平可能与OP病理过程有密切关系,研究中发现OP患者肌肉中MPTP的通透性明显偏高,其中MPTP通透性水平高低受COX的活性介导;因此,保持COX的活性对于有效控制MPTP的变化意义重大,可以有效实现延缓细胞的衰老进程。此外,刘庆浩[20]发现COX的活性与肌细胞的凋亡有一定联系,而肌细胞的衰退有可能加速肌少症的到来并诱发骨质疏松,综上,研究者认为COX的活性与SO的发生发展有密切关系,但其复杂的分子机制需深入研究。
SO属于肌肉-骨骼系统疾病,差异蛋白PPARγ在维持成骨细胞与破骨细胞的平衡体系中发挥重要作用。TGF-β1参与调控骨形态发生蛋白表达过程,可为机体骨骼修复过程提供必要的物质基础。TFAM的主要作用是参与了氧化应激过程,深入研究其是否参与氧化和抗氧化的疾病过程将为揭示OP的氧化应激具体分子机制提供更多可能;此外,COX参与了骨骼肌功细胞的氧化代谢过程,并且在肌少-骨质疏松症骨组织样品中存在显著差异表达,提示其可能也同时参与了OP的成骨细胞氧化代谢过程。
综上,本研究团队运用Label-free质谱筛选技术在SO上进行蛋白质谱数据采集与研究分析,并且初步筛选出过氧化物酶-1、潜在转化生长因子β结合蛋白1亚型X1、线粒体转录因子A、细胞色素C氧化酶等4个差异显著的蛋白,这些差异蛋白可能参与调控着SO发病的全过程;此蛋白质谱研究结果将为后续开展有关肌少-骨质疏松症细胞或动物的实验研究提供了更多思路与方向。
