TNF-α介导绝经后骨质疏松症发病机制的研究进展
2021-04-16姚娜李鹏程耿春梅俸玉宋艳萍陈红波张瑾范秦瑶黄丽陈奇刚
姚娜 李鹏程 耿春梅 俸玉 宋艳萍 陈红波 张瑾 范秦瑶 黄丽 陈奇刚*
1.云南中医药大学,云南 昆明 650500 2.昆明市中医医院,云南 昆明 650505
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是由于妇女绝经后雌激素水平降低引起的相应免疫功能变化及炎症反应,导致骨重建平衡失调的代谢性骨病[1]。李淼等[2]研究报道,骨代谢相关因子在治疗早期(3~6个月)可灵敏地监测出骨代谢水平。肖华等[3]通过进一步证实细胞因子水平能反映骨量丢失率和骨破坏水平,TNF-α作为促骨吸收的细胞因子,了解其与PMOP的关系,可深入了解PMOP的发病机制,为治疗及预防PMOP提供新方向。
1 TNF-α概述
TNF-α是一种具有多功能的细胞因子,主要由单核-巨噬细胞、B细胞、NK细胞、T细胞、内皮细胞等分泌产生,它在炎症反应、细胞免疫、低氧及骨代谢异常等多种生理和病理过程中均起着关键的作用[4-5]。研究[6-7]表明,TNF-α的表达水平可作为临床上监测机体应激、免疫、炎性反应的有效指标。TNF-α可直接或间接作用于破骨细胞前体细胞,增强骨吸收,影响骨重建;也可通过调节其他组织代谢活性并促使其他细胞因子的合成和释放影响骨微环境、加剧氧化应激反应;此外还通过调节机体免疫影响PMOP的发生、发展[8-9]。Murad等[10]研究结果显示TNF-α与BMD呈负相关,证实血清TNF-α水平可作为评价骨质疏松症和未来脆性骨折风险的较好指标。
2 TNF-α调控绝经后骨质疏松的机制
雌激素水平下降是导致PMOP发生的重要原因,关键是绝经后妇女因雌激素分泌减少引起相应的免疫功能增强,促进T细胞的激活与增殖,引起TNF-α分泌增多,从而导致骨重建失衡[11]。TNF-α可通过多途径调控骨细胞、免疫细胞的增殖、分化,决定骨重建方向。TNF-α通过调节机体骨代谢、免疫、炎症反应、氧化应激反应等调控骨代谢参与PMOP的发生、发展。机制如图1所示[12-14]。(1)TNF-α增强免疫反应,增强机体免疫功能,促进免疫细胞增殖、分化,直接调控破骨细胞与成骨细胞的增殖、分化,促进骨代谢,导致PMOP;(2)TNF-α可刺激其他炎性因子分泌,加剧炎症反应,影响骨代谢微环境,调控破骨细胞与成骨细胞的增殖、分化,促进骨代谢,导致PMOP;(3)TNF-α加剧氧化应激反应,介导破骨细胞与成骨细胞的增殖、分化,从而促进骨代谢,导致PMOP。
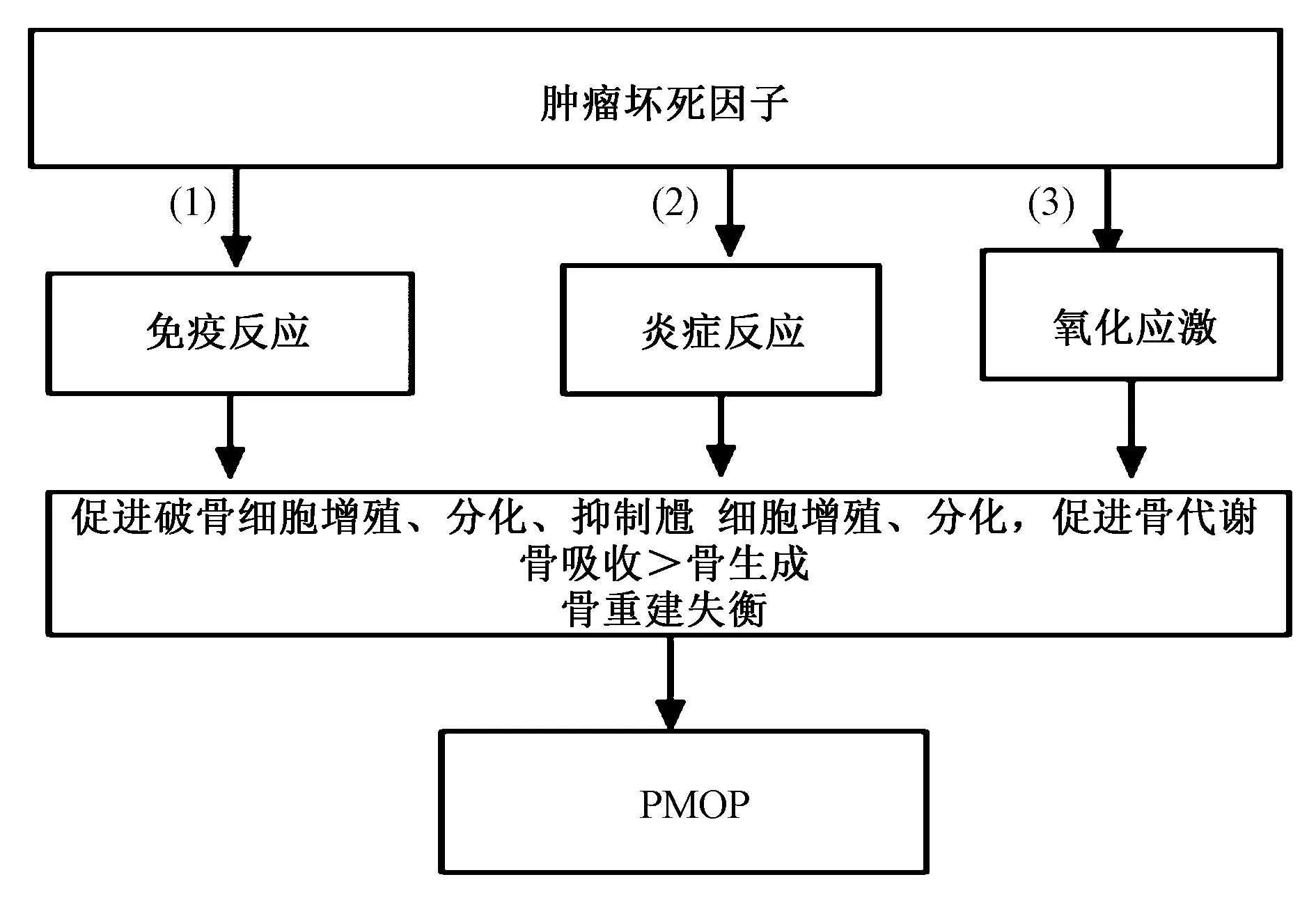
图1 TNF-α介导PMOP的机制Fig.1 The mechanism of TNF-α mediated PMOP
3 TNF-α对骨代谢的影响
TNF-α是目前发现的最强的骨吸收诱导剂之一,与骨质疏松症关系最为密切,可通过直接调节破骨细胞及成骨细胞的增殖与分化,影响骨代谢;还可通过损伤肾血管-基底膜屏障,导致血管通透性升高,使肾小管吸收钙、磷下降,肾脏的钙、磷转运障碍,从而导致骨钙、磷的代谢失调和肾脏羟化酶活性下降,影响骨代谢[15]。
3.1 TNF-α对破骨细胞影响
TNF-α由破骨样细胞和成骨细胞合成,是强效的骨吸收刺激因子[16]。马赫等[17]研究确定了TNF-α与破骨细胞(osteoclast,OC)的形成存在着正相关关系,TNF-α通过影响OC的增殖、分化、生存进而影响骨代谢,主要通过以下途径作用于OC,促进骨吸收,具体如图2所示[8,18-19]。(1)TNF-α通过刺激巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、白介素-6、前列腺素E2(PGE2)的释放,促进OC前体细胞分化及成熟;(2)TNF-α通过增加破骨细胞上V-ATP酶的表达,从而加强破骨细胞的骨吸收活性;(3)TNF-α通过激活成骨细胞和基质细胞核因子κB受体活化配体(receptor activator of NF-κB ligand,RANKL)的活性间接刺激OC生成;(4)TNF-α通过JNK途径、NF-κB途径、PI3K/Akt等信号传导途径通过OPG/RANKL/RANK系统来促进OC的分化。

图2 TNF-α调控破骨细胞分化途径Fig.2 TNF-α regulates the differentiation pathway of the osteoclast
目前,TNF-α调控破骨细胞增殖、分化、加强骨吸收活性的机制尚未完善,可进一步研究其对破骨细胞密切相关的细胞及受体的影响,以及TNF-α的调控通路。
3.2 TNF-α对成骨细胞的影响
成骨细胞(osteoblast,OB)既是TNF-α的效应细胞,又是TNF-α的产生细胞,TNF-α抑制成骨主要通过抑制骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的成骨分化、成骨细胞矿化[20]。侯君艺等[21]报道,TNF-α对成骨分化起双重作用,主要取决于其浓度、处理时间以及细胞类型。TNF-α主要通过以下途径影响成骨细胞的增殖与分化,如下图3所示[22-25]。(1)TNF-α可通过Wnt、NF-κB等信号通路影响干细胞的成骨分化;(2)TNF-α对BMSCs的成骨分化起负性调节作用,可抑制成骨细胞分化增殖的关键因子Runt相关转录因子2(Runx2)的表达;(3)TNF-α通过抑制叉框蛋白1(FoxO1)转录,从而抑制BMMSCs,引起成骨细胞分化障碍;(4)TNF-α通过抑制骨形成的关键信号途径Wnt/β-catenin负向调控Sema3B的表达,抑制MSCs向成骨细胞分化。
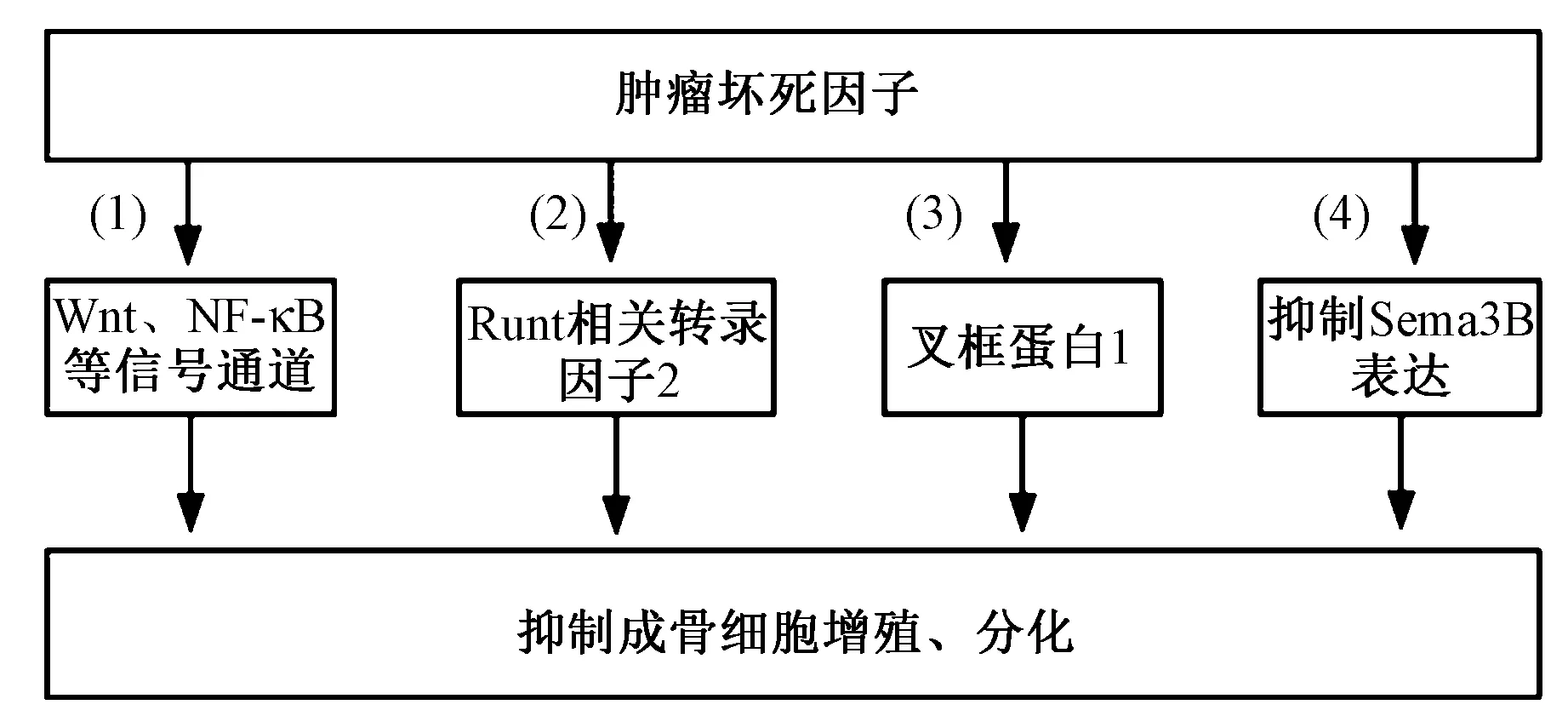
图3 TNF-α抑制OB增殖、分化Fig.3 TNF-α inhibits the proliferation and differentiation of the osteoblast
TNF-α对成骨分化的调控途径较多,主要通过抑制BMSCs分化,从而引起成骨细胞的分化障碍,导致PMOP,其调控机制较为复杂,可存在相互交错的部分,仍需进一步研究。
4 TNF-α对免疫反应的影响
细胞因子与淋巴细胞在骨代谢过程中相互协同或相互制约,淋巴细胞产生一系列细胞因子,参与骨代谢,同时这些细胞因子又可相互作用,并反过来影响淋巴细胞的功能[26]。TNF-α是免疫系统的产物,在免疫反应中发挥多种作用,通过免疫信号通路的反馈调节,影响骨代谢,具体途径如图4示[14,27-29]。(1)免疫反应增强,激活T淋巴细胞分泌促骨吸收因子TNF-α、RANKL的产生;(2)TNF-α的增多,免疫系统活化,淋巴细胞分泌增加;(3)TNF-α直接作用于破骨细胞,促进破骨细胞增殖、分化,导致PMOP;(4)TNF-α通过作用于成骨细胞和基质细胞增加RNAKL和M-CSF的表达促进破骨细胞生成,导致骨吸收增加,导致PMOP;(5)TNF-α增加骨髓单核/巨噬细胞系前体细胞对RANKL的反应性,促进破骨细胞的形成和活化,促进破骨细胞骨吸收活性,导致骨吸收增加,骨量减少,形成PMOP。

图4 TNF-α介导免疫反应调节骨代谢Fig.4 Regulates of bone metabolism by TNF-α mediated immune response
骨与免疫系统有着复杂的调控机制,免疫细胞分泌细胞因子可直接调节OB与OC的增殖与分化,影响骨代谢,反之细胞因子分泌增多时会促进免疫细胞分化,加速骨吸收。
5 TNF-α对炎症反应的影响
TNF-α是炎症反应过程中最早出现、最重要的炎性介质,是炎症信号级联反应的启动因子,可激活淋巴细胞及中性粒细胞,增加血管内皮通透性,诱导并促进其他炎性因子释放,加剧炎症反应[30]。持续激活的微炎症状态是绝经后重要的病理改变,是骨密度下降的重要原因,也是骨微结构破坏的重要病理因素[31]。TNF-α通过以下途径作用于炎症反应,调控骨代谢,具体如图5所示[32-35]。(1)TNF-α可促进干细胞合成和释放IL-6等炎性因子,促进炎症发展,影响骨代谢微环境,促进破骨细胞增殖、分化,导致PMOP;(2)TNF-α可活化炎症细胞,诱导白细胞介素-1、白介素-6等的分泌,直接刺激破骨细胞祖细胞分化为成熟破骨细胞,促进骨吸收,导致PMOP;(3)TNF-α可促进相关组织水解酶、前列腺素E2等的释放,导致疾病组织结构破坏,导致PMOP。

图5 TNF-α对炎症反应的作用及调节骨代谢Fig.5 The effect of TNF-α on inflammatory response its regulation on bone metabolism
TNF-α作为炎性因子刺激其他炎性因子加剧炎症反应,影响骨代谢微环境,促进破骨细胞增殖、分化,破坏骨微结构,加速PMOP的发生。
6 TNF-α对氧化应激反应的影响
氧化应激可导致PMOP的发生。氧化应激可促进TNF-α分泌增多,TNF-α作为机体应激反应产生最早的、最核心的炎症介质,可诱发机体代谢增强、血流动力学明显变化、促进炎症介质生成,增加炎症效应[17]。TNF-α通过促进氧化应激反应,直接或间接的调节骨重建方向,具体途径如图6所示[14,36-37]。(1)TNF-α可抑制具有抗氧化应激作用的Fox O1,抑制BMSCs分化,影响骨重建;(2)TNF-α可通过激活产生活性氧(reactive oxygen species,ROS)的还原型烟酰胺腺嘌呤二核苷酸磷(reduced nicotinamide adenine dinucleotide phosphate,NADPH),发挥促氧化作用,抑制超氧化物歧化酶(superoxide dismutase,SOD)抗氧化作用从而促进氧化应激的产生;(3)TNF-α能增强不同组织细胞的ROS活性,促进氧化应激反应。

图6 TNF-α调节氧化应激反应Fig.6 TNF-α regulates the oxidative stress response
程韵等[38]发现ROS能够通过激活ERK、JNK、NF-κB等信号通路,上调RANKL、TNF-α的表达,下调OPG的表达,提高骨吸收功能,间接地影响骨重建过程。由此证明,TNF-α通过调节ROS的活性,提高骨吸收功能,ROS亦能调节TNF-α的表达,间接的影响骨重建,两者相互相互影响,协调影响骨代谢。
7 总结与展望
TNF-α作为骨骼系统与免疫系统共享的细胞因子,通过增强机体免疫、增加炎症反应、促进氧化应激反应,直接或间接的调节骨代谢,改变骨重建方向,参与PMOP的发生、发展过程。同时免疫系统活化、炎症反应、氧化应激反应的加剧会增加TNF-α的表达,它们相互调节,协同影响PMOP进程。因此,TNF-α在绝经后骨质疏松症的诊断和治疗中有着重大意义。但其作用机制尚未研究完善,可从TNF-α不同生物功能特性,不同信号通路等深入研究,进一步完善其调节绝经后骨质疏松症的机制,探究如何有效地将TNF-α作为靶点治疗绝经后骨质疏松症。
