金银花根际土壤真菌群落多样性及其土壤影响因子研究
2021-04-16刘世鹏江林春韦洁敏白尚尚崔浪军
刘世鹏,江林春, 韦洁敏, 白尚尚,崔浪军
(1.延安大学生命科学学院,陕西 延安 716000;2.西北濒危药材资源开发国家工程实验室,药用资源与天然药物化学教育部重点实验室,陕西师范大学生命科学学院,西安 710119)
金银花(Lonicerajaponica)又名二花,花初开为白色,后转为黄色,因此得名金银花。忍冬最早出现于东晋葛洪著于《肘后备急方》[1],“金银花”一名出自《本草纲目》[2],首次以金银花入药记载于《救荒本草》[2]。药材金银花为忍冬科忍冬属植物忍冬及同属植物干燥花蕾或带初开的花[3],为传统大宗药材之一,其性味甘寒,气味芳香,入肺经、心经和胃经[4],具有清热解毒、广谱抗菌、通经活络等功效。传统意义上金银花具有清热解毒、疏散风热等功效,临床上用于治疗温病发热、风热感冒、咽喉肿痛、肺炎、丹毒、蜂窝状组织炎、病疾等多种疾病[5],属于中医临床上清热解毒的首选药物。现代研究表明,金银花主要含有挥发油类、黄酮类和有机酸类等成分,具有解热抗炎、抗菌、抗病毒、抗氧化、保肝利胆等作用[6],其中含有的绿原酸是抗菌消炎的主要有效成份,对金黄葡萄球菌、溶血性链球菌、痢疾球菌、肺炎球菌有显著的抑制作用,因此成为中医治疗SARS和流感等病毒病时应用的药材。同时,金银花又是香料、化工和保健食品的主要原料之一[7]。
金银花主产于我国河南、山东、河北等地,且以河南产“密银花”“封丘金银花”与山东产“济银花”较为道地[8], 河南的“密银花”和山东的“济银花”最为著名[9]。此外,四川、广西、江西、江苏、陕西和甘肃等地均有野生[10]。同时相关研究表明,金银花属多年生半常绿缠绕及匍匐茎灌木,适应性强、抗逆性强,对土壤要求不严,根系繁密发达,萌蘖性强,茎蔓着地即能生根,观赏和水土保持价值高[11],栽培金银花可有效改善土壤理化性质,防治水土流失,培肥土壤地力[12],是一种极具开发潜力的生态、环保、经济型植物,和秦巴山区改善生态环境、推动经济发展的药材品种。近年来,许多学者对金银花化学成分、药理、种质与良种选育、规范化种植等技术进行了大量研究,取得了丰硕成果,但没有关于金银花自然状况下根际土壤理化性质、真菌多样性与群落结构的变化对金银花田间管理与野生抚育方案的影响这方面的报道[13]。由于对药用植物种植保护的影响,特别是考虑到正在发生的气候变化,研究适宜种植地的药用植物(如金银花)与相关的微生物之间的相互作用正变得越来越重要。基于此,本文系统研究了金银花6年生根际土壤化学性质和土壤真菌群落结构的变化规律,分析了二者的相互关系,为商洛乃至秦巴山区金银花的科学田间管理与野生抚育方案的确定提供一定的理论指导。
1 材料和方法
1.1 试验样地概况
金银花实验样地位于陕西省商洛市柞水县下梁镇西川农业示范产业园,属于秦岭南麓,气候为暖温带间凉亚热带过渡性气候,该区域年均日照1 860.2 h,年均气温12.4 ℃,最冷月平均气温0.2 ℃,最热月平均气温23.6 ℃。极端最高气温37.1 ℃,最低-13.9 ℃,无霜期209 d,年降水量742 mm,四季分明,温暖湿润,夏无酷暑,冬无严寒,宜长、短日照和需不同温湿度的植物发育生长。
1.2 土壤样品的采集
2019年7月在金银花试验园中选取自然生长状况下6 a生金银花根际土壤(Y6)样本作为研究对象,选择距离金银花居群根际较远的空地样品(下文称非根际土壤) 作为对照组(CK)。在金银花居群采样时, 通过五点采集法,以金银花树主茎为中心在半径约 20~30 cm 的范围内取土, 取土深度为0~25 cm, 采集对照组样品时,选择5处距离金银花居群根际较远的空地进行采样,采样深度为0~25 cm。土样采集完毕后混匀装入无菌的牛皮纸袋中, 放入冰盒内带回实验室[14]。去除土壤中的残留根系、石块、其他杂质并过2 mm孔径筛子后, 将土壤一部分自然风干用于测定土壤化学性质,另一部分低温保存于-80 ℃超低温冰箱内,用于后续土壤微生物真菌多样性的确定。
1.3 土壤化学性质测定
土壤中大量与微量元素含量的测定采用PW2403型X-Ray荧光光谱仪(Brukers8,德国),土壤铵态氮、硝态氮以及磷酸盐的含量测定采用Smart Chem300全自动间断化学分析仪(Westco SmartChem300) ,具体操作参照仪器生产商提供的参考方法。
1.4 高通量测序
利用土壤专用DNA提取试剂盒(MOBIO Power Soil DNA Isolation Kit,USA) 提取样本基因组DNA后,测定总DNA浓度,并利用1%的琼脂糖凝胶电泳检测总DNA提取质量。选择质量合格的DNA样品进行真菌ITS区Paired-end测序,由北京百迈客科技有限公司完成文库制备、均一化、检测、上机测序及数据质量控制等工作。数据分析参考张玥等人[15]的方法。
1.5 数据处理与分析
主要使用SPSS 19.0和Microsoft Excel 2010对结果进行处理与生物信息学分析。
2 结果与分析
2.1 根际与非根际土壤化学性质
根际土壤化学性质测定结果表明(表1),金银花根际土壤的NH3-N、A-P、S含量达到非根际土壤的2倍左右,差异达到显著 (P<0.05)。非根际土壤中微量元素Fe3+、Mn2+、Zn2+的含量要比根际土壤中的含量高,无显著差异(P>0.05)。
2.2 样品测序深度评估
通过Illumina HiSeq测序平台对6个真菌样品测序,序列优化后最终得到优质序列90 283条,有效序列的长度主要分布在191~310 bp区段内,其中221~250 bp区段内分布最多。基于97%相似性水平,将随机抽取测序序列所得序列数与它们所能代表OTU数目构建稀释曲线,聚类OTU并制作各样品的稀释曲线(图1) ,以此可评估测序数据量是否足够[16]。两份样品的稀释性曲线均显示随着随机抽取的样本真菌测序量不断增大,各样品OTUs数目的增加趋于平坦,说明测序深度基本可以反映样品中绝大多数的微生物信息。

图1 2组样本中真菌测序的稀释曲线
2.3 根际与非根际土壤真菌数量分析
由不同样品OTU数量关系 Venn 图(图2) 可见,2组样品中共获得795个真菌OTUs。其中,根际土壤674个,非根际土壤576个。非根际土壤和根际土壤中所独有的OTU数量分别为121和219,2组样品共有的 OTU有455个。

图2 根际与非根际土壤真菌OTU的Venn图
2.4 根际与非根际土壤真菌Alpha多样性分析
对指示群落结构变化的4个Alpha多样性指数ACE、Chao1、Simpson和Shannon指数进行组间差异性分析。结果(表2)显示,Y6组中ACE和Chao1指数显著高于对照组(CK),其余各组间多样性指数均无显著性差异,其中CK、Y6的土壤真菌ACE指数分别为424.25、522.97。 从Chao1指数分析来看,Y6组(534.54)的土壤真菌物种丰富度较CK组高;从Shannon指数分析来看,Y6组(4.43)的土壤真菌物种多样性高于CK(4.25)。

表2 根际与非根际土壤真菌群落Alpha指数
2.5 根际与非根际土壤真菌群落组成的比较分析
根际土壤样本中真菌群落的主成分1(PC1)和主成分2(PC2)的样品差异性贡献率分别达到75.89%和13.49%(图3)。Beta多样性分析表明:非根际土壤(CK)与树龄6 a的金银花树根际土壤(Y6)的真菌群落有差异。
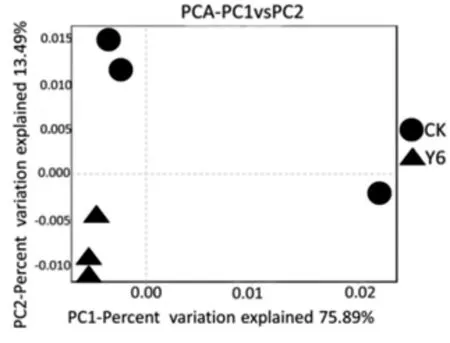
图3 根际与非根际土壤真菌群落的主成分分析(PCA)
2.6 根际与非根际土壤真菌群落组成
物种组成分析反映样品在不同分类学水平上的群落结构,图4(a)和图4(b)分别展示科水平和属水平的群落结构和分类比较结果,由此可知,CK与Y6土壤根际真菌在科水平和属水平的相对丰度分布差异较大,与主成分分析(PCA)结果(图3)一致。 在科的水平上,鉴定出曲霉科Aspergillaceae(13.11%)、毛壳菌科Chaetomiaceae(10.96%)、肉座菌科Hypocreaceae(5.17%)、Piskurozymaceae(3.87%)、赤壳科Nectriaceae(9.81%)、Ophiocordycipitaceae(1.02%)、Plectosphaerellaceae(2.96%)在CK中的相对丰度较大;被孢霉科Mortierellaceae(11.15%)、枝孢霉科Cladosporiaceae(3.04%)、麦角菌科Clavicipitaceae(3.43%)、Peniophoraceae(8.23%)、Trichomeriaceae(1.25%)、Hyaloscyphaceae(0.88%)在Y6中的相对丰度较大。在属水平,鉴定出20个属,曲霉属Aspergillus(12.16%)、尖孢镰刀菌属Fusarium(2.42%)、Fusicolla(0.89%)、赤霉菌属Gibberella(0.86%)、腐质霉属Humicola(4.38%)、Plectosphaerella(2.02%)、Purpureocillium(0.89%)、Solicoccozyma(3.78%)、Tausonia(3.04%)、木霉属Trichoderma(5.17%)在CK中的相对丰度较大;青霉菌属Penicillium(1.32%)、被孢霉属Mortierella(11.15%)、Subulicystidium(8.23%)、Knufia(1.20%)、枝孢霉属Cladosporium(11.15%)、Metarhizium(3.20%)、Mrakia(3.41%)、Pleurotheciella(0.97%)在Y6中的相对丰度较大。
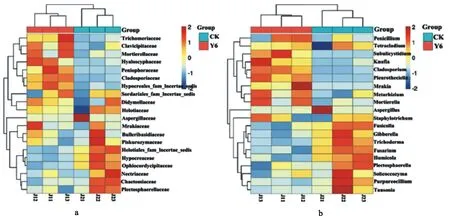
图4 根际与非根际土壤真菌群落科水平(a)与属水平(b)丰度聚类热图
2.7 组间差异显著性分析
LEfSe能够在不同组间寻找具有统计学差异的真菌种类。进化分支图由内至外辐射的圆圈代表了由门至种的分类级别;在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比;着色原则为将无显著差异的物种统一着色为黄色,其他差异物种按该物种所在丰度最高的分组进行着色[15]。2组样品中LEf Se分析进化图(图5)显示,在非根际土壤(CK)、根际土壤(Y6)中共具有15种显著差异的菌种,其中Y611种,CK4种。 从物种分类看,目水平下有2种,科水平下有4种,属水平下有5种,种水平下有4种。

图5 根际与非根际土壤真菌群落Lefse分析进化分支图
2.8 土壤化学因子对土壤真菌群落多样性的影响
选取的6个环境因子对金银花根际土壤真菌群落组成都有一定程度的影响(表3)。根际土壤NH3-N、A-P与土壤真菌物种丰富度呈极显著正相关(P<0.01),S与土壤真菌物种丰富度呈显著正相关(P<0.05) ,Fe3+、Zn2+与土壤真菌物种丰富度呈显著负相关(P<0.05)。

表3 根际土壤真菌多样性影响因子汇总表
2.9 真菌群落结构与土壤化学性质相关性分析
RDA分析反映菌群与化学环境因子之间的关系,真菌RDA的累计贡献率RDA1 39.24%,RDA2 21.18%(图6)。影响按大小排序:A-P>NH3-N>S>Zn2+>Fe3+。Solicoccozyma、Tausonia、木霉属Trichoderma、尖孢镰刀菌属Fusarium、曲霉属Aspergillus和腐质霉属Humicola与A-P、NH3-N、S呈负相关,与Fe3+、Zn2+呈正相关;被孢霉属Mortierella、Subulicystidium和Metarhizium则相反,与A-P、NH3-N、S呈正相关,与Fe3+、Zn2+呈负相关。
3 结论与讨论
3.1 金银花根际与非根际土壤的化学性质
土壤作为金银花树养分吸收及储藏的载体,土壤肥力指标的变化对于金银花树的生长、金银花的产量及其品质具有一定的影响。本研究结果表明,金银花根际土壤的NH3-N、A-P含量达到非根际土壤的2倍左右,差异达到显著 (P<0.05)。有文献证明[17], 根际的微生物种群不断地接触到来自根的低分子量和高分子量有机质,可能会影响特定的物理化学和生物条件、微生物活动以及根际土壤微生物群落结构。说明随着生长年限的增加,凋落物的质量和数量会通过改变植物群落组成而改变,从而来影响凋落物的分解;通过改变土壤环境及其生物活性,进而启动旧的稳定有机质分解,从而促使N、P的含量增加。王海斌等[18]研究发现,茶树根系分泌有机酸改变根际土壤理化性质,使根际土壤磷酸盐有效性提高,利于茶树对磷的吸收和品质改善,与本文研究结果一致。

图6 土壤化学性质与真菌群落(属水平)的冗余分析
土壤中的微量元素是土壤的重要组成成分,是表征土壤质量的重要因子,在促进作物生长代谢及提高产量与品质方面具有十分重要的作用[19],它的组成及其变化特征直接反映了土壤发育、成土及其演化过程。此外,微量元素参与许多酶系统的活动,在氮、磷、碳的代谢过程中以及在生物氧化过程中均有微量元素参与。呼吸作用、光合作用、碳水化合物的运转均离不开微量元素。在本研究中,根际土壤中Fe3+、Mn2+、Zn2+等微量元素含量较非根际土壤低,也侧面说明了金银花植株在生长过程中需要从土壤中大量吸收这些微量元素进行呼吸作用等以满足其生长所需。
3.2 金银花根际与非根际土壤真菌的多样性
成熟的土壤肥力是依靠微生物的不断活动来保持的。通过热图分析,样品间的优势真菌科与属差异显著。真菌群落的明显分化和聚类表明根际土壤和非根际土壤具有不同的真菌群落。
被孢霉科Mortierellaceae、枝孢霉科Cladosporiaceae、麦角菌科Clavicipitaceae、Peniophoraceae、Trichomeriaceae、Hyaloscyphaceae在根际土壤(Y6)为优势科,而曲霉科Aspergillaceae、毛壳菌科Chaetomiaceae、肉座菌科Hypocreaceae、Piskurozymaceae、赤壳科Nectriaceae、Ophiocordycipitaceae、Plectosphaerellaceae在CK中为优势科。赤壳科Nectriaceae隶属肉座菌目,已有研究发现归属于子囊菌门的肉座菌目具有降解腐烂有机质,降解纤维素的作用[15],毛壳菌科Chaetomiaceae隶属于炭角菌目,营腐生,也是有较强分解纤维素能力的类群[20]。青霉菌属Penicillium、被孢霉属Mortierella、Subulicystidium、Knufia、枝孢霉属Cladosporium、Metarhizium、Mrakia、Pleurotheciella在根际土壤(Y6)中为优势属,曲霉属Aspergillus、尖孢镰刀菌属Fusarium、Fusicolla、赤霉菌属Gibberella、腐质霉属Humicola、Plectosphaerella、Purpureocillium、Solicoccozyma、Tausonia、木霉属Trichoderma在非根际土壤(CK)中为优势属。其中,尖孢镰刀菌属Fusarium是引起枯萎病的主要病原菌属[21-22]。分子孢子菌属Cladosporium真菌是一种室内和室外都常见的霉菌,为腐生真菌,广泛存在于自然界的土壤、某些动物的粪便、蔬菜、腐木、鸟巢、腐烂水果中[23],会导致果实腐烂[22]。腐质霉属Humicola真菌是土壤中常见的腐生菌,广泛分布于世界各地的各种土壤,尤其是有机质丰富的土壤,部分种类也分布于植物残体、木材或人体等[24]。被孢霉属Mortierella是土壤中有益微生物,具有溶解土壤中磷的功能[25],并且能够通过提供氮营养和提高植物的抗病性促进植物的生长,可能与植物的糖代谢有关[26]。
吴佳徽[27]研究表明,植物根系的分泌物为根际微生物提供了丰富的营养和能量,因此植物根际微生物数量和活性常高于非根际土壤,使得植物根系表现出特定的“根际效应”。由于根际效应的存在,根际微生物的数量大于非根际微生物[21]。由于植物的根排斥某些细菌和真菌,并促进其他代表其物种特异性伙伴的建立,包括有益细菌和菌根真菌[28-30]。所以青霉菌属Penicillium、被孢霉属Mortierella、枝孢霉属Cladosporium等对植物有益的真菌属在根际土壤中的数量和活性要高于在非根际土壤中。
3.3 影响金银花根际与非根际土壤真菌多样性的因素
张泽[31]研究发现,土壤微生物在有机质分解、养分运转、土壤结构维持和土壤污染物净化等方面发挥重要作用的同时,微生物自身还含有一定数量的N、P、S等,对土壤肥力的提高有重要作用。邓大豪等[32]研究表明,在香蕉种植地土壤微生物多样性及其对土壤理化性质的响应中,以真菌途径为主的土壤有利于存贮有机质和固态氮,氮和能量转化较缓慢。这些研究结果均与本研究中NH3-N、A-P与土壤真菌物种丰富度呈极显著正相关关系,S与土壤真菌物种丰富度呈显著正相关(P<0.05) 关系结论一致。Fe3+、Zn2+与土壤真菌物种丰富度呈显著负相关(P<0.05) 关系,也印证了根际土壤中的真菌物种丰富度较非根际土壤大。
RDA分析主成分 RDA1、RDA2,贡献率分别为39.24%和21.18%,表明并非单一土壤理化性质能够显著影响土壤微生物的群落结构和物种组成,而是综合因素共同作用的结果。同时本研究表明,金银花根际土壤中真菌的丰富度和多样性与土壤的化学特性有关。
王西锐等[21]研究发现,植物的根际微生物能够合成微生物生长发育所需的生长素类物质,如酵母促生素、硫胺素、核黄素和维生素等,而使土壤微生物数量上升,所以金银花树根际土壤的真菌数量比非根际多,也可认为金银花树的根际微生物能够合成微生物生长发育所需的生长素类物质,再由输入土壤生态系统的金银花植物枯落物与土壤中其他物质一起被土壤中的微生物降解,对土壤中的微生物活性产生刺激或抑制作用,金银花树根系分泌N、P、S等提高土壤肥力的同时对Solicoccozyma、Tausonia、木霉属Trichoderma、尖孢镰刀菌属Fusarium、曲霉属Aspergillus、腐质霉属Humicola等有害真菌有抑制作用,而刺激被孢霉属Mortierella、Subulicystidium、Metarhizium等土壤微生物生长,进而引起土壤微生物多样性发生改变。
已有文献表明[33],真菌在改善土壤质量方面具有一定作用,本论文研究亦得出了这样的结论,金银花植物根系与真菌丰度和群落相互作用显著相关,金银花植物根系是改变真菌丰度和相互作用的最重要因素。
