接受单孔胸腔镜肿瘤切除术治疗非小细胞肺癌患者术后出现持续性咳嗽的危险因素
2021-04-16钱鹏朱峰马冬春葛腾飞王路郭华徐宁
钱鹏,朱峰,马冬春,葛腾飞,王路,郭华,徐宁
安徽省胸科医院,安徽合肥230000
肺癌中85%病理分型为非小细胞肺癌[1]。目前手术是临床治疗早中期非小细胞肺癌的首选方案。电视胸腔镜手术具有术后疼痛小、胸腔引流时间短、住院时间短等优势,被逐渐应用于临床治疗中[2]。但随手术例数的不断增多,术后并发症也越来越多,术后持续性咳嗽(CAP)是其常见的并发症之一,发生率24.7%~50.0%,严重降低患者生活质量,影响患者术后康复。目前临床对这种神经性超敏反应缺乏有效的药物治疗方案。CAP的发生机制及相关影响因素仍不够明确,虽然相关文献[3]已报道术后咳嗽可能与肺组织纤维化、迷走神经损伤、反酸、支气管内缝合、纵隔淋巴结切除等因素相关,但不同研究结果之间差异仍较大,对术后CAP 的认识仍需待进一步提高。2019年6月—2020年6月,我们对258例非小细胞肺癌患者行单孔胸腔镜下肿瘤切除术,观察术后CAP 发生情况,分析CAP 发生危险因素,现将报告如下。
1 资料与方法
1.1 临床资料 选取 2019 年 6 月—2020 年 6 月安徽省胸科医院收治的非小细胞肺癌患者258 例,患者均接受单孔胸腔镜肿瘤切除术治疗,其中男123例、女135例,年龄(56.4±13.7)岁,麻醉时间(94.7±26.6)min,采用非气管插管自主呼吸麻醉方式55例、双腔管插管(DLT)麻醉方式203 例,右侧手术207 例、左侧手术 51 例,肺叶切除 96 例、肺楔形切除103 例、肺段及联合亚段切除59 例,有吸烟史105例,术后病理为腺癌184 例、鳞癌52 例、腺鳞癌16例、大细胞癌2例、类癌4例。纳入标准:①接受单孔胸腔镜肺楔形切除、肺段联合亚段切除、肺叶切除、联合肺叶切除,伴或不伴有纵隔淋巴结切除;②所有患者术后病理明确为原发性非小细胞肺癌;③年龄≥18 岁;④获得人体委员会批准,并签署书面知情同意书。排除标准:①术前有明确的咳嗽疾病史;②术前合并有诱发咳嗽的疾病史,如支气管扩张、慢性阻塞性肺病、慢性支气管炎、过敏性鼻炎、支气管哮喘、鼻后滴流综合征、口服ACEI药物等);③同期行双侧肺部手术或中转开放手术患者;④拒绝接受随访调查、退出、失访或不能明确诊断为CAP 患者。根据术后是否发生CAP 将其分为发生CAP 者及未发生CAP者。CAP诊断标准:①术前无明显咳嗽病史;②发生于肺部手术后30 d 内的咳嗽;③术后咳嗽持续时间≥2 周;④排除肿瘤复发者;⑤排除因术后感染等内科因素所致的咳嗽。
258 例患者均采用非气管插管保留自主呼吸麻醉或双腔管插管(DLT)麻醉方式,取健侧卧位,于术侧第五肋间腋前线行一3~4 cm 长手术切口进胸操作。其中非气管插管保留自主呼吸麻醉采用留置喉罩通气,麻醉成功后取2%利多卡因及0.375%罗哌卡因各10 mL 按1∶1 配比成混合液,在超声引导下行椎旁肋间神经阻滞,进胸后再用2%利多卡因及0.375%罗哌卡因混合液(1∶1)依次行肺表面麻醉、膈神经及胸迷走神经干阻滞,至此保留自主呼吸麻醉。淋巴结分组采用AJCC 标准。纵隔淋巴结清扫采用ACSOG Z0030 标准。根据咳嗽感受器的分布特点将分布于气管周围的淋巴结称为气管树周围淋巴结,包括2、4、7组淋巴结。有上述3组任何一组淋巴结切除则定义为有气管树周围淋巴结切除,反之则无气管树周围淋巴结切除。所有患者经手术切口放置24F 引流管一根接引流瓶,经术侧腋中线第七肋间放置胸腔微导管一根接引流袋,术后第1 天常规行床边胸片检查,若胸片提示肺复张尚可,无明显肺不张,咳嗽时无明显气泡溢出,则常规拔除24F引流管,当胸腔微导管引流量<200 mL/d 时,可拔除胸腔微导管。
1.2 资料收集及分析方法 收集患者性别、年龄、肺部手术部位以及疾病种类等一般资料。对258 例患者术后进行随访,通过自拟的数字评分法(NRS)评价患者的咳嗽程度(0分:无咳嗽;1~3分:轻度咳嗽,对睡眠无影响;4~6 分:中度咳嗽,对睡眠有影响,但能入睡;7~9 分:重度咳嗽,无法入睡或睡眠中咳醒;10 分:剧烈咳嗽)。NRS 评分中若患者正服用止咳药物,则以未服药时的NRS 评分为准。随访过程中若患者的NRS 评分超过4 分,则应指导患者接受药物干预治疗。
1.3 统计学方法 采用SPSS19.0 统计软件。计量资料以表示,两组间比较采用t检验;计数资料比较用χ2检验。以NRS 评分≥4 分为观察对象,对患者的性别、年龄、肺部手术部位以及疾病种类等不同因素对非小细胞肺癌患者术后出现持续性咳嗽的影响进行分析,对单因素分析中差异有统计学意义的指标进行二分类Logistic 回归分析。P<0.05 表示差异具有统计学意义。
2 结果
258 例患者中发生 CAP 者 101 例,术后 CAP 发生率39.1%(101/258)。发生CAP 者(101 例)中男39 例、女62 例,年龄(57.9 ± 12.8)岁,吸烟史50 例,病理类型为腺癌70例、鳞癌22例、其他9例,纵膈淋巴结阳性23 例,手术方式为肺叶切除45 例、肺段及联合亚段切除29 例、楔形切除27 例,纵膈淋巴结切除方式为清扫45 例、采样27 例、无切除29 例,气管树周围淋巴结切除70例,麻醉时间(96.4±28.8)min,麻醉方式为DLT 92 例、自主呼吸9 例,手术侧在右侧89例、左侧12例。未发生CAP 者(157例)中男84例、女73 例,年龄(55.4 ± 14.2)岁,吸烟史55 例,病理类型为腺癌114例、鳞癌30例、其他13例,纵膈淋巴结阳性25 例,手术方式为肺叶切除51 例、肺段及联合亚段切除30 例、楔形切除76 例,纵膈淋巴结切除方式为清扫63例、采样35例、无切除59例,气管树周围淋巴结切除128例,麻醉时间(93.6±25.1)min,麻醉方式为DLT 111 例、自主呼吸46 例,手术侧在右侧118 例、左侧39 例。与术后未发生CAP 者比较,术后发生CAP 者性别、吸烟史、手术侧、手术方式、麻醉方式、气管树周围淋巴结切除等因素具有统计学差异(P均<0.05)。术后发生CAP的多因素Logistic回归分析结果见表1。由表1可知,性别、麻醉方式、手术方式、气管树周围淋巴结切除是术后CAP 发生的独立危险因素(P均<0.05)。
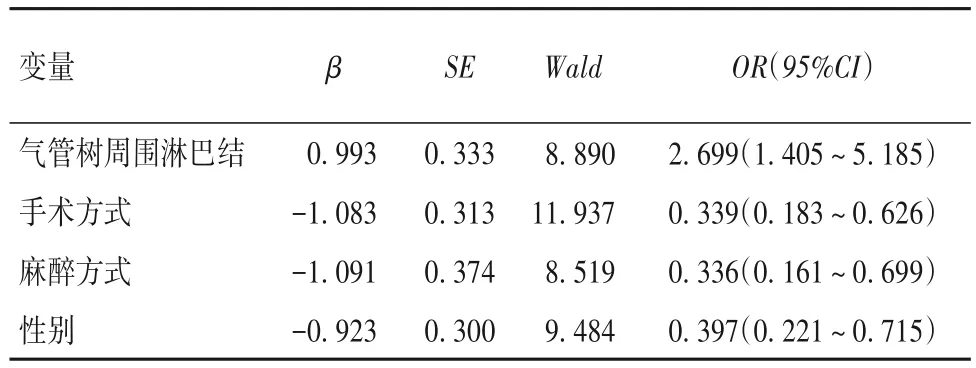
表1 术后发生CAP的多因素Logistic回归分析结果
3 讨论
咳嗽反射是机体发生咳嗽的生理基础,是一种涉及膈肌、胸壁肌、颈肌、腹肌、喉外展肌、及髓质和皮质区的复杂的神经肌肉现象,由多种外周和中枢神经机制诱导和调节的复杂神经生物学过程[4]。但目前关于咳嗽的确切机制尚不清楚,相关报道认为气道炎症、肺纤维化引起的机械性变形、迷走神经的断裂、咳嗽反射性超敏反应等可能是引起咳嗽的重要机制和预测因子。虽然咳嗽很少危及生命,但有时会出现气胸、晕厥和心律失常等严重并发症。然而CAP 是非小细胞肺癌患者术后常见的并发症之一,患者常伴有咽痛、气喘、气促、胸痛等不适。据相关报道[5],有25%非小细胞肺癌术后长期存活者(>5年)患有咳嗽,其中约50%的患者是在手术后1年内遭受咳嗽。本组病例术后CAP 的发生率为39.1%。肺切除术后CAP 则特指发生于肺切除术后,胸部X线检查结果无明显异常,排除鼻后滴流综合征、支气管哮喘或口服血管紧张素转换酶抑制剂等因素,持续性咳嗽<2 周的干咳[6]。目前关于 CAP 发生的确切机制仍不明确。
咳嗽反射的完成是由咳嗽感受器接受理化刺激后产生的冲动,沿迷走神经传入纤维上传至脑干、脑桥、大脑皮层,经处理后沿迷走神经、膈神经及脊神经的运动支下传至呼吸肌,支配呼吸肌协调性运动而产生咳嗽。其中迷走神经C-纤维是最主要的咳嗽感受器,主要分布于喉、气管、隆突及肺内较大支气管,不仅分布于气道的黏膜上皮,而且分布于气道壁内的咳嗽效应器。我们根据迷走神经C-纤维分布的特点,对患者术中是否行气管树周围淋巴结清扫及麻醉方式进行研究分析,结果表明单因素及多因素统计均具有统计学意义。关于气管树周围淋巴结清扫引起咳嗽的机制我们推测如下:①清扫淋巴结过程中,对气管壁的机械牵拉或损伤引起神经肽分泌改变,从而促进神经源性炎性因子释放,刺激快适应感受器纤维(RARS)而引起咳嗽;②清扫淋巴结过程中,损伤相应区域迷走神经,可能会造成咳嗽的敏感性增加;③淋巴结清扫后,局部气管裸漏,受周围理化因素刺激后易引起咳嗽。而非气管插管保留自主呼吸麻醉患者较气管插管患者术后CAP 发生率低的原因,我们考虑如下:①根据咳嗽感受器主要分布于喉、气管、隆突等处的特点,自主呼吸麻醉可有效的避免对咳嗽感受器的直接刺激;②当导管球囊压力超过粘膜毛细血管压力时,粘膜缺血会立即引起压力、充血、水肿和炎症,而自主呼吸麻醉可有效避免气管插管对支气管黏膜的损伤,其气道黏膜的完整性得到保护,从而减少气道黏膜炎性介质(如IL-1β、TNF-α 等)和神经生长因子(NGF)的分泌,这些因子可直接致敏感觉神经元,从而导致咳嗽反射的超敏反应[7];③肋间神经阻滞能有效阻断手术操作对传入神经伤害性刺激,能有效减少支气管黏膜炎性因子释放,调节细胞因子平衡,抑制机体的炎症反应。④可能与麻醉过程中芬太尼、舒芬太尼、瑞芬太尼等阿片类药物及麻醉气体的应用剂量较少有关系。相关研究[8]已有报道,芬太尼等阿片类药物一方面可通过抑制交感神经,增强迷走神经活动,从而引起支气管收缩和咳嗽,另一方面可通过对节前副交感神经刺激增加支气管肺泡肥大细胞对组胺释放,从而提高快速适应受体兴奋性而引起咳嗽。而肺叶或肺段及联合亚段切除术后患者出现咳嗽的原因,我们考虑如下:①术侧肺组织损失较多,肺容量减少,胸膜腔内压力下降,机体会通过患侧余肺代偿性膨胀,膈肌上抬,纵隔偏向患侧等方式消灭残腔,而这种长期的解剖学和生理学变化(如支气管扭曲、残肺畸形等)会导致呼吸力学和呼吸时气道敏感,导致持续手术后咳嗽;②肺叶或肺段切除患者,术中切断的支气管较楔形切除的支气管粗大,其支气管内分布的咳嗽感受器较密集。本研究还发现女性患者术后CAP 发生率较男性高,其原因尚不明确。通过对患者出现慢性咳嗽的的文献和经验分析,我们推测造成这种现象的原因可能与女性体内荷尔蒙的影响、内脏的高敏感性以及气道传入感觉皮质神经层的超敏反应有关。肥大细胞是已知的女性性激素受体,相比男性,女性体内的肥大细胞能够触发更积极的反应,其储存的炎性介质可能加重气道的高反应状态,从而促进咳嗽的发生。对于另一个因素吸烟,先前已有研究[9]表明,与不吸烟者相比,长期吸烟可抑制咳嗽反射敏感性,且咳嗽反射敏感性是一种动态现象,戒烟2周后,咳嗽反射敏感性显著增强。慕腾等[10]研究显示,无吸烟史为术后咳嗽发生的独立危险因素,术前吸烟可能是发生CAP的保护性因素,长期吸烟导致气道咳嗽感受器的敏感性下降,对咳嗽的耐受性增加。但本研究显示术前无吸烟史并非术后发生CAP的独立危险因素。
综上所述,双腔管气管插管、非楔形肺切除术、女性、气管树周围淋巴结切除是患者术后发生CAP的独立危险因素。
