安徽省药品批发企业两轮《药品经营质量管理规范》认证检查情况比较
2021-04-16黄世福
张 慧,倪 凯,黄世福
(安徽省药品审评查验中心,安徽 合肥230051)
自2013年6月1日实施新修订《药品经营质量管理规范》(GSP)以来,随着新修订《药品管理法》的正式施行及《药品医疗器械飞行检查办法》(总局令第14号)、《关于严格执行〈药品经营质量管理规范〉加强药品批发企业监督检查工作的通知》(食药监药化监〔2015〕85号)等一系列政策法规的出台,进一步加强了药品监管,规范了药品经营行为。各地药品监管部门对药品经营企业实施监督检查,公开检查结果,依法查处违法违规药品经营行为,督促药品经营企业的经营活动符合GSP要求。本研究中汇总了安徽省药品批发企业2013年至2015年(第一轮认证)和2018年至2019年(第二轮换证)的两轮检查情况,并对比分析检查中发现的缺陷,旨在为促进药品批发企业规范经营和加强有效监管提供参考。现报道如下。
1 检查总体情况
1.1 企业数量
安徽省是药品流通大省,2013年11月正式启动新修订GSP认证时,全省共有药品批发企业607家,截至2015年底,共有447家通过第一轮认证检查,主动注销和认证不通过160家。截至2019年底,全省共有药品批发企业417家(经历第一轮认证企业402家,2016年后新开办体外诊断试剂企业15家);2018年10月启动第二轮换证,截至2019年底,已完成271家。可见,近年来我省药品批发企业数量呈下降趋势,尤其是第一轮认证后,企业数量大幅减少,减幅为26.36%;第二轮较第一轮企业减少30家,减幅为6.71%。
1.2 结果
2017年初,根据原国家食品药品监督管理总局印发的《药品经营质量管理规范现场检查指导原则》(以下简称《指标原则》作为标准开展GSP认证检查。检查结果分为3类,即通过检查、限期3个月整改和不通过。结果见表1。两轮GSP认证一次性通过率卡方检验结果显示,χ2Pearson=77.071,P双侧=0.000<0.05,可以认定两轮GSP认证一次性通过率有差异。

表1 两轮GSP认证检查结果汇总Tab.1 Results of two rounds of GSP certification inspection
2 缺陷项目构成情况
2.1 缺陷项目频次
第一轮认证447家企业中,共发现主要缺陷项目1 039频次,一般缺陷项目4 489频次;第二轮换证271家企业中,共发现主要缺陷项目175频次,一般缺陷项目1 731频次。根据《指导原则》中章节的划分,两轮检查缺陷项目频次汇总结果见表2。可见,第二轮换证检查中一般缺陷项目数占总项目数的90.82%,显著高于第一轮认证的81.20%。两轮认证中主要缺陷项出现频次最高的3个章节均为质量管理体系、校准与验证和计算机系统。一般项目出现频次最高的3个章节为第一轮轮认证,人员与培训、收货与验收和储存与养护;第二轮换证,储存与养护、人员与培训和设施与设备。经对比,储存与养护章节缺陷项目升幅最大,主要缺陷项目出现频率由7.60%升至11.43%,一般缺陷项目出现频率由12.39%升至16.98%。
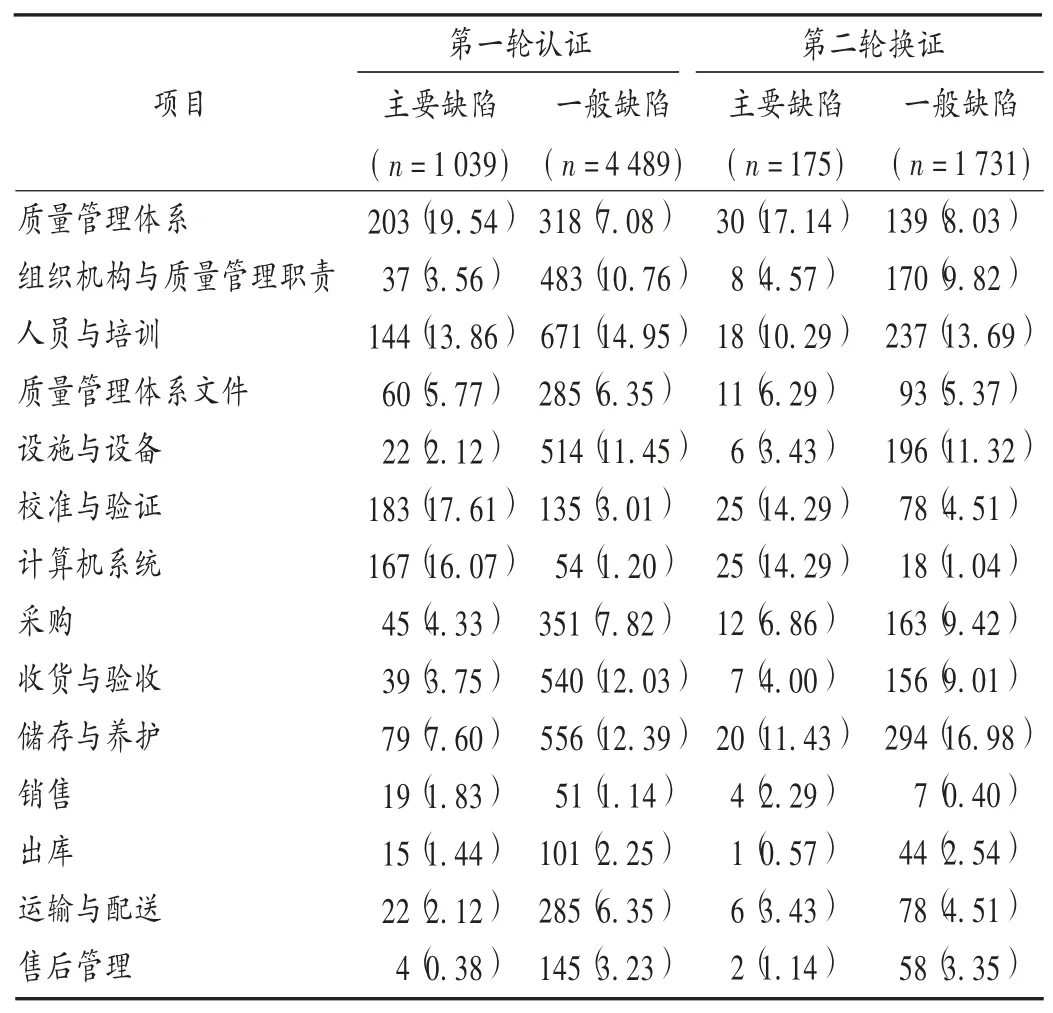
表2 两轮GSP认证各章节缺陷频次统计[频次(%)]Tab.2 Statistics results of defects frequency in each chapter of two rounds of GSP certification[times(%)]
2.2 高频主要缺陷
经统计,两轮检查中均未发现严重缺陷。第一轮认证检查中未通过的9家企业,均因未通过3个月限期整改后的复查。统计二轮检查中259家企业限期3个月整改企业的检查报告,高频主要缺陷项见表3。可见,两轮检查中高频主要缺陷集中在计算机系统、内审、质量管理体系、验证校准等方面,其中*05901(计算机系统)在两轮检查主要缺陷中均排首位。

表3 两轮GSP认证主要缺陷项高频统计Tab.3 Statistical results of major defects with high frequency in two rounds of GSP certification
3 缺陷项目分析
3.1 相同点
计算机管理系统:计算机系统是药品批发企业五大质量管理关键要素之一[1]。计算机授权不符合规定,授权范围与岗位职责不符;各岗位人员间用户名和密码公开,彼此混用;计算机系统数据不能安全、有效地按日备份是企业存在的主要问题。一方面反映企业追溯意识淡薄,另一方面反映对人员操作动态管理滞后与混乱,部分企业甚至只在面临检查时才进行一次梳理。计算机系统是企业药品经营过程重要的追溯工具[2]。在当前国家强调药品追溯体系建设的重要时期,企业需加强计算机系统的管控,降低相关风险。
验证与校准:不能有效监督审核验证工作的真实性与合理性,或验证结果不能应用于使用中是存在的主要问题。由于验证的技术性,药品批发企业普遍委托第三方技术单位进行[3],但部分企业完全依赖第三方机构,并不参与到验证工作中,这样会造成验证与实际操作“两张皮”,造成冷链药品储运质量风险加大。
质量方针与目标:企业的年度目标不能量化,未进行年度目标考核,每年的质量目标相同仍是高频问题。药品流通企业的方针与目标是企业进行战略部署,实现战略目标的重要方法[4]。上述问题反映出企业重视程度不足,对质量方针和目标理解不到位,存在应付检查的思想,不能有效利用方针和目标对经营和质量管理提供支撑。
内审:内审是企业对于发现自身经营、质量等问题的重要手段。在检查过程中,企业内审流于形式,不能有效发现企业经营过程中明显存在的问题,导致企业不能及时整改,加大问题的严重性与危害性[5]。
采购环节:企业主要存在供货单位资质审核不全的问题。该环节是药品经营过程中的起始环节,若不能对上游供货单位进行严格审核,就无法确定上游企业的合法性与规范性,其销售的药品质量是否合格、渠道是否合规都存在疑问,增加了假劣药品、回收药品等非法渠道药品进入市场的风险[6]。
3.2 不同点
第二轮换证检查缺陷项总数明显少于第一轮认证检查。第一轮认证的一次性通过率为50.34%,近半数企业通过限期3个月整改后的复查得以换证,其中9家未通过整改复查。第二轮换证的一次性通过率为83.03%,且限期3个月整改的企业均通过了复查。完成第二轮换证的217家企业多属大中型企业,管理较规范。从第二轮换证检查情况来看,目前已有20余家企业自感不符合GSP要求,许可证到期而未申请,主动退出市场。可见,经过几年GSP的实施,企业逐渐加深了对新修订GSP的学习和理解;此外,在飞行检查常态化、市场竞争日趋激烈的环境下,批发企业的日常经营规范性有所提高。
仅在第一轮认证中进入前10的高频缺陷有3条:*03601(质量管理制度内容)、*03701(部门及岗位职责内容)、*02001(企业质量负责人任职要求)。其原因是新修订GSP颁布实施之初,企业对其理解有限,导致达不到要求,如质量体系文件的不规范、质量负责人能力不足等。随着GSP的推行,逐步加深理解和认识,企业制度、规程等出现大量缺失或与实际工作不对应的情况相对减少[7]。同时,质量负责人等关键岗位人员资质、能力不足的情况也相对改善。
第二轮换证中,*08404(养护人员应当对库房温湿度进行有效监测、调控)位居高频榜首,而在第一轮认证中并非高频缺陷项。分析原因,一是换证检查时部分企业在5年内因自身疏忽或节省成本不能有效调控温湿度,导致超温情况出现频率增加[8];二是在第一轮认证中,检查员对于检查标准的掌握程度不够,检查标准不统一,造成有些检查员对温度记录要求不严格,而随着政策的推行,检查尺度趋向严格、统一,判定此类缺陷的情况增多。
4 建议
从近年检查情况来看,我省药品批发企业质量管理水平有所提升,但药品流通领域正处在转型升级的关键时刻,仍需面临不断变化的新形势与新问题[9]。为进一步提升科学有效监管、促进企业规范发展,提出以下建议。
1)适应新形势,努力提升企业质量意识。分析两轮缺陷情况,仍需提高批发企业人员质量意识,对于部分长期存在的行业顽疾,究其原因主要是质量管理意识未内化于心。在当前形势下,药品批发企业全体从业人员应重视常态化的质量管理,这是企业自身发展的基本要求,不管监管检查的形式怎么改变,企业均应严格执行GSP的相关要求。尤其是企业负责人,要牢固树立企业是第一责任人的观念[10],在经营过程中自觉自律执行GSP,而不能抱有侥幸心理或敷衍心态,导致质量管理体系和实际工作“两张皮”。此外,药品批发企业还应加强质量风险管理,加强风险防范意识,通过提前排查风险、提前介入,避免企业损失或将损失降到最低。
2)多途径开展培训,提高企业从业人员能力水平[11]。由本研究结果可见,部分高频缺陷项的存在是由经营企业从业人员能力水平不足导致的,如质量管理人员对验证知识的匮乏,养护人员对自动温湿度系统、养护知识掌握不足等。因此,建议通过行业协会、监管部门、企业内部等多渠道、多部门组织培训,从不同角度针对企业不同岗位人员进行专业培训,提高培训实效性。
3)理论联系实际,全面提升检查能力。检查员是监管工作的执行者,若能力不强,将制约药品的流通监管[12]。通过两轮检查情况来看,检查员对条款的把握和理解愈加科学、客观,尺度把握愈加统一、规范,但仍存在检查能力和水平参差不齐、对条款理解狭隘片面、法规学习不足、知识更新不及时等问题。根据2019年印发的《国务院办公厅关于建立职业化专业化药品检查员队伍的意见》[13],建议加快职业化、专业化药品检查员队伍建设,通过不断的理论学习和实践检查,打造出政治过硬、素质优良、业务精湛、廉洁高效的药品检查员队伍。
4)完善配套法规,多措并举严控风险。随着新修订《药品管理法》的实施,药品上市许可持有人制度等的深入推行,新修订药品GSP及其附录亟需调整,建议尽快出台药品流通相关配套文件,规范监督检查方式和频次,推行实施风险分级管理。
新修订《药品管理法》不再要求药品经营企业强制实施GSP认证,并不意味着监管时代的终结,从立法内容上更加体现强化动态监管的形势,监督管理部门随时对药品经营企业在经营活动中执行GSP等情况进行检查,这也标志着药品经营企业将面临更加严厉的监管新局面[14]。随着药品流通领域法律法规的配套完善,严格按“四个最严”要求,企业执行GSP的主动性会越来越高,从而形成以规范促发展的良性循环,切实保证人民用药经济、安全、有效。
