微型生物碳泵研究进展
2021-04-15蔡阮鸿陈晓炜徐大鹏骆庭伟
蔡阮鸿,郑 强,陈晓炜,徐大鹏,王 煜,骆庭伟,张 锐
(厦门大学海洋与地球学院,近海海洋环境科学国家重点实验室,福建省海洋碳汇重点实验室,海洋微型生物与地球圈层研究所,福建 厦门 361102)
人类活动正从多时空尺度上影响着地球系统.政府间气候变化专门委员会(Intergovernmental Panel on Climate Change,IPCC)特别评估报告[1]以及相关研究成果均指出:自工业革命以来,人类活动(以石化能源燃烧为主)导致了大气中温室效应气体浓度显著增加[2].以二氧化碳(CO2)为主的温室效应气体的激增导致全球变暖和海洋酸化,改变了生态系统和地球各碳库之间的平衡[3-6].地球各圈层碳库间的变化量影响了气候变化的程度、范围及人类生存[7-8].
海洋占地球总表面积近71%,总储碳量(含有机和无机)超过380 000亿t,是地球表面最大的活跃碳库,是大气碳库的近50倍、陆地碳库的近20倍[6,9-10].自工业革命以来,近1/3人类活动排放的CO2被海洋以物理、化学、生物的机制吸收和储藏,在一定程度上缓解了全球变暖及其他气候变化[11].开阔大洋储存大气CO2至深层海洋,当时间尺度达百年甚至千年时,即可起到减缓大气CO2压力而调节气候的作用.目前已知的3种海洋储碳机制(图1)分别是:溶解度泵(solubility pump,SP)、生物泵(biological pump,BP)和微型生物碳泵(microbial carbon pump,MCP).
SP(图1左)介导无机碳封存,可从化学海洋学和物理海洋学角度解释海洋维持溶解无机碳(通常指溶解的CO2、HCO3-和CO32-)从表层到深海的浓度梯度,将寒冷、高密度、富含溶解无机碳的水输送至海洋深部(主要发生在北大西洋高纬度地区),贡献无机碳至近380 000亿t的海洋巨大溶解无机碳库[12].
BP(图1中)通过重力沉降输送颗粒有机质(particulate organic matter,POM)至海底沉积物形成长期储碳,其通量主要依赖于生活在海洋表层的浮游植物固定无机碳所生成的POM沉降[13-14].然而,海洋中POM在总有机碳库中所占比例不足5%,且绝大部分POM在沉降过程中被转化为溶解有机质(dissolved organic matter,DOM),或经微生物呼吸作用迅速分解为无机碳;据估算,现代海洋中浮游植物每年固定的有机碳总量约580亿t,通过BP最终沉降至永久跃层而储藏的POM总量每年仅3亿~7亿t[9,15],约占初级生产力的0.5%~1.2%.
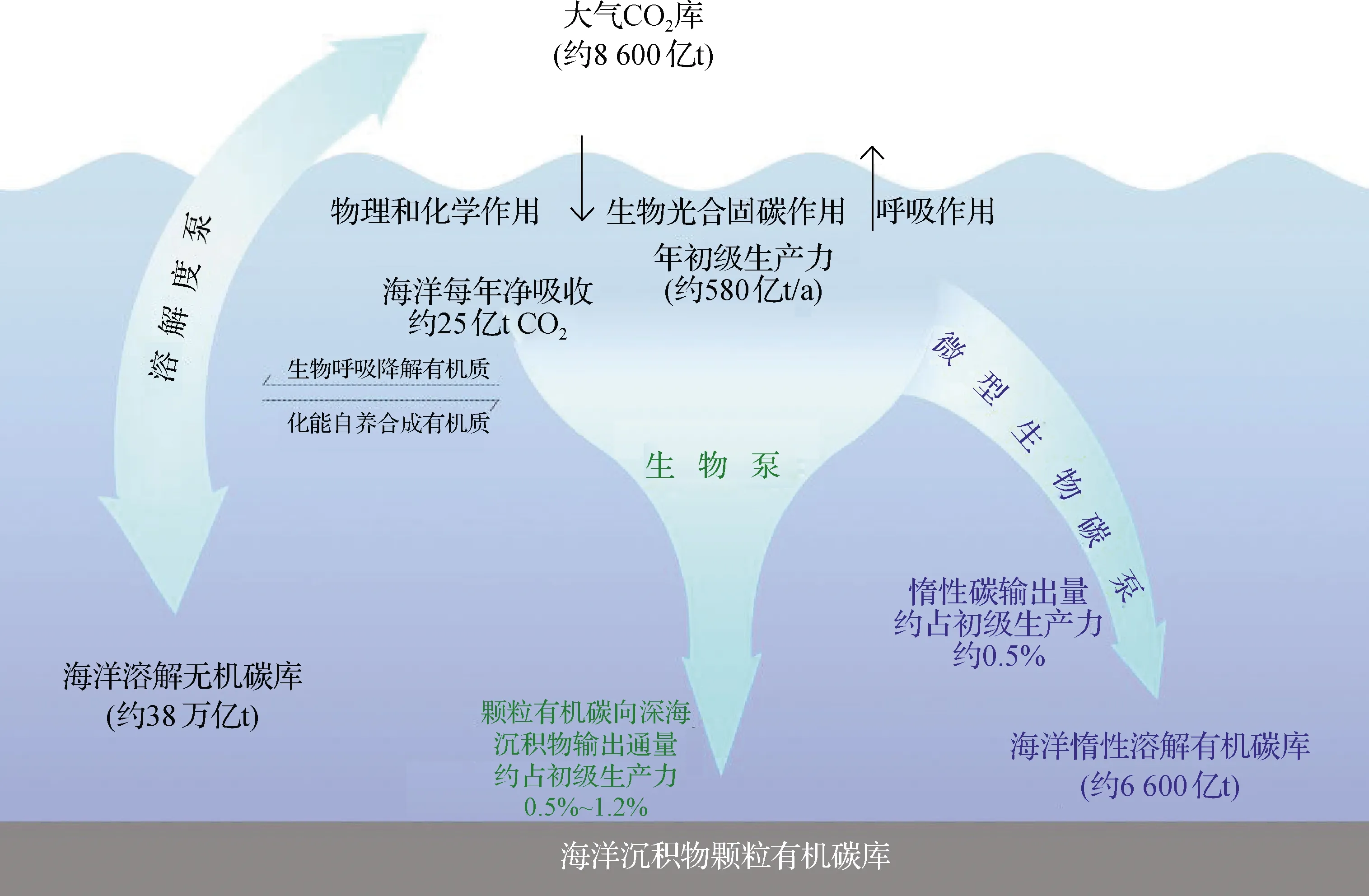
图1 海洋三大储碳机制:溶解度泵、生物泵和微型生物碳泵Fig.1 The three ocean carbon sequestration mechanisms:solubility pump,biological pump,and microbial carbon pump
海洋有机碳的主体组分(>95%)为DOM形式,且绝大部分DOM耐受生物降解,周期可长达5 000年[16-17],被称为惰性溶解有机质(recalcitrant DOM,RDOM).有别于BP介导的POM沉积,海洋中RDOM库的储量巨大,储碳量近6 600亿t[18],接近大气CO2的总储碳量.研究表明巨大的RDOM库的储量变化影响着全球气候[7,19-20].新提出的MCP储碳机制(图1右)阐述了通过微型生物活动将活性溶解有机质(labile DOM,LDOM)转化为RDOM的生态过程,具体包括异养微生物代谢转化、病毒裂解宿主生物、原生动物捕食微型生物等[9,18],累积的RDOM进入长周期(平均5 000年)储碳[18].这一新兴储碳机制于2010年首次提出并被广泛关注[21].该理论一定程度解释了1968年美国科学家针对海洋这一巨大RDOM库形成过程和机制的“难解之谜”[22].本文回顾自MCP理论提出后近10年关于其过程机制的研究进展.
1 MCP介导的RDOM解析方法和化学分子特征
MCP是以“微型生物(浮游植物、细菌、古菌、病毒、原生动物等)介导DOM转化”为核心的理论机制,因此研究微型生物生态过程和DOM组分的关系对深入探索MCP至关重要.DOM常指可被孔径为0.2 μm滤膜(或平均孔径为0.75 μm的玻璃纤维滤膜)滤过的有机质.自20世纪中叶开始,海洋中巨大的DOM库的形成原因、惰性机制和分子结构特征引发关注.色谱、质谱、光化学等传统分析技术揭示海洋DOM呈现高度多样化,不仅含有碳水化合物、氨基酸、多肽、蛋白质等微生物易于降解利用的活性DOM,还含有结构组成极其复杂多样的未知组分.
海洋DOM库中绝大多数都是复杂的天然RDOM,将其解析至单一组分是一项巨大的挑战.DOM在水环境中的浓度极低,1 L深层海水所含DOM的碳量不足500 μg[18],且具有极高的分子多样性.运用超高分辨率质谱,如傅里叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance mass spectrometry,FT-ICR MS)或静电场轨道阱质谱(orbitrap MS),可从海水DOM样本中解析出成千上万个化学分子式,每个分子式背后有多种结构可能[23].此外,由于海水无机盐浓度高,分析DOM前通常需先将其浓缩并除去盐分,以避免无机盐干扰DOM离子化.固相萃取、反渗透和超滤等技术被广泛运用于浓缩DOM并除盐,然而这些技术均无法完整回收所有DOM[24],使得解析RDOM的分子组成和结构信息成为海洋学研究的难题.
现有研究对RDOM的解析仍多集中于混合物水平.早期研究发现表层与深层海水中DOM的化学特征具有很大差异:表层海水多含活性有机质,如胞外多糖和小分子氨基酸等物质;而深海富含未知的难降解DOM[25-27].水体中小部分的天然DOM带有发荧光基团,如芳香氨基酸、色素以及分子组成和结构复杂的木质素、腐殖酸和黑碳等,可在给定激发光的刺激下发生分子内电子能量跃迁,因此释放的荧光可被捕获解析.基于此原理,激发发射矩阵(excitation emission matrix,EEM)荧光光谱被广泛运用于天然DOM的研究[28].EEM荧光光谱可鉴定出若干类具有相似荧光特性的溶解有机质(fluorescent DOM,FDOM),典型物质如相对活性的类蛋白质和相对惰性的类腐殖质组分[29-30].越来越多的生物降解实验证实:类蛋白质FDOM可快速被微生物降解利用,产生一些相对惰性的类腐殖质FDOM信号[31-32].对海洋水柱中FDOM组分的空间分布调查发现:表层海水含有更多的活性FDOM信号,如类蛋白和氨基酸组分;而深海中富集更多的惰性FDOM信号,如类腐殖有机质[30,33].这种分布规律受控于物理和生物机制的共同作用:类腐殖质FDOM容易受到光降解(或紫外光漂白)而不易在海洋真光层累积,但可通过MCP的作用产生并累积至黑暗的海洋深部[34-36];类蛋白质FDOM主要来源于浮游植物的光合产物且容易被微生物降解,因此在海洋表层可检出较高的信号丰度,在海洋深层的信号强度更低,整体分布规律与类腐殖质FDOM相反[35,37].
21世纪初以来,FT-ICR MS逐渐被一些欧美国家和我国的研究人员应用于天然DOM的解析和比对[38-40],提供了指纹图谱信息和预测DOM的结构信息[41-42].核磁共振(nuclear magnetic resonance,NMR)结合FT-ICR MS从一定程度上解析出一类典型的RDOM复合物,它们具有相似的化学结构特征,即主体呈环烷状且侧链富含羧基,因此被称为富羧基不饱和脂环族化合物(carboxyl-rich alicyclic molecules,CRAM)[43-44].CRAM也被认为是类腐殖质的重要组成部分[45].Arakawa等[46]通过气相色谱质谱联用(gas chromatography-MS,GC-MC)和NMR等方法,解析出一类浮游植物色素(类胡萝卜)的降解产物,该物质具有典型的芳香环头部结合戊二烯尾巴结构特征,广泛存在于海洋DOM中,碳-14定年法测得其循环周期大于1 500年,是一类典型的生源(即生物产生的)化合物降解产生的RDOM.此外,Zhao等[47]等结合FT-ICR MS、NMR和EEM荧光光谱也解析出一种生源DOM——荧光藻胆色素降解产物,其与深海RDOM组分对比显示出分子组成上的高度一致性.以上研究均采用多种分析技术手段结合生物分析途径解析生源RDOM的信息,证实了浮游植物有机质是RDOM的重要来源[21].借助FT-ICR MS,越来越多的实验表明微生物可代谢的简单有机质(如葡萄糖和寡肽等)或复杂有机底物(如沉积物有机质、浮游植物细胞破碎物和大型海藻等)为惰性CRAM组分,在培养体系中存在累积效应[32,48-50],证实了生源RDOM分子对海洋天然RDOM库的贡献,也从微生物生态和分析化学角度证实了10年前提出的MCP理论.
MCP理论在提出之初被认为不仅是一个生态学理论,更阐述了许多有待验证的过程细节,如:微生物和DOM如何相互作用产生RDOM?病毒颗粒如何侵染宿主释放DOM而影响储碳?原生动物的捕食作用如何影响有机碳的归宿和RDOM的生成?这些问题早期均未有明晰的答案,越来越多的研究在一定程度上作出了解释.
2 微生物与DOM的相互关系
与海洋DOM类似,天然微生物种群也具有极高的物种丰富度和功能多样性,在不同海区、水团、深度等具有明显的分布差异,同一海区不同季节也显著不同.深入阐释海洋微生物与DOM分子组成之间的耦联关系是解释微生物吸收-转化-释放DOM的重要途径,也是揭开MCP产生RDOM主动过程(即浮游植物化合作用胞外分泌RDOM和异养细菌转化过程)的关键[21,51].
近5年来,相关研究揭示海洋微生物群落对海洋DOM库的组成和变化具有重要影响.病毒裂解超微型蓝细菌所产生的DOM与微生物群落具有显著的共变关系,异养微生物进一步降解过程可促使DOM向惰性转变[52].在自然环境中DOM的多样性与惰性均会随着时间推移而增加,这一过程与微生物的降解和转化密不可分[53-54].在开阔大洋寡营养海水中,浮游植物释放出多样化的有机分子,这些有机分子的碳、氮、磷元素占比通常较低,经过微生物的连续降解和不断改造,DOM的多样性、惰性和碳、氮、磷元素占比均进一步增加[55-57].在空间分布上,沿北海(North Sea)经度断面的DOM分子组成与微生物群落组成研究展示了活跃微生物群落与活性DOM之间的耦联关系[58].此外,Osterholz等[59]对特拉华湾(Delaware Bay)的DOM组成与微生物群落耦联关系的研究发现:DOM分子组成相对于微生物群落具有更高的稳定性.可见在不同时空尺度上,海洋微生物与DOM的相互作用关系对巨大的海洋DOM库产生重要影响.
微生物对DOM的利用和转化受其生理特征和生化途径的制约,不同微生物类群所介导的DOM转换过程和最终产物也不尽相同,不同微生物对底物有不同的选择倾向.在富含活性有机质的环境中,玫瑰杆菌(Roseobacter)倾向于利用碳水化合物,而浮游细菌SAR11类群主要以氨基酸等富含有机氮的DOM为底物[60].异养细菌在改造病毒裂解超微型蓝细菌所产生DOM的过程中,γ变形杆菌(Gammaproteobacteria)和黄杆菌(Flavobacteria)与较大分子质量的DOM显著相关,暗示这些微生物倾向于利用较大的DOM分子,并释放较小的DOM分子以供其他微生物类群生长代谢,这种DOM选择机制有利于有机质的转化[51].在近岸罗斯基勒(Roskide)峡湾中,β变形杆菌(Betaproteobacteria)与类腐殖质DOM存在显著的相关性,暗示该类群对这类DOM有利用潜能[61].而在寡营养的开阔大洋中,交替单胞菌(Alteromonas)、海绵菌(Spongiibacteraceae)、泉古菌(Crenarchaeota)和广古菌(Euryarchaeota)均能氧化相对惰性的富含羧基DOM[62],其中海绵菌被归类为寡营养生物,其可以将甾体等相对难降解的化合物代谢为更难降解的惰性有机质[63],表明这种生长缓慢的微生物可代谢半惰性DOM并释放更加惰性的DOM,这预示着MCP的过程机制还包含将相对惰性的有机质改造得更加惰性,使水体中的RDOM成为惰性连续体(recalcitrant continuum)[49,64-65].此外,在黑暗海洋中,分布广泛的浮游细菌SAR202和SAR11两大微生物类群被认为在改造半惰性DOM过程中发挥重要作用[66,62].特别是Landry等[66]发现:SAR202类群包含多个编码核黄素单核苷酸或F420-依赖性单加氧酶的基因,其中多数被预测属于Ⅱ型Baeyer-Villiger单加氧酶,主要催化氧原子插入脂环烷烃结构;这些酶在分解代谢固醇类有机质的途径中与其他酶家族发挥互补作用,表明部分SAR202类群可能是催化一些半活性有机质(如固醇类物质)转化为惰性有机质CRAM的关键.
化能自养微生物也被证实是RDOM的重要来源.厌氧氨氧化古菌特别是奇古菌(Thaumarchaeota)属于典型的化能自养氨氧化古菌,可在培养中产生相当数量的活性有机质(如氨基酸、多肽、碳水化合物及饱和脂肪酸等)和部分类似CRAM的惰性分子,预示这些古菌在黑暗海洋中的化能自养作用不仅提供活性DOM用于异养微生物的生长代谢,更为深海碳库提供了直接的RDOM来源[67].Zhang等[68]的最新研究发现黑暗深海中氨氧化古菌和亚硝氧化细菌具有显著不同的代谢策略,并揭示了硝化作用与黑暗固碳耦合的生理生态学机制,为量化深海物质与能量循环的研究提供了新参数.综上可见,微生物群落在功能上“多才多艺”,其在对DOM吸收、转化、释放的过程中影响有机碳循环(如从活性到惰性的过程)和深海RDOM的多样性,对海洋巨大的DOM库产生极其重要的影响.
3 病毒在MCP中的作用
病毒是海洋中丰度最高的生命粒子,其中裂解性病毒侵染宿主作用可导致部分(20%~40%)海洋微生物死亡,调控微型生物的群落结构和遗传进化[69].宿主生物被病毒裂解后,释放的有机物重新被环境中的微生物吸收利用,因此病毒能够通过“病毒回路”作用影响有机碳在海洋微食物网中的通量和途径[21,70-71].越来越多研究揭示了病毒裂解宿主后释放的DOM的化学组成和进一步的生物地球化学效应.不同于浮游植物分泌的有机物,病毒裂解产物富含更多生物活性的蛋白类有机物[72].Ma等[73]利用高分辨率MS比较病毒裂解性产物和浮游植物分泌物的组分差异,发现病毒裂解产生的DOM组分更复杂且更容易被微生物利用,是海洋中高分子质量(>1 000 ku)溶解有机氮化合物的重要来源.此外,不同病毒种群裂解特定宿主得到的有机物在成分上也有所不同[74].Zhao等[47]发现富含氮的病毒裂解性产物是海洋DOM库的重要来源,并可能在深海里持续累积和储存.Zheng等[75]利用FT-ICR MS等方法分析发现,病毒裂解海洋微型“初级生产者”(浮游植物)产生了大量含氮类有机质如氨基酸、寡肽、蛋白质等,也产生了小分子有机酸、核苷酸、脂类、生物胺、卟啉等,这些活性物质可为异养生物繁殖代谢提供能量,也调控海洋碳循环途径.培养实验也表明病毒裂解产物能被自然微生物群落快速利用,而小部分有机物组分能抵御微生物的降解,验证了MCP理论中“病毒裂解产物也是海洋RDOM的重要来源之一”这一推测[21].因此,病毒裂解宿主调控有机碳的归宿,称为MCP的被动过程[21,51],在海洋碳循环中发挥重要的作用.
病毒侵染策略的生态重要性也得到了更好的认识.不同于裂解性侵染,病毒还会通过溶原性侵染将自身整合到宿主的基因组中,并随着宿主的复制而复制,在避免外界各种环境因子对病毒颗粒产生胁迫的同时,也避免了宿主的裂解死亡,进而影响宿主群落的动态变化和结构,并影响微生物对有机物的利用[76-77].这一过程影响了有机碳的归宿.如在河口生境从大潮到小潮的转化过程中,病毒群落会从裂解性侵染向溶原性侵染转换,在降低病毒降解率的同时也能促进细菌的生存,促使碳量向高营养级传递而非被裂解释放到环境中[78].综合多方面的数据,Knowles等[79]提出了“Piggyback-the-Winner”假说,认为环境中微生物丰度的增加会驱使病毒从裂解性侵染向溶原性侵染转换,并通过溶原性侵染影响宿主的群落结构和代谢.Chen等[80]进一步发现病毒的高溶原性侵染会抑制微生物群落的多样性,而溶原性侵染向裂解性侵染转换则会杀死群落里的高丰度类群,给原本的稀有类群提供生长机会,最终促进宿主群落的多样性,揭示了新的“Piggyback-the-Winner”和经典的“Kill-the-Winner”病毒侵染模式在时间尺度上存在相互转化并共同发挥作用.此外,有研究发现在白令海(Bering Sea)次表层沉积物中,病毒从溶原性侵染向裂解性侵染的转化能够增加环境中20%~56%的DOM、复合单糖和氨基酸的含量,且50%以上产生的有机物能被微生物在培养过程中持续利用和转化[81].这些过程体现了病毒适应环境所展现出的不同生存和生态策略,而这些策略对MCP的碳转化机制影响的研究有待深入开展.
最新研究发现病毒颗粒自身可能直接影响海洋的碳循环过程.作为有机物的复合体,病毒颗粒的降解向周围环境释放有机碳和营养元素[82].据最新研究统计,病毒颗粒在海洋中的总数量达到1.4 × 1030,有机碳总量可达32 Tg,这些有机碳若释放到环境中,将为微生物群落提供丰富的营养物质[83].据估算,深海沉积物生境中的病毒会降解宿主,每年释放37~50 Mg有机碳到环境中,其总量相当于上层海洋光合作用产物通过沉降到达深海沉积物碳量的(3±1)%[84].此外,这些高丰度的病毒颗粒能够被原生动物直接摄食,贡献了原生动物的有机物食物来源,直接进入高营养级的海洋食物链而非进入“微食物环”,进而影响海洋碳流的途径[83,85].近年来发现还存在一种“病毒穿梭”机制,能够通过促进颗粒有机物的富集和沉降,从而提高POM从上层海洋沉降到深海并储存的效率[86-87].Tian等[88]和Zhang等[89]发现沉降到深海的上层海洋病毒仍具有侵染活性,对深海微生物类群的动态变化和群落结构具有重要影响.因此,病毒不仅在MCP中扮演重要角色,更协同BP在生物地球化学中发挥重要作用.
病毒侵染对宿主生理状态和代谢机制的影响也已得到更直接的证据.被病毒侵染后的宿主会重新调整细胞内的代谢通路来促进病毒颗粒的复制和释放[87].如病毒侵染光合自养微生物后会抑制宿主体内的有机碳固定过程,并促进戊糖磷酸代谢,进而促进病毒颗粒所需核酸的合成[90-91].在侵染过程中,病毒携带的辅助宿主代谢基因(auxiliary metabolic genes,AMGs)也可能直接影响到宿主的代谢过程.随着纯病毒株和病毒宏基因组序列库的不断扩展,越来越多的AMGs被发现,病毒对宿主的碳代谢、营养物质如氮磷硫的循环、脂肪酸代谢、光合作用、蛋白质合成、细胞膜与囊泡的形成等过程都具有重要的潜在贡献[92-94],进而在各方面直接影响病毒在海洋碳循环过程中所扮演的角色.
病毒在MCP储碳和全球碳循环中发挥的作用远超想象,期待更多未知过程在不断深入的研究中被发现.Cai等[32]近期的研究指出:病毒侵染作用可调控微生物群落,释放微生物体细胞内含物以供给异养细菌群落.正是病毒这种“Kill-the-Winner”的生态策略促进了微生物群落的演替,加速了活性有机质向RDOM转化,使得碳循环在生物介导的过程中尽可能“转动”起来.这也印证了Jiao等[49]对MCP机制的补充,即微生物群落的演替对于有机质的转化至关重要,而病毒生态正是调整群落演替的关键因素之一[95].因此,病毒对碳循环的作用不容忽视.
4 原生生物在MCP中的作用
与细菌、古菌、病毒等微生物相似,原生生物也在时刻影响着海洋碳循环,在MCP过程机制中扮演重要角色[21].根据五界系统理论,真核生物中除植物、动物、真菌外的所有生物均属原生生物界(Protista).已有研究表明原生生物并不形成单系,而是散布于整个真核生物的各大进化支[96].其种类繁多,至今尚无统一的形态学特征来定义这一类群.目前被业内学者普遍接受的定义为:能够独立生存的单细胞或群体真核生物[97].原生生物具有多样性高、结构功能复杂和分布广泛等特点,是海洋微型浮游生物群落的重要组成部分,在维持海洋生态系统结构与功能中发挥重要作用.原生生物功能类群一般可简单划分为具有光合自养能力的原生植物和具有异养能力的原生动物.
海洋原生植物的光合作用贡献了约全球50%的初级生产力[98],是有机碳循环的第一步,也为驱动MCP提供了能源物质[21].一般认为,无论是近岸还是远海,原生植物(如硅藻、绿藻和甲藻等微型真核藻类)由于具有比单细胞蓝藻更大的粒径和与之相似(甚至更高)的生长率,对海洋初级生产力的贡献超过海洋中其他光合生物[99],其形成的生物量是通过BP沉降作用的POM向深海储藏的重要输出者[100-101];同时,藻类生长过程中所释放的DOM可被异养细菌快速吸收利用,经细菌转化后的有机质贡献于海洋RDOM库[102].
异养原生动物(如微型异养鞭毛虫和纤毛虫等)通过摄食细菌与微藻将碳及其他元素经微食物环传递至经典食物链,在微食物环能流与元素循环中发挥重要作用,如原生动物可摄食约62%藻类和25%~100%细菌的日生产量[103].同时,原生动物摄食过程中通过排泄与分泌所释放的物质中含有DOM,如尾丝虫(Uronemasp.)和游仆虫(Euplotessp.)两种纤毛虫在实验室培养条件下能分别将其所摄食细菌碳量的9%和3%以DOM的形式释放,调控碳分馏[104].在另一培养实验中发现,纤毛虫Strombidinopsisacuminatum和甲藻Oxyrrhismarina可通过摄食作用释放16%~37%的藻类碳量[105];在异养鞭毛虫摄食细菌的实验中发现,摄食活动可释放惰性大分子有机质[106].因此,原生动物的摄食活动是包括RDOM在内的海洋DOM的重要来源之一,印证了MCP理论中原生生物的作用.
在相当长一段时间里,光合自养与异养被认为是原生生物仅有的两种营养方式.然而,Bird等[107]研究发现很多原生生物具有混合营养能力,这为生物参与碳循环提出了新的研究方向.原生生物主要包括两种混合营养模式:1) 某些能进行光合作用的藻类可进行吞噬营养[108];2) 某些进行异养生活的原生动物可摄食藻类,将其部分消化,但保留其质体(叶绿体)并在原生动物体内进行光合作用[109].混合营养模式的发现改变了海洋物质循环与能流的经典模型.大西洋混合营养模式的藻类可摄食约37%~95%的细菌生产量[110];基于模型的研究发现,将混合营养模式纳入食物网后,桡足类通过捕食所能获取的微型浮游动物的生物量是没有混合营养模式条件下的2倍[111].混合营养模式不仅对物质在营养级间的传递影响很大,也影响水体中DOM的组成.Tranvik等[112]比较了一种具有混合营养能力的金藻Poterioochromonasmalhamensis在光合自养及异养(即摄食细菌)条件下所分泌的溶解及胶状有机碳,发现异养比光合自养条件下释放更多粒径>0.02 μm的胶质颗粒,且异养条件释放的DOM具有更高的生物惰性.
综上,原生生物尤其是混合营养原生生物,在海洋生态系统包括碳在内的元素循环中(如营养级间的传递对海洋DOM库,尤其是RDOM库)发挥重要作用.然而,目前混合营养原生生物的研究仍有较大不足,亟待开展深入的研究以补充关键性数据,进一步揭示原生生物在海洋碳循环中的作用.此外,虽然原生生物在MCP的过程机制中同时包含“主动过程”(即一些浮游植物光合作用后直接释放的DOM中含有惰性成分)和“被动过程”(即原生生物分泌或排泄的代谢产物中含有RDOM)[21],原生动物摄食作用被证实改变了碳流(如微食物环作用调整POM为DOM),但是并无明确的研究指出这种过程是否产生RDOM.因此,无论是原生生物中浮游植物分泌的DOM,还是原生动物摄食作用产生的DOM,其分子组成都亟待研究.近10年来光分析化学、超高分辨MS分析和高场NMR分析技术的发展和融合,为这一研究提供了充分的基础.早在2006年,Gruber等[113]发现培养体系中有无原生动物捕食行为介入的情况下,其碳转化方式显著不同.然而,目前仍不明确原生动物的摄食作用是否类似于病毒的“Kill-the-Winner”作用,即调控微生物群落结构和释放“被摄食者”的有机碳,进而促进活性有机质向RDOM转化并影响碳循环.
基于上述MCP理论提出10年来的研究进展,MCP的过程与机制总结于图2.
5 展 望
经过10年的研究,MCP理论框架得到了细化和完善,已被应用于解释海洋碳汇通量与气候变化的关系[9,114].此外,MCP被认为不仅适用于水体,也适用于解释土壤环境[115]及海洋沉积物[116]的储碳过程;MCP概念以及基于MCP的陆海统筹近海增汇和养殖区增汇路径也被纳入IPCC特别评估报告[1].
由于MCP过程机制的复杂性和应用潜力,其研究仍需进一步深入.基于现有研究进展,提出未来研究方向如下:1) MCP产物RDOM组分和化合物结构的解析,以及对应微生物功能类群吸收、胞内转化、释放这些RDOM的机制;2) RDOM在不同环境(河口、近海、开阔大洋表层、中层和深层带)的通量;3) 黑暗深海和低(缺)氧海区微生物和RDOM的动态变化及其碳汇效应;4) 古海洋MCP与气候变化的关系、未来海洋MCP效应的变化趋势及其对气候的调控作用[117];5) 基于MCP的跨学科(生物-化学-物理-沉积)“负排放”对“碳中和”的潜力[118].
致谢:感谢MCP理论提出人焦念院士对本文的启发,及周文楚对绘图的帮助.
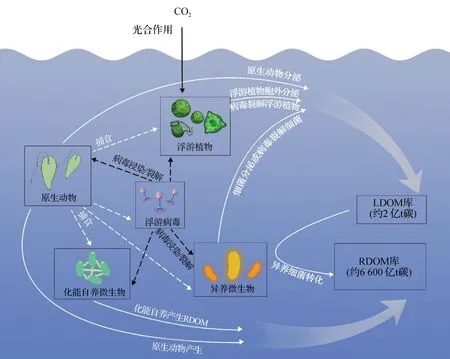
图2 MCP过程与机制Fig.2 Processes and mechanisms of MCP
