PDGF-BB诱导兔骨髓间充质干细胞向成骨细胞分化的实验研究①
2021-04-15买买艾力玉山张继秀
魏 琴,买买艾力·玉山,张继秀,吴 硕,马 创
(1新疆医科大学动物实验中心,2新疆医学动物模型研究重点实验室,乌鲁木齐830011;3新疆医科大学第一附属医院骨科中心,乌鲁木齐830054;4新疆昌吉职业技术学院,昌吉831100)
由创伤、感染、恶性肿瘤等引起的骨缺损,临床上处理比较困难,一般选用自体移植和异体移植的方法[1-2],较小的骨缺损一般选用自体或同种异体骨移植的方法进行治疗,而自体移植存在来源少、生长慢等的限制[3],异体移植存在免疫排斥、植骨存活率低等问题[4]。目前采用牵张成骨(DO)的技术取得了良好的疗效[5-7]。牵张成骨技术作为一种内源性组织工程技术,又被称为“自体骨组织工程技术”。但也存在新骨钙化慢,治疗周期长的问题[8]。为了加快新骨形成速度,研究人员引入干细胞[9]、生长因子[10]、激素[11]等促进新骨及其周围组织生成。骨髓间充质干细胞(BMSCs)可以作为种子细胞应用于DO骨的再生[12-13],BMSCs具有很强的增殖和分化能力,作为多能造血干细胞可以在不同诱导因子的作用下向成骨细胞[14]、血管细胞[15]、神经细胞[16]、骨骼肌细胞[17]等方面分化,这些细胞对于新骨的生成、牵张区结缔组织的构建、周围软组织的恢复以及DO新生骨痂的形成都具有重要作用。本实验拟采用血小板衍生生长因子BB(platelet-derived growth factor-BB,PDGF-BB)诱导兔骨髓间充质干细胞向成骨分化,为后期PDGFBB诱导后的细胞移植到牵张成骨区域是否能够加速动物模型骨折的愈合速度提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 普通级健康新西兰大白兔5只,雄性,4周龄,体重(2.0±0.2)kg,购自新疆医科大学实验动物中心,动物使用许可证号:SYXK(新)2018-0003。动物实验经新疆医科大学第一附属医院实验动物使用和管理委员会审核,伦理审批号:IACUC20180925-01。所有实验动物均在新疆医科大学实验动物中心按照国际AAALAC标准,遵循3R原则统一管理。
1.1.2 主要试剂及仪器 DMEM培养基(Gibco公司,美国);澳洲胎牛血清(1099141,Gibco公司,美国);1%青链霉素(Hyclone公司,美国);0.25%trypsin-0.02%EDTA消化液(Hyclone公司,美国);PBS(Hyclone公司,美国);CCK-8(日本同仁化学研究所);骨钙蛋白(osteocalcin,OCN)(Abcam,ab13418,英国);Ⅰ型胶原(COLIA1)(Novus Biologicals NB600-450,美国);Runt相关转录因子2(Runx-2)(博奥森bs-1134R,中国);一抗人PDGF-BB(Catalog#100-14B;R&D,美国);C02恒温培养箱(Thermo公司,美国);酶标仪(Thermo公司,美国);流式细胞仪(BD公司,孟加拉国);荧光倒置显微镜(Zeiss公司,德国)。
1.2 方法
1.2.1 兔骨髓的提取 碘伏棉球消毒新西兰大白兔双耳,沿耳缘静脉注射3%戊巴比妥钠(1 mL/kg)用于麻醉,采取正常体位由课题组成员将兔固定于手术台上,用骨髓穿刺针行髂前上棘穿刺骨髓,有落空感后抽出针芯,用20 mL注射器抽取5 mL骨髓液,注射器内预先含5 g/L肝素用于抗凝。
1.2.2 兔骨髓间充质干细胞的分离与培养 将抽出的骨髓悬液迅速拿到超净工作台,注入到等体积的DMEM培养基中,DMEM培养基中含有200 U/mL青链霉素,用新的20 mL注射器,更换为小号针头,反复吸吹骨髓悬液3遍,将骨髓小粒尽可能冲散,吸取细胞悬液于50 mL离心管中,1 000 r/min,5 min,弃上清,再用DMEM洗2遍,加入完全培养基(10%FBS+100 U/mL P/S+1%谷氨酰胺+DMEM),重悬细胞接种于25 cm2的培养瓶中,置于37℃、5%CO2培养箱中,3 d换液1次。待原代细胞长至90%左右时,细胞进行传代。吸弃培养基,加入2 mL PBS清洗细胞2次,用消化液消化细胞约2 min,细胞呈细沙状从瓶底脱落,以1∶3传代,每瓶接种于3个培养瓶中,并标记第1代和日期。接种后每3天换液1次,在荧光倒置显微镜下观察细胞形态及生长情况,并拍照记录,当细胞融合至90%左右时如上传代,余类推。
1.2.3 CCK-8法筛选PDGF-BB的最佳干预时间和最佳干预浓度 选取第3代对数生长期的细胞,吸弃培养基,用PBS洗1遍,加入胰酶消化,所得细胞用完全培养基制成5×104个/mL的细胞悬液,接种于96孔板中,每孔细胞悬液5×103个/mL,每组设5个复孔,接种完毕移至CO2培养箱继续培养,24 h后镜下观察,待细胞长至50%,即可加入PDGF-BB干预。实验分为空白组(BLANK组):加DMEM完全培养基;对照组(CONTROL组):BMSCs+DMEM完全培养基;其余各组采用PDGF-BB干预,浓度分别为10、25、50、100ng/mL,用完全培养基配置不同浓度的PDGF-BB,按每孔100 μL加入到96孔板中,于干预后的24、72、120、168 h各取出一块板用于CCK-8检测。取出96孔板,避光下每孔加入10μL CCK-8试剂,于普通恒温培养箱中避光37℃孵育3 h,用酶标仪在450 nm检测吸光度值,取5个孔平均值。以吸光度值的平均值为纵坐标,检测时间为横坐标,绘制不同浓度PDGF-BB吸光度值趋势图,即骨髓间充质干细胞的吸光度值在不同时间随着PDGF-BB药物浓度改变的折线图。
1.2.4 细胞免疫化学染色 取第3代兔BMSCs细胞,按1×105个/mL接种于含有盖玻片的24孔板内,24 h后细胞贴壁,镜下观察待细胞融合率达到50%左右,加入上述确定浓度的PDGF-BB诱导,待诱导时间到时,弃培养基,PBS清洗2遍,4%多聚甲醛固定30 min,PBS清洗3遍,分别加入一抗Runx-2(1∶400),Ⅰ型胶原(1∶300),骨钙素(1∶1 000),4℃冰箱过夜,PBS清洗3遍,5 min/遍,滴加通用型二抗,37℃孵育1 h,PBS清洗3遍,5 min/遍,二氨基联苯胺(DAB)显色,苏木素复染30 s,PBS清洗3遍,5 min/遍,显微镜下观察并拍照。
1.2.5 细胞免疫荧光染色 取第3代兔BMSCs细胞,按1×105个/mL接种于共聚焦小皿中,24 h后细胞贴壁,镜下观察待细胞融合率达到50%左右,更换为PDGF-BB诱导培养基,待诱导时间到时,弃培养基,PBS清洗2遍,4%多聚甲醛固定30 min,PBS清洗3遍,加入骨钙素(1∶1 000),4℃冰箱过夜,PBS清洗3遍,5 min/遍,滴加FITC-IgG二抗,37℃孵育1 h,PBS清洗3遍,5 min/遍,加入DAPI,室温5 min,激光共聚焦显微镜拍照。
1.3 统计学处理 采用SPSS 23.0对实验数据进行统计学分析,计量资料采用(-x±s)表示,检验水准α=0.05,各组数据经K-S检验符合正态分布(P>0.05),经Leven检验各组数据方差齐。数据分析主体效应检验采用重复测量方差分析,首先进行球形检验,其结果决定我们是看多变量检验还是主体内效应的检验。如果球形检验P>0.05,说明服从球形假设,各组间数据比较采用one-way AVONA检验。
2 结果
2.1 兔BMSCs形态学变化 细胞接种第3天,镜下可见大量漂浮细胞,紧贴瓶底低倍镜下即可见到细胞主要呈双极生长,有的呈集落生长,细胞由中心向四周发散生长,形态均一,双极的长梭形,细胞核呈圆形或椭圆形,并可见正在分化的细胞核,换液死细胞可直接换掉,镜下细胞更加清晰,如图1A。到第5天,细胞生长迅速,集落慢慢汇聚逐渐融合在一起,生长呈鱼群样,呈漩涡转生长。到第7天,已经看不到漂浮细胞,细胞基本铺满瓶底,可进行传代,如图1B。随着第1次传代后细胞进入快速生长期,当细胞融合至90%左右时如上传代,余类推,基本3 d即可传代1次。并且随着传代的次数增加,细胞形态越来越均一,生长排列整齐,折光性好,低倍镜下呈鱼群样、旋涡状生长,如图1C。

图1原代培养的兔BMSCs(X50)
2.2 PDGF-BB诱导后细胞形态的改变骨髓间充质干细胞经不同浓度PDGF-BB干预后24 h,不同浓度对细胞影响不大,>25 ng/mL时可见培养瓶中出现部分漂浮的死细胞,100 ng/mL漂浮细胞较多。干预后72 h时,细胞数量稳步增长,尤其是25 ng/mL时已经全部长满,且很少有死细胞,低倍镜下,细胞仍是集落样生长,偶见几个细胞围城的小管腔样结构,可见梭形细胞伸出细丝,如图2A;高倍镜下可见细胞之间伸出细长的丝,类似芽生结构,相互交错在一起。余下在瓶中散落的细胞形态上也发生很大改变,由原来的梭形生长有的变成了铺路石样生长,并且伪足变成了细长的丝,如图2B;<25 ng/mL时的细胞形态均为细胞形态改变不是特别明显,细胞仍是平铺密集生长。随着培养时间的延长,每个浓度的细胞都是越来越密集,>50 ng/mL时的细胞仍有不同程度的细胞死亡,尤其是100 ng/mL时第7天瓶底细胞仍然没有长满,且可见悬浮的死细胞。

图2 PDGF-BB诱导72 h的细胞形态
2.3 不同浓度PDGF-BB对骨髓间充质干细胞增殖的影响在不同的时间点间PDGF-BB干预BMSCs的吸光度值改变不同,差异均有统计学意义(F=441.351,P<0.001)。在不同浓度PDGF-BB干预BMSCs的组间比较吸光度值改变不同,差异均有统计学意义(F=70.685,P<0.001)。25 ng/mL PDGF-BB组与其他5组比较差异均有统计学意义(P<0.005);50 ng/mL、25 ng/mL、100 ng/mL PDGF-BB组与其他4组比较差异均有统计学意义(P<0.001);对照组与10 ng/mL、50 ng/mL PDGF-BB组比较差异无统计学意义,与其他4组比较差异均有统计学意义(P<0.001),见表1和图3。25 ng/mL PDGF-BB组在72 h吸光度值明显高于其他各组,随后又呈下降趋势,提示25 ng/mL PDGFBB组干预BMSCs在72 h对细胞有增殖作用。细胞随着PDGF-BB干预时间延长,细胞一直在增殖,但是100 ng/mL对细胞抑制作用较明显,会促进细胞凋亡。
表1不同浓度PDGF-BB对骨髓间充质干细胞增殖影响s,n=5)
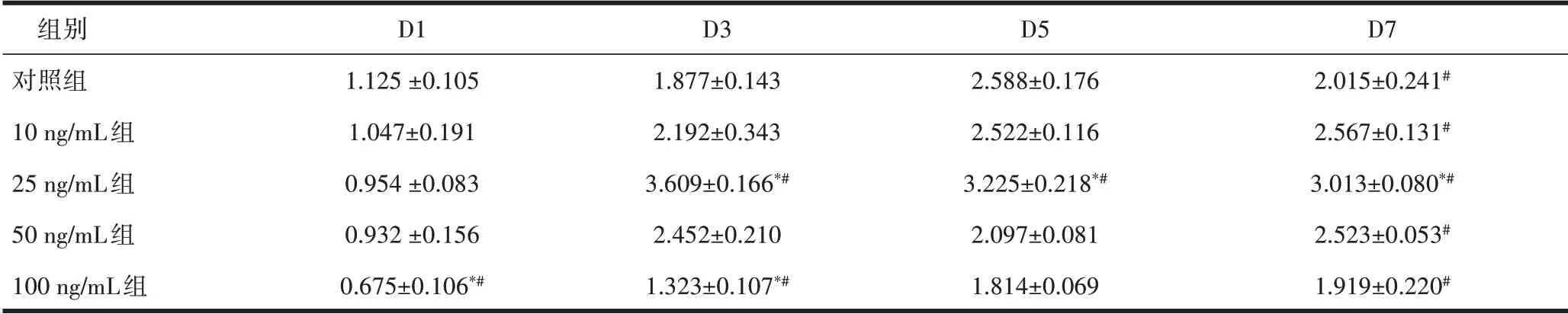
表1不同浓度PDGF-BB对骨髓间充质干细胞增殖影响s,n=5)
注:在同一时间点,与对照组比,*P<0.01;在相同浓度下,与第1天比较,#P<0.01。
组别对照组10 ng/mL组25 ng/mL组50 ng/mL组100 ng/mL组D1 1.125±0.105 1.047±0.191 0.954±0.083 0.932±0.156 0.675±0.106*#D3 1.877±0.143 2.192±0.343 3.609±0.166*#2.452±0.210 1.323±0.107*#D5 2.588±0.176 2.522±0.116 3.225±0.218*#2.097±0.081 1.814±0.069 D7 2.015±0.241#2.567±0.131#3.013±0.080*#2.523±0.053#1.919±0.220#
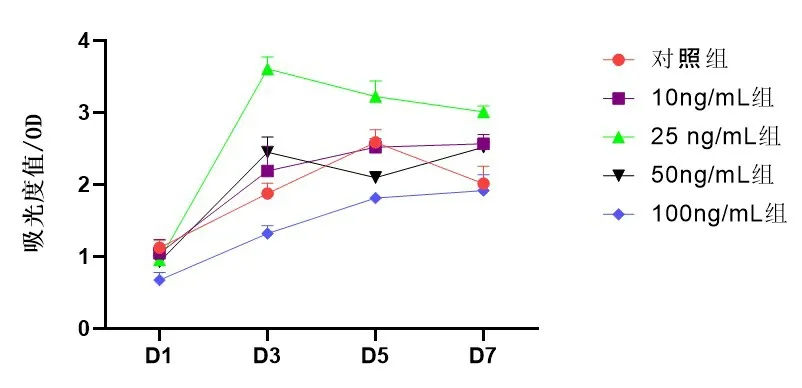
图3不同浓度PDGF-BB干预骨髓间充质干细胞的吸光度变化图
2.4 诱导后细胞的免疫化学染色结果 诱导后的细胞免疫化学成骨相关蛋白染色结果显示,3种抗体染色,OCN和Runx-2阳性细胞胞浆均着棕色,阳性率>90%,而COL-I可见许多胞浆为棕色的阳性细胞。见图4。
2.5 诱导后细胞的免疫荧光染色结果 成骨相关蛋白OCN显示经PDGF-BB诱导72 h的BMSCs都有绿色荧光的表达,绿色荧光表达率>90%,经DAPI染色后核着蓝色,说明BMSCs经PDGF-BB诱导72 h成骨细胞阳性率较高。见图5。

图4 PDGF-BB诱导后细胞免疫化学染色
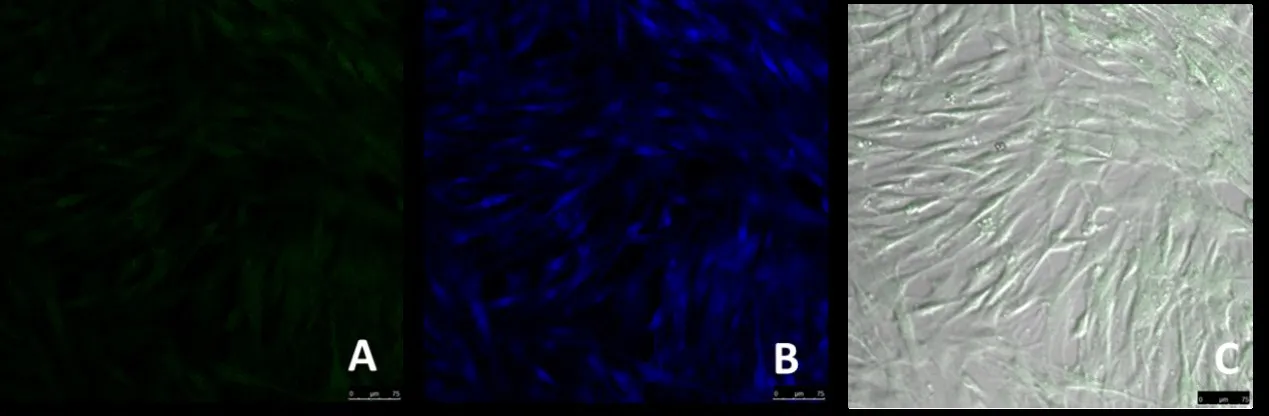
图5 PDGF-BB诱导后免疫荧光染色
3 讨论
骨髓间充质干细胞是具有多向分化潜能的干细胞,目前组织工程骨研究多趋向于使用骨髓间充质干细胞作为种子细胞[18-19]。与骨髓中其他种类的细胞比较,骨髓间充质干细胞含量很少,丰度也不高[20],但是在骨折、骨缺损时却需要大量的骨髓间充质干细胞分化为所需要的靶细胞,并依靠细胞的归巢功能[21],迁移到损伤区域,进行组织修复。因此在损伤时需要大量的骨髓间充质干细胞在体外条件下进行分离纯化扩增,并在相应的诱导因子作用下诱导为靶细胞就显得尤为重要[22]。
本研究首先进行了新西兰大白兔骨髓间充质干细胞的原代培养纯化,采用全骨髓培养法,其优点是可以快速的获得细胞,减少分离过程中细胞的死亡率,同时减少了污染几率,缺点是细胞没有密度梯度离心法的纯度高,但是可以通过传代及流式分选的方法获得纯度较高的种子细胞。全骨髓培养法细胞生长很快,本实验中第7天细胞已经长满,即可传代,按1∶3传代,细胞只需要3 d就可以长满,可能原因一方面是兔骨髓间充质干细胞的细胞体积较大,很快就能铺满瓶底;另一方面是选用的兔子为1月龄的动物,骨髓间充质干细胞的原始细胞较多,再生能力较强,增殖分化能力较强。因此2周左右细胞就进入了P3对数生长期,可用于进行药物干预实验。
血小板衍生生长因子(PDGF)最初从血小板中分离出来,是间充质干细胞迁移和增殖的关键生长因子,PDGF-BB在骨折愈合的早期就出现,作用贯穿全程,各阶段均能够有效诱导软骨细胞及成骨细胞增生,同时可提高破骨细胞活性、加速骨吸收,促进骨重塑[23]。PDGF-BB促进骨细胞形成的同时也可促进骨组织中血管的形成[24]。联合应用PDGF-BB和BMP-2在不同浓度梯度作用下可以促进脂肪干细胞分化为成骨细胞[25]。本实验应用PDGF-BB诱导兔骨髓间充质干细胞向成骨分化,采用不同的干预浓度及干预时间,以探讨最佳干预时间和浓度。
本实验选用了最低浓度为10 ng/mL,最高浓度为100 ng/mL。研究表明PDGF-BB在50 ng/mL作用于脂肪干细胞是抑制胶原蛋白的形成[26]。实验发现,PDGF-BB>50 ng/mL,细胞生长就会受到抑制,尤其是100 ng/mL的细胞镜下死亡细胞较多,在25 ng/mL诱导第1天可见有视野中有漂浮细胞,第3天可见皿底细胞已经全部长满,10 ng/mL同样可以促进细胞增殖,但是作用没有25 ng/mL强,最终选择25 ng/mL诱导BMSCs第三天进行下一步细胞鉴定实验。
本实验选择OCN、Runx-2、COL-I作为细胞鉴定指标。Ⅰ型胶原蛋白(COL-I)是骨细胞外基质的重要组成部分,在成骨细胞的增殖分化中起重要作用,也是成骨细胞重要的特异性基因[25],是成骨细胞成熟的重要标志[27]。Runx-2又称核心结合因子Cbfal,在成骨细胞分化中被认为是重要的特异转录因子,在成骨分化的早期比较活跃[28-29]。OCN主要表达于成骨细胞分化的晚期,其表达升高说明成骨细胞开始进入矿化期[30-31]。从本研究结果可以看出,经PDGFBB诱导后的BMSCs的细胞免疫化学OCN和Runx-2阳性表达率均较高,COL-I阳性表达略低于OCN和Runx-2,但也是阳性表达,说明诱导后的细胞已经形成了成熟的成骨细胞,同时细胞免疫荧光OCN为阳性表达,也证实了诱导后的细胞发育为成熟的成骨细胞。
综上所述,本研究验证了兔BMSCs经25 ng/mL PDGF-BB诱导第3天时细胞增殖能力较强,且诱导后的细胞经过鉴定均发育为成熟的成骨细胞,为下一步组织工程骨移植实验奠定了基础。
