微小染色体维持蛋白4在胰腺导管腺癌中的表达及其与预后相关性研究
2021-04-14刘宾刘辉李宝玉
刘宾 刘辉 李宝玉
天津医科大学第二医院胃肠外科300211
0 引 言
胰腺癌被称为“癌中之王”,是一类主要起源于胰腺导管上皮细胞的恶性肿瘤[1]。胰腺癌的恶性程度高,早期诊断困难,起病迅速,是预后最差的一种恶性肿瘤,其发病率与死亡率在全球均高居恶性肿瘤前10 位[2]。中国国家癌症中心的数据表明,2019年我国胰腺癌的发病率居恶性肿瘤第10 位,死亡率高居第6 位。按照病理类型,胰腺癌主要分为胰腺导管腺癌(约占80%)、腺鳞癌、腺泡细胞癌等[3]。手术结合放射治疗、化学治疗是胰腺癌的主要治疗手段,但临床效果欠佳[4]。胰腺癌缺乏显著的早期症状,因此其早期诊断至关重要[5]。
胰腺癌的早期诊断常用标记物包括CEA、CA199、CA242 等,尽管其在一定程度上能预测胰腺癌的发生,具有一定的早期诊断价值,但特异性均有待提高,并需结合影像学手段加以进一步判断[6]。为了提高胰腺癌患者的早期诊断率,降低死亡率,仍需发现更为有效的胰腺癌生物标记物。
微小染色体维持蛋白(minchromosome maintenance proteins,MCM)主要负责染色体功能维持及DNA 复制起始[7]。MCM 蛋白家族高度保守,具有保守的MCM 盒结构域,是一种依赖DNA 的三磷酸腺苷(adenosine triphosphate,ATP)酶[8]。MCM 家族主要包括8 个成员,这些成员能够形成多聚体而发挥功能[9]。MCM4 是MCM 家族的一个重要成员,与MCM4 突变相关的疾病主要包括免疫缺陷和家族糖皮质激素缺乏等[10]。近年来,MCM4 对肿瘤的影响已得到广泛的揭示[11]。MCM4 可作为一种可靠的肿瘤标记物[12]。在多种肿瘤组织中(如膀胱癌及胃癌中),MCM4 均异常表达,并与患者的不良预后及临床病理特征密切相关[13]。在胃癌中,MCM4 蛋白与肿瘤的分化程度及淋巴转移有关,低分化癌组织中的MCM4表达高于高分化癌,且淋巴转移组的MCM4 表达高于未转移组[14]。然而截至目前,MCM4 与胰腺癌这一高恶性程度肿瘤的潜在关联仍不明确。
本文中,通过生物信息学分析与免疫组化分析,探索胰腺癌中MCM4 的表达情况,以及其表达量与临床病理特征的关系,以便进一步了解MCM4在胰腺癌中的作用,为胰腺癌的发现、监测及治疗提供新的思路。
1 资料与方法
1.1 临床资料
选择2015年3月至2019年3月,天津医科大学第二医院胃肠外科收治的经手术治疗的胰腺癌患者76例。其中,男性44例,女性32例,年龄(54.5±5.8)岁。全部病例均经过病理证实,术前未经化疗或放疗,且具有完整的病例资料。收集患者的一般临床资料,包括年龄、性别、肿瘤分级和肿瘤大小等。76例病例中,肿瘤为低级别者35例,高级别者41例;肿瘤大小<4 cm 者28例,≥3.5 cm 者48例。
1.2 主要材料与仪器
MCM4 兔抗人单克隆抗体(ab124836,英国Abcam公司),PV-6001 免疫组化检测试剂盒、ZLI-9018 二氨联苯胺(diamio benzidine,DAB)显色试剂盒(北京中衫金桥生物技术有限公司。
RM2235 型石蜡切片机(德国Leica 公司),BX51型显微镜(日本奥林巴斯公司)。
1.3 免疫组织化学检测方法
胰腺导管腺癌肿瘤及癌旁组织通过福尔马林固定,石蜡包埋。包埋后蜡块标本进行3 μm 切片,进一步进行MCM4 免疫组化染色。切片于75 ℃孵育30 min,随后用二甲苯脱蜡,并用梯度乙醇溶液(100%,100%,95%,85%,80%,75%)水合。水合完毕后使用柠檬酸缓冲液孵育20 min 提取抗原,并阻断内源性过氧化物酶5 min,使反应充分进行。随后用质量浓度为50 g/L 的牛血清白蛋白(bovine serum albumin,BSA) 封闭液封闭30 min。封闭后使用MCM4 抗体孵育2 h,抗体采用1∶100 稀释。然后切片用生物素化的二抗孵育1.5 h,通过DAB 法显色,苏木素染色细胞核。免疫组化切片于显微镜下观察并拍照采集图像,根据肿瘤细胞阳性染色面积和染色强度综合评价免疫组化结果。
通过染色证实,MCM4 蛋白在肿瘤组织中呈胞浆定位。随机选取5 个不同的视野,依照阳性细胞在总细胞数中的比例进行评定。阳性细胞比例评分标准:肿瘤细胞阳性百分数<20%时,记0分;20%~50%时,记1分;50%~70%时,记2分;>70%时,记3分。阳性染色强度评分标准:阴性染色记0分;弱阳性染色记1分;中阳性染色记2分;强阳性染色记3分。以阳性细胞百分比评分和染色强度评分的和判断表达情况,总分范围为0~6分。总分为0~2分为MCM4 低表达,3~6分为MCM4 高表达。
1.4 统计学方法
采用Graphpad 5.0 统计学软件处理数据。通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)数据库分析MCM4 的mRNA 在胰腺导管腺癌组织中的表达情况。通过ProteinAtlas数据库(https://www.proteinatlas.org/ENSG00000104738-MCM4/tissue)分析不同肿瘤组织中MCM4 的表达与患者预后的相关性,并通过GEPIA 数据库比较胰腺导管腺癌患者MCM4 不同表达组的总生存及无病生存率差异(http://gepia.cancer-pku.cn/detail.php?gene=MCM4)。符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,通过卡方检验比较临床病理特征与患者胰腺导管腺癌组织MCM4 表达之间的相关性,以P<0.05 为差异有统计学意义。
2 结 果
2.1 MCM4 的生物信息学分析结果
有研究结果证实,MCM4 在多种肿瘤中异常表达并提示不良预后。因此,通过ProteinAtlas 数据库分析MCM4 的mRNA 在不同肿瘤中与患者生存期之间的相关性。结果表明,MCM4 的mRNA 水平与多种肿瘤患者的生存期之间具有显著相关性,包括子宫内膜癌、黑色素瘤、肝癌、结肠癌、胰腺癌及肾癌,提示MCM4 可作为相关肿瘤预后的预测因子(图1)。
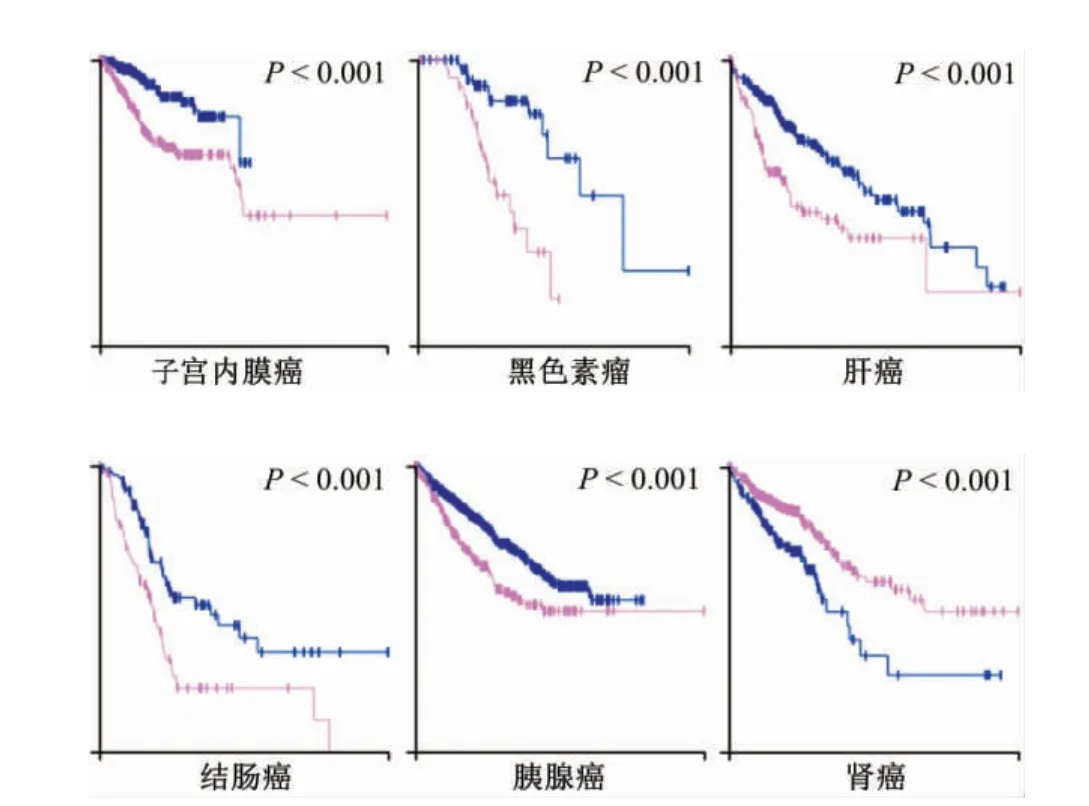
图1 微小染色体维持蛋白4(MCM4)在不同肿瘤组织中与患者预后间的关联
通过GPEIA 数据库分析MCM4 的mRNA 水平在胰腺导管腺癌组织和正常组织中的表达情况,共分析人胰腺导管腺癌组织179例及对应的癌旁正常组织171例。如图2 所示,MCM4 的mRNA 在胰腺导管腺癌组织中呈显著高表达(P<0.05)。
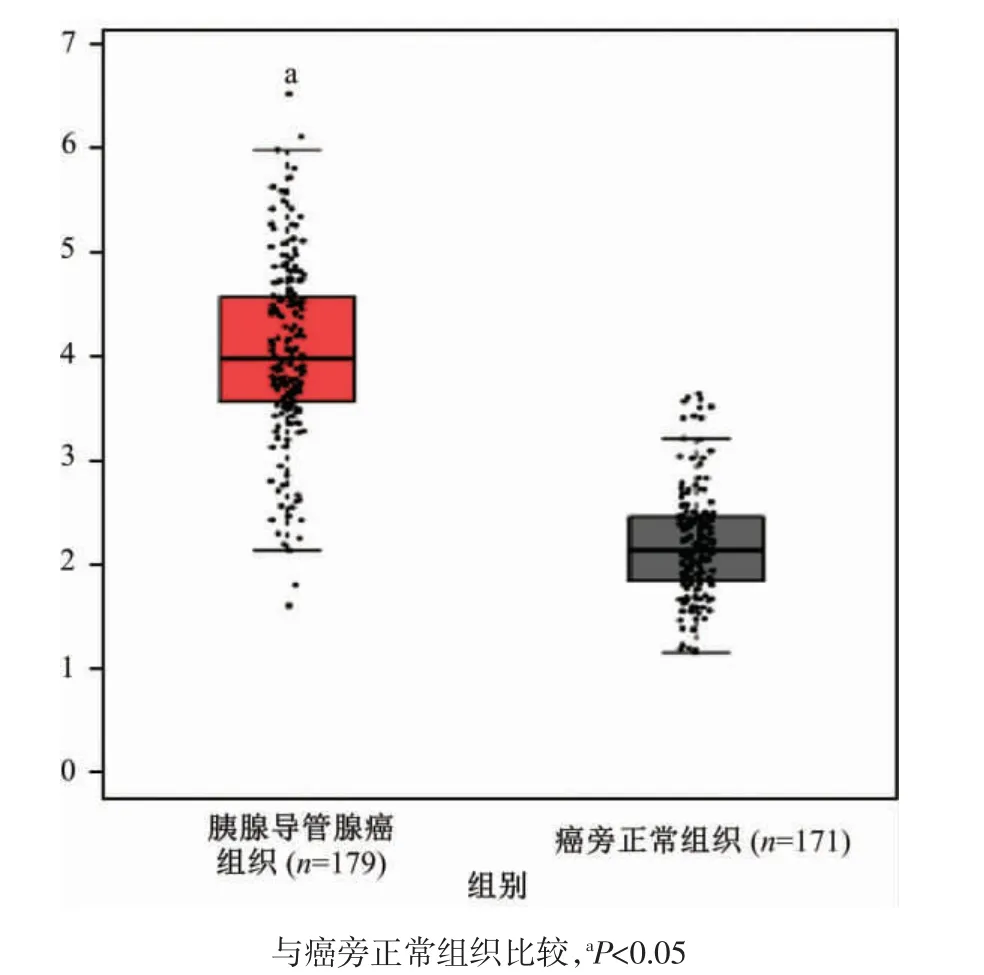
图2 胰腺导管腺癌中微小染色体维持蛋白4(MCM4)的mRNA 表达
进一步通过GPEIA 数据库分析MCM4 的表达与胰腺导管腺癌患者的预后的潜在关联。结果表明,MCM4 的表达与胰腺导管腺癌患者的总生存率及无病生存率均密切相关(图3)。该结果提示,MCM4 的表达与患者的预后密切相关。
2.2 MCM4 在胰腺导管腺癌组织中的表达
通过免疫组织化学染色方法检测MCM4 在76例行手术切除的胰腺导管腺癌患者的肿瘤组织及其对应的癌旁组织中MCM4 蛋白表达情况。结果显示,MCM4 定位于胞浆,其表达量在胰腺导管腺癌组织中明显高于癌旁正常组织(图4A)。根据染色的强度,将胰腺导管腺癌患者分为MCM4 高表达组和MCM4 低表达组。分组后发现,MCM4 在癌旁正常组织中的表达量显著降低(图4B)。
2.3 MCM4 蛋白表达与胰腺导管腺癌患者的临床病理特征相关
为了进一步明确MCM4 对胰腺导管腺癌的临床意义,分析比较了MCM4 表达情况与胰腺导管腺癌患者的临床病理特征之间的关联。比较了MCM4高表达组与MCM4 低表达组的临床病理特征差异,包括年龄、性别、肿瘤分级及肿瘤大小。结果表明,MCM4 的表达水平与胰腺导管腺癌患者的肿瘤大小显著相关(P=0.038),而与其他的临床特征,如年龄(P=0.818)、性别(P=0.845)、肿瘤分级(P=0.632)无关(表1)。
3 讨论与结论
胰腺癌患者的预后极差,5年总生存率不足5%。行根治性切除术的患者,往往由于肿瘤的转移及复发,5年总生存率不到20%[15]。胰腺癌的主要死亡原因包括肿瘤直接导致的并发症或胰腺癌术后的并发症[16]。如果能对胰腺癌进行早期诊断与治疗,患者术后2年的存活率可达40%[2]。早期诊断和早期治疗是提高和改善胰腺癌预后的关键,而新兴的靶向治疗与免疫治疗已经初见曙光,多种靶向治疗药物开始用于临床[17]。胰腺癌的早期诊断需要高效且灵敏的生物标记物。作为传统的胰腺癌标记物,CA199、CEA 等已取得了一定的效果,但其灵敏度与特异性均有待提高[18]。近期研究结果表明,白血病抑制因子(leukemia inhibitory factor,LIF)在胰腺导管腺癌组织中显著高表达,且比CA199 的各项指标更加突出,而进一步的临床实验仍待进行。本研究中,MCM4 蛋白在胰腺导管腺癌组织中呈现显著高表达,并与患者的临床病理特征及不良预后密切相关,相关结果证实MCM4 可作为胰腺导管腺癌的预后预测因子和潜在的生物标记物。
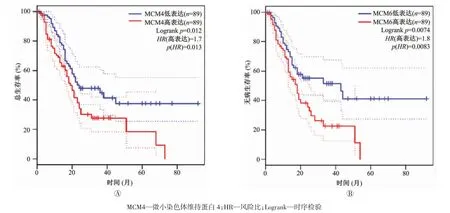
图3 微小染色体维持蛋白4(MCM4)表达与胰腺导管腺癌患者生存率的相关性

图4 胰腺导管腺癌组织和癌旁正常组织中微小染色体维持蛋白4(MCM4)的免疫组化结果
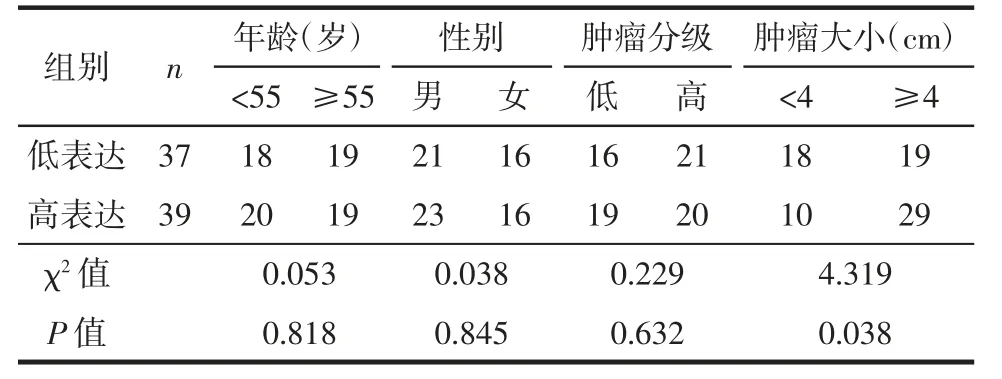
表1 微小染色体维持蛋白4(MCM4)蛋白表达与胰腺导管腺癌患者临床病理特征的相关性分析
本研究中,通过生物信息学分析,发现179例胰腺导管腺癌样本中MCM4 的mRNA 呈显著高表达,且MCM4 的mRNA 水平与胰腺导管腺癌患者的总生存率及无病生存率密切相关。该结果证实了MCM4 与胰腺导管腺癌患者的预后存在相关性,暗示其可作为胰腺导管腺癌的预后预测因子。此外,免疫组化分析结果显示,MCM4 在76例胰腺导管腺癌组织样本中显著高表达。因此,综合生物信息学分析和免疫组化分析结果。可以得出MCM4 在胰腺导管腺癌中呈现高表达,并暗示MCM4 可作为一个潜在的胰腺导管腺癌生物标记物。
进一步,通过分析免疫组化结果与患者的临床病理特征之间的关系,发现MCM4 与胰腺导管腺癌的肿瘤大小显著相关。这暗示MCM4 在胰腺导管腺癌的发生发展中具有重要作用。肿瘤的生长包括多个重要阶段,如肿瘤细胞的增殖、迁移及新生血管形成等,而失控的细胞增殖是其中的关键环节。MCM4 的表达与肿瘤大小相关,提示MCM4 可能会对胰腺导管腺癌细胞增殖有影响。下一步需要通过体外实验加以证实,以便为探索胰腺导管腺癌的有效治疗靶点提供新的线索。
MCM4 对于肿瘤发生发展的影响已有广泛的报道[19]。作为一个和细胞周期相关的调控基因,MCM4可通过多种手段调控肿瘤的进展。MCM4 的过表达是喉部鳞状细胞癌的一个潜在的预后标志物[19]。另外,在卵巢癌中,E2F2 可诱导MCM4 的表达上调,并与患者的不良预后显著相关[13]。在食管腺癌、鳞状细 胞 癌 和 癌 前 病 变 中,MCM4 与Ki-67、Bmi1 和cyclin E 的表达显著相关[19-20]。上述这些结果和本研究结果证实了MCM4 可作为多种肿瘤的预后预测因子及潜在的生物标记物。
MCM4 本身对于细胞周期、细胞分裂及DNA复制具有重要的调控作用[10,21-23]。有研究者证实了MCM4、SLD3 和DBF4 在控制DNA 复制进程中具有协同作用[24-25]。MCM4 是启动DNA 复制所必须的关键基因,是前复制复合体的关键组成部分[20,26]。MCM4经检查点激酶ATR 及CDK2 磷酸化后可抑制相关解旋酶活性,进而抑制DNA 复制过程[27]。这暗示MCM4 在肿瘤组织中的异常表达会影响DNA 复制,进一步影响相关肿瘤的发生、发展及预后。同时,MCM4 在全身多处组织中均广泛表达,而其对于胰腺导管腺癌的影响是否由于对DNA 复制的调控仍然值得进一步的体内外研究加以证实。
综上,胰腺导管腺癌是一种恶性程度极高且预后极差的肿瘤。MCM4 在人胰腺导管腺癌组织中呈现异常高表达且与胰腺导管腺癌患者的肿瘤大小显著相关;MCM4 的表达与胰腺导管腺癌患者的预后密切相关。以上结果表明,MCM4 可能是胰腺导管腺癌的潜在生物标记物。
利益冲突所有作者均声明不存在利益冲突
