p38MAPK抑制剂对高脂血症性急性胰腺炎大鼠肠道微生物区系的影响
2021-04-14李臻张晓英杨国栋
李臻,张晓英,杨国栋
(1.川北医学院基础医学院,四川 南充 637000;2.川北医学院附属医院 消化内科,四川 南充 637000)
急性胰腺炎(acute pancreatitis,AP)是一种可引起全身炎症反应综合征、脓毒症、多器官功能障碍综合征、胆石症等而危及生命的疾病,胆道疾病、酒精、高脂饮食等是AP的常见病因[1-2]。 近年来,随着饮食结构的变化,高脂血症性急性胰腺炎(hyperlipidemia acute pancreatitis,HLP)的发病率明显上升,据统计,12%~38%的高脂血症患者发生AP[3]。目前,HLP的主要治疗方法是血液净化、降血脂等以达到降低血清甘油三酯水平,防止全身炎症反应,虽然以上治疗可以降低血清甘油三酯,但目前尚无治疗HLP的正式策略[4]。因此,需要开发更有效的治疗HLP的方法。
肠道微生物区系多样性和结构的变化与代谢和炎症性疾病的发病机制有关,包括糖尿病、肥胖症和动脉粥样硬化等[5]。研究表明AP大鼠的肠道微生物区系结构发生了变化,并在门水平上糖化细菌门和软壁菌门的丰度降低[6]。Nishiyama等[7]证明慢性胰腺炎患者肠道内关键有益菌的丰度增加,其中包括黏液阿克曼氏菌和罗伊氏乳杆菌。然而,与HLP患者肠道微生物区系变化相关的研究仍然有限。相关报道指出全身和肠道过度释放炎性细胞因子会导致AP的发生,p38MAPK信号通路的激活参与了炎症的调节,抑制p38MAPK信号转导可作为降低中性粒细胞炎症的选择性干预措施[8],p38MAPK抑制剂SB203580已被证明可以减轻AP患者肠黏膜屏障的损伤[9]。然而,p38MAPK信号通路在HLP肠道炎症和微生物区系失调中的作用仍不清楚。故本研究观察p 38 MAPK抑制剂SB203580对HLP肠道微生物区系失调及炎症的影响,为HLP的治疗提供理论和实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物健康雄性SD 大鼠24 只,体质量250~300 g,由成都达硕实验动物有限公司提供,使用许可证号[SYXK(川)2019-189],生产许可证号[SCXK(川)2020-030]。大鼠在控制温度(23±1)℃和相对湿度65%~70% 的情况下,按12 h 的光/ 暗周期饲养,所有大鼠标准饲养,适应性饲养1 周后,将大鼠按照随机数字法分为3 组,假手术组、模型组、p38MAPK 抑制剂(SB203580)组。
1.1.2 主要试剂与仪器p38MAPK 抑制剂(SB203580)( 批号:124-20-9)购自上海吉至生化科技有限公司(Mr=145.25);D- 乳酸(D-lactate,货号:ZC-36102)、二胺氧化酶(DAO,ZC-36566)、白介素1β(IL -1β, 货号:ZC-36391)、肿瘤坏死因子α(TNF-α,货号:ZC-37624)、白介素6(IL-6, 货号:ZC-36404)ELISA 试剂盒购自上海茁彩生物科技有限公司;p38MAPK(批号:8690)、p-p38MAPK(批号:4511)相关抗体购自Cell Signaling Technology(CST)公司(中国);蛋白定量试剂盒(BCA 法)购自R&D 公司(美国);正置荧光显微镜(型号:DM3000)购自德国Leica 公司。
1.2 实验方法
1.2.1 高脂血症性AP 大鼠模型建立模型组、SB203580 组:大鼠给予高脂饲料(77%普通饲料+ 20% 猪油+3% 胆固醇)喂养4 周后,2% 戊巴比妥钠(0.3 mL/100 g)腹腔注射麻醉,常规消毒、固定、备皮、铺消毒洞巾,取剑突下腹部正中切口入腹,长约2~3 cm,寻找十二指肠及胰胆管,确认后使用血管夹阻断肝门胆管,头皮针经乳头对侧十二指肠壁穿刺进入十二指肠腔,经十二指肠乳头逆行入胰胆管,深度约5 mm,使用血管夹将头皮针固定于十二指肠乳头,使用微量泵恒速将5%牛磺胆酸钠(1 mg/kg)注入胆胰管内,结束后仍保持压力8 min,去除血管夹及穿刺针,观察到出现胰腺水肿伴出血后缝合腹壁,术后皮下注射0.9%生理盐水5 mL 补充血量。假手术组:大鼠予以普通饲料喂养4 周后,术中仅轻轻翻动十二指肠和胰腺,不注射牛磺胆酸钠,在确保腹腔中没有活动性出血后,关闭腹腔。SB203580 组大鼠造模前1 h 腹腔注射SB203580(5 mg/kg),假手术组、模型组大鼠注射等量生理盐水。
1.2.2 样本采集各组大鼠分别于造模后12 h 腹主动脉采血,采集每组大鼠新鲜粪便样本(10±5)g,置于密闭的无菌便盒中,迅速放入-80 ℃冰箱内保存,每组样本数≥6 用于肠道微生物检测。后处死大鼠,分别取远端回肠和胰腺组织,用4% 多聚甲醛固定。
1.2.3 胰腺和回肠组织病理学观察将固定的胰腺和远端回肠组织经全自动脱水机脱水,包埋,切片,放入苏木精中染色约10 min,自来水冲洗使切片颜色变蓝,1% 盐酸酒精分化数秒钟,使细胞核呈紫蓝色,1% 氨水中数秒,至返蓝,1% 伊红染色3 min 左右,脱水,透明,中性树胶封存,镜检观察组织病理变化,以Chiu 等[10]肠组织损伤评分标准和Schmidtt[11]胰腺组织评分标准进行组织病理评分。
1.2.4 酶联免疫吸附法(ELISA)检测采用ELISA 试剂盒检测血浆D- 乳酸、DAO 含量及肠道组织中IL-1β、TNF-α 和IL-6 的水平。
1.2.5 Western blot 分析用RIPA 裂解液提取回肠组织总蛋白,BCA 蛋白检测试剂盒测定总蛋白水平。然后用8%~12% SDS-PAGE 分离蛋白质样品,将蛋白转移到聚偏氟乙烯膜上,用含有5% 脱脂牛奶的TBS/T 缓冲液封闭聚偏氟乙烯膜,然后与抗p38MAPK 或p-p38MAPK 抗 体(1:1000)4 ℃孵育过夜,然后与过氧化物酶标记的山羊抗兔抗体或抗鼠免疫球蛋白G(IgG)抗体在37 ℃孵育1 h。取出聚偏氟乙烯膜,化学发光法获得胶片后进行图像采集,目标条带A值采用Quantity One 凝胶图像软件分析,以目标条带与β-actin 条带A值的比值作为相应蛋白相对表达量。实验进行3 次重复。
1.2.6 肠道微生物区系分析对样本进行16S rDNA 基因测序,参照粪便基因DNA 磁珠法提取试剂盒说明,采用磁珠法提取粪便样本DNA,抽提所得DNA 采用Qubit 2.0 和2% 琼脂糖凝胶电泳进行质检,将质检合格的基因组DNA 纯化后进行两轮PCR 扩增,构建样本测序文库,Qubit®2.0荧光剂检测样本浓度,Agilent 2100 检测文库的大小,然后按照MiSeq 测序试剂说明书,进行上机测序,鉴定肠道菌群组成以及表达峰度,数据采用QIIME 软件进行统计分析。
1.3 统计学处理
OUT序列和α/β多样性分析通过QIIME分析软件实现,采用SPSS 20.0软件进行数据统计分析,计量资料均以均数±标准差(±s)表示,且均符合正态分布,组间比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠胰腺和回肠组织病理变化及评分
假手术组:胰腺和回肠组织未见明显增生、坏死及炎性细胞浸润。模型组:胰腺组织部分胰岛内细胞变性坏死,见细胞崩解,胞核溶解消失,间质内和血管周围较多炎细胞浸润;回肠组织肠绒毛顶部上皮细胞变性坏死,见细胞崩解,胞质淡染,固有层毛细血管暴露,细胞成分增多,毛细血管充血。SB 2035 80 组:胰腺组织薄层纤维组织被膜较为完整,叶间隙略微增宽,部分胰岛内少量细胞变性坏死,腺泡上皮细胞少量变性坏死,间质内和血管周围少量炎细胞浸润;回肠组织黏膜层、黏膜下层、肌层及外膜结构较完整,黏膜固有层内管状肠腺结构较清晰,局部炎细胞聚集增多,以淋巴细胞为主,肌层和浆膜层未见明显炎性细胞浸润和增生(图1A)。组织病理评分结果显示,与假手术组相比,模型组胰腺、回肠组织病理评分明显升高(P<0.01);与模型组比较,SB203580组胰腺、回肠组织病理评分明显降低(P<0.01)(图1B)。
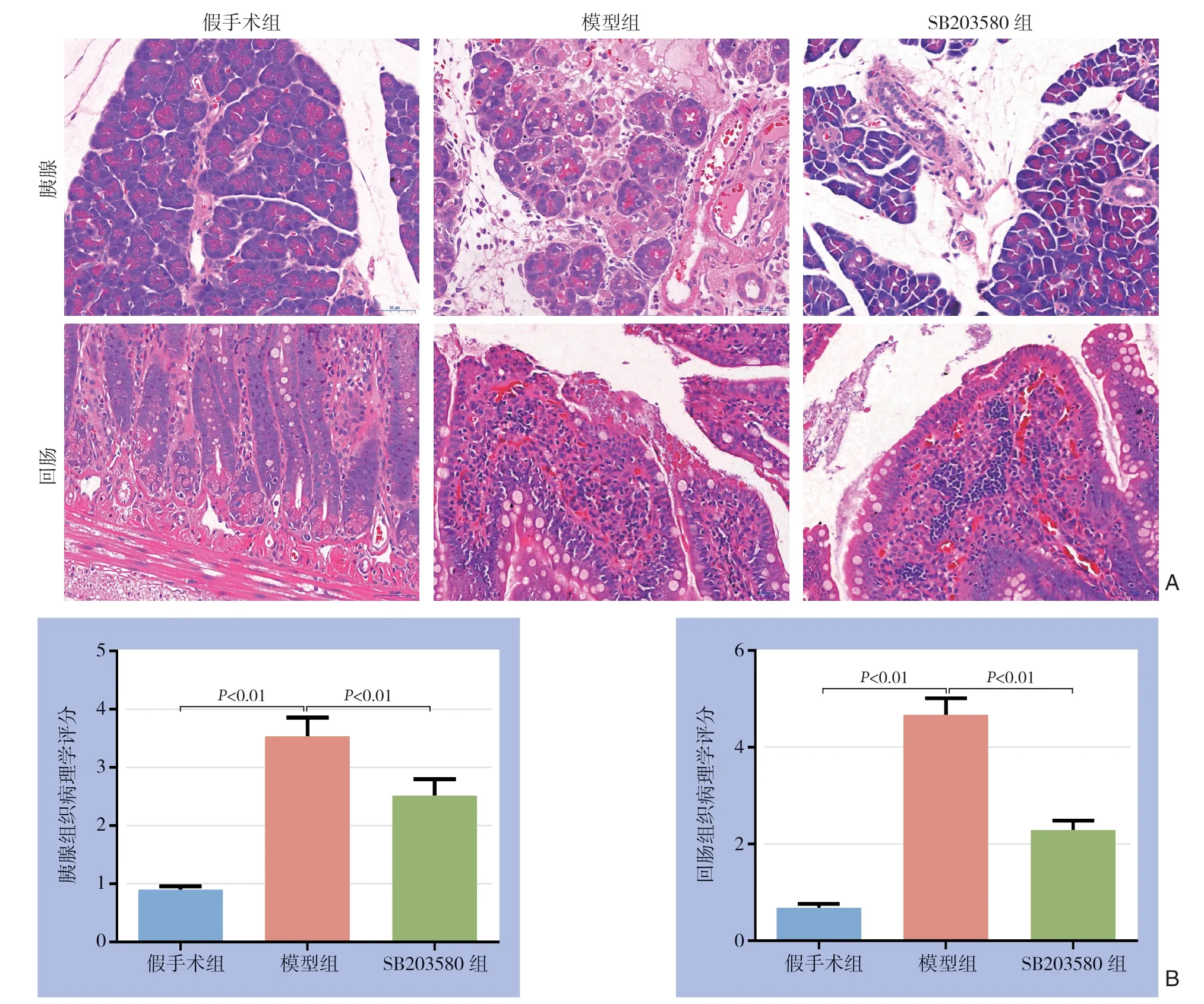
图1 各组大鼠胰腺和回肠组织病理变化及评分 A:胰腺与回肠组织病理变化(HE×400);B:胰腺与回肠组织病理学评分 Figure 1 Pathological changes and scores of pancreas and ileum tissues of rats in each group (HE×400) A: Pathological changes of the pancreas and ileum tissue; B: Pathological scores for pancreas and ileum tissue damage
2.2 各组大鼠肠屏障功能及细胞因子变化
与假手术组比较,模型组大鼠血浆D-乳酸、DAO及回肠组织IL-1β、TNF-α、IL-6含量明显升高(均P<0.05);与模型组比较,SB203580组大鼠血浆DAO及回肠组织IL-1β、TNF-α、IL-6含量明显降低(均P<0.05),血浆D-乳酸含量降低,但差异无统计学意义(P>0.05)(图2)。
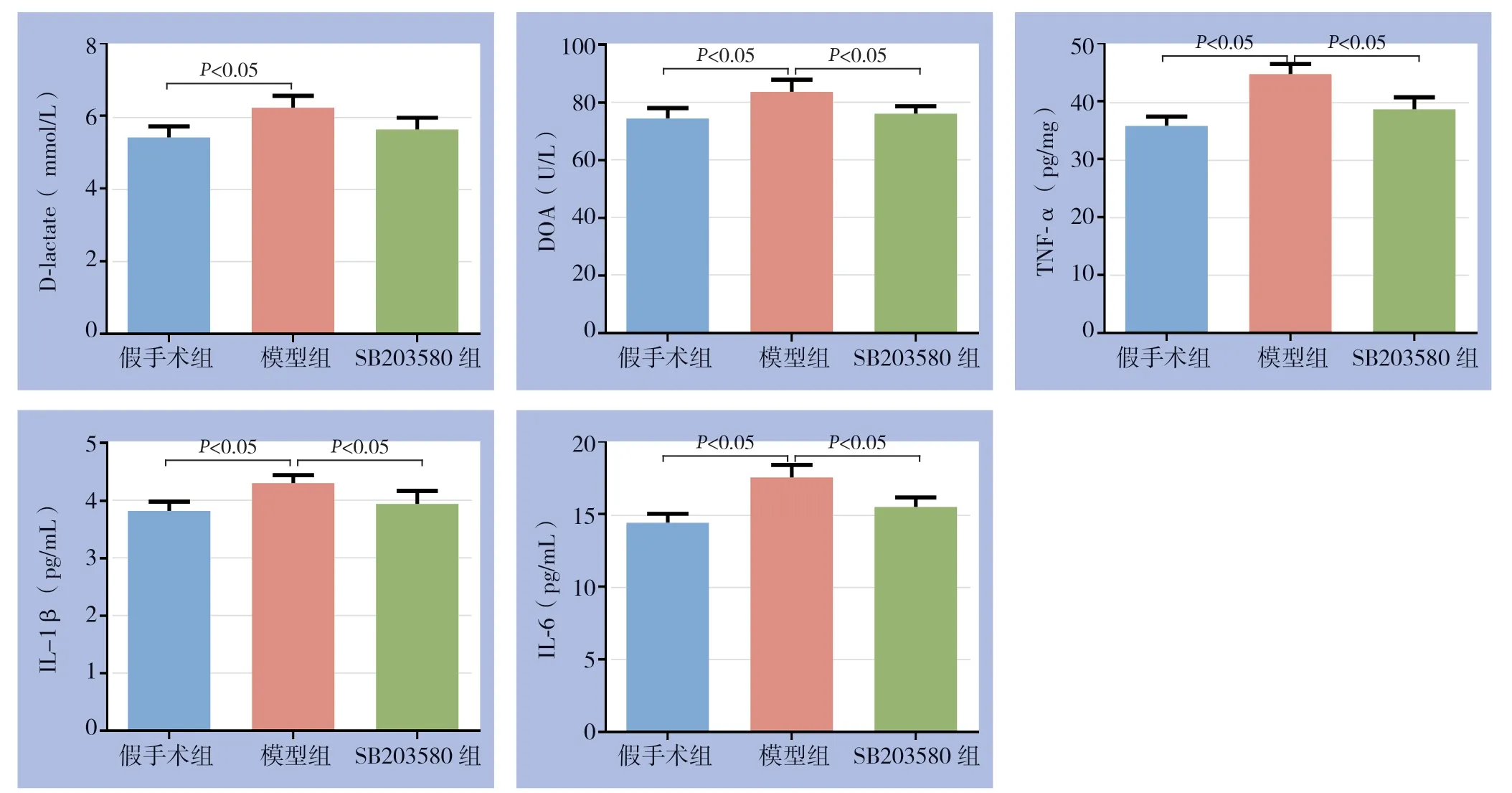
图2 各组大鼠肠屏障功能及细胞因子变化Figure 2 Changes in intestinal barrier function and cytokine levels of rats in each group
2.3 各组大鼠回肠组织p38MAPK、p-p38MAPK蛋白表达
与假手术组比较,模型组大鼠回肠组织p38MAPK、p-p38MAPK蛋白表达明显升高(均P<0.01);与模型组比较,SB203580组大鼠回肠组织p38MAPK、p-p38MAPK蛋白表达明显降低(均P<0.05)(图3)。
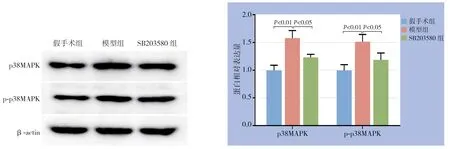
图3 各组大鼠回肠组织p38MAPK、p-p38MAPK 蛋白表达Figure 3 The expressions of p38MAPK and p-p38MAPK protein in the ileum tissue of rats in each group
2.4 各组大鼠肠道微生物区系分析
16SrDNA扩增序列测定,产生了1843 01个有效序列。由α多样性指数可知各组间Chao1指数、Simpson指数和Shannon指数均没有明显差异,治疗干预对菌群的丰富度及均匀度没有明显影响(图4 A)。β 多样性显示各组间无明显交叠趋势,存在聚类现象,SB 2035 80 组和模型组的样本分布存在差异(图4 B)。在门水平上,在假手术组中,粪便样本中菌群门水平最丰富的是厚壁菌门(Firmicuts)和拟杆菌门(Bacteroidetes);与假手术组比较,模型组粪便微生物区系组成有明显的变化,以厚壁菌门(Firmicuts)和拟杆菌门(Bacteroidetes)为主,拟杆菌门(Bacteroidetes)比例明显升高(P <0.05);与模型组相比,SB 2035 80 组拟杆菌门(Bacteroidetes)比例下降,厚壁菌门(Firmicuts)丰度增加(P <0.05)(图4 C)。在属的水平上,粪便成分的个体差异增强,假手术组、模型组和SB 2035 80 组以乳酸杆菌(Lactobacillus)和阿克曼氏菌(Akkermansia)为主, 其比例在3 组间具有可比性。 乳酸杆菌(Lacto bacillus)丰度在模型组增加,而在SB 2035 80 组降低,模型组阿克曼氏菌(Akkermansia)丰度降低,SB203580组可增加阿克曼氏菌(Akkermansia)丰度(图4D)。
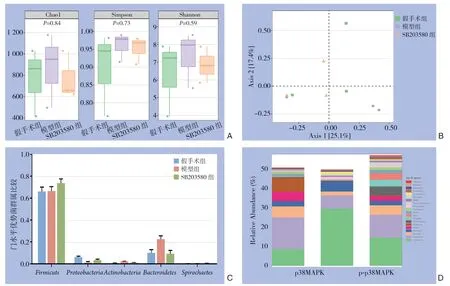
图4 各组大鼠肠道微生物区系分析 A:各组α 多样性指数;B:β 多样性;C:门水平优势菌群属;D:属水平优势菌群属Figure 4 Analysis of gut microflora in each group of rats A: The α-diversity index of each group; B: The β-diversity; C: The dominant flora at phylum level; D: The dominant flora at genus level
3 讨 论
HLP与较高的发病率和病死率有关,可导致胰腺和胰外器官坏死、继发感染和多系统器官衰竭[12-13]。根据研究[14]报道,尽管HLP相关病死率在过去10年中有所下降,但它仍然是一种破坏性疾病,病死率从不到10%到高达85%不等。此外,由于对HLP的发病机制和多种因果关系的了解有限,HLP有效的治疗方式较少[15]。故本研究探讨了p38MAPK抑制剂SB203580对HLP肠道微生物区系失调及炎症的影响,以期为HLP的治疗提供理论支撑。
研究[16-17]报道炎症在HLP的发展中起着关键作用。本研究结果发现HLP大鼠回肠组织中炎性细胞因子(IL-1β、TNF-α、IL-6)含量明显增加,胰腺和回肠组织病理损伤及组织病理评分明显增加,组织病理学检查结果与炎性细胞因子表达结果一致。丝裂原活化蛋白激酶(MAPKs)是一类丝氨酸/苏氨酸蛋白激酶和信号转导介质[18]。在哺乳动物细胞中发现了3个主要的MAPK家族,包括p38MAPK、细胞外信号调节激酶(ERK1/2)和c-Jun 氨基末端蛋白激酶(JNK)。其中,p38MAPK影响胰腺炎的严重程度,在急性胰腺炎的发展过程中,p38MAPK信号通路参与了NF-κB活化的调节,NF-κB在炎症级联反应中起着至关重要的作用[19-20]。此外,p38MAPK的激活导致p38 MAPK下游蛋白激酶MK2 的磷酸化,从而触发NF-κB的表达,增加炎症反应[21]。几项研究表明,p38MAPK抑制剂SB203580降低了雨蛙素诱导的急性胰腺炎中p38MAPK的活性,并减弱了胰腺中的炎症反应和细胞因子的释放[22-23]。本研究结果发现p38MAPK抑制剂SB203580能明显降低HLP大鼠回肠组织IL-1β、TNF-α、IL-6含量,提示SB203580处理可明显降低HLP大鼠炎症反应及病理损伤。
人类肠道微生物区系是一个多样化的微生物群落,据估计,其包含1000多种不同的细菌,以及共生真菌和病毒[24-25]。估计人体肠道中的微生物总数约为100万亿,是构成人体细胞数量的10 倍,而集体微生物基因组即微生物组,包含的基因大约是整个人类基因组的100倍[26]。微生物群极大地增强了宿主的代谢能力,并对维持肠道内环境平衡做出了积极贡献[27]。而关于肠道微生物区系的变化及其影响,目前仍知之甚少。Chen等[6]采用粪便16S rDNA基因测序方法研究急性胰腺炎大鼠肠道微生态的变化,发现急性胰腺炎大鼠肠道微生物区系多样性降低,尤其是在门水平上糖化细菌门和软壁菌门的丰度降低。目前研究在肠道中发现的细菌门以厚壁菌门(Firmicuts)和拟杆菌门(Bacteroidetes)为主,其他如放线菌门(Actino bacteria)、变形菌门(Proteobacteria)等占有一定比例[28]。在本研究中,模型组以厚壁菌门(Firmicuts)和拟杆菌门(Bacteroide tes)为主,拟杆菌门(Bacteroidetes)比例明显升高。Tan等[29]招募了108名参与者,发现肠道微生物区系改变的急性胰腺炎患者的多器官衰竭和感染并发症的发生率明显高于肠道微生物区系未改变的患者,急性胰腺炎患者肠球菌(Enterococcus)丰度增加,双歧杆菌(Bifidobacterium)丰度减少。Hamada等[30]对1 型自身免疫性胰腺炎和慢性胰腺炎患者的肠道菌群进行了综合分析比较,发现慢性胰腺炎患者肠道菌群中卵形拟杆菌(Bacteroides ovatus)、澳大利亚链球菌(Streptococcus australis)、戈登链球菌(Streptococcus gordonii)、乳酸发酵梭菌(Clostridium lactati fermentans)含量较高。然而,抗炎治疗对急性胰腺炎患者肠道菌群的影响仍不清楚。本研究发现与模型组相比,SB203580组拟杆菌门(Bacteroi detes)比例下降,厚壁菌门(Firmicuts)丰度增加,增加阿克曼氏菌(Akkermansia)丰度,表明SB203580组具有更高的细菌多样性和丰富度,SB203580处理可明显降低对肠道微生物区系的损伤,诱导更正常的肠道微生物区系组成。
综上所述,HLP大鼠炎症加重,肠屏障受损,肠道菌群失调;p38MAPK抑制剂SB203580可降低肠道炎症反应和调节微生物区系失调,SB203580具有治疗HLP的潜力。
