胰源性门静脉高压症的诊断和外科治疗:附20例报告
2021-04-14李文斌朱朝庚向兴华陈少丰成伟陈梅福李国光
李文斌,朱朝庚,向兴华,陈少丰,成伟,陈梅福,李国光
(湖南师范大学附属第一医院/湖南省人民医院 肝胆外科/湖南师范大学胰腺疾病转化医学研究所,湖南 长沙 410005)
胰源性门静脉高压症(pancreatic portal hypertension,PPH)是由脾静脉闭塞或狭窄引起的肝外门静脉高压症的一种[1],约5%的门静脉高压病例归因于PPH[2]。随着诊断技术进步和胰腺疾病发病率逐渐增加,PPH的发病率也逐渐增加,但因大部分患者无明显临床症状,实际发病率不明确。PPH是可治愈的一种门脉高压症,而本病的诊断和治疗对胰腺基础病的病程及预后有显著影响。本文通过回顾性分析2012年1月—2019年 12月,湖南省人民医院收治的20 例P P H 患者经外科手术治疗的病例资料,旨在探讨其诊断和治疗,总结诊治经验。
1 资料与方法
1.1 一般资料
20例患者中男15例,女5例;年龄23~63岁,平均年龄45 岁;病程1 个月至2年;胰体尾腺癌 2例,胰体尾神经内分泌癌1例,胰头部腺癌并胰腺假性囊肿1例,胰腺假性囊肿3例,慢性胰腺炎13例。符合胰腺疾病的表现:所有患者肝功能均正常,Child分级为A级,均有不同程度腹痛史;符合门脉高压症的表现:20例患者血常规检查均有不同程度的白细胞、红细胞、血小板中二项或者三项降低,查体均有不同程度的脾肿大,其中I°肿大5例,II°肿大8例,III°肿大7例,16例有呕血和(或)黑便史。
1.2 诊断方法
20例患者均存在胰腺原发疾病,有不同程度的脾肿大、脾功能亢进;16例患者有消化道出血史,胃镜检查均提示重度胃静脉曲张,其中1例合并轻度食管下段静脉曲张;20例患者均行腹部增强CT检查提示脾静脉受累、缺失、栓塞及狭窄等表现,脾门及胃底周围可见不同程度扩张、迂曲的静脉血管。
1.3 治疗方法
20例患者均行外科手术治疗,其中16例有消化道出血史的,在出血后先行药物、输血等保守治疗,病情稳定后再行外科手术治疗,具体手术方式见表1。
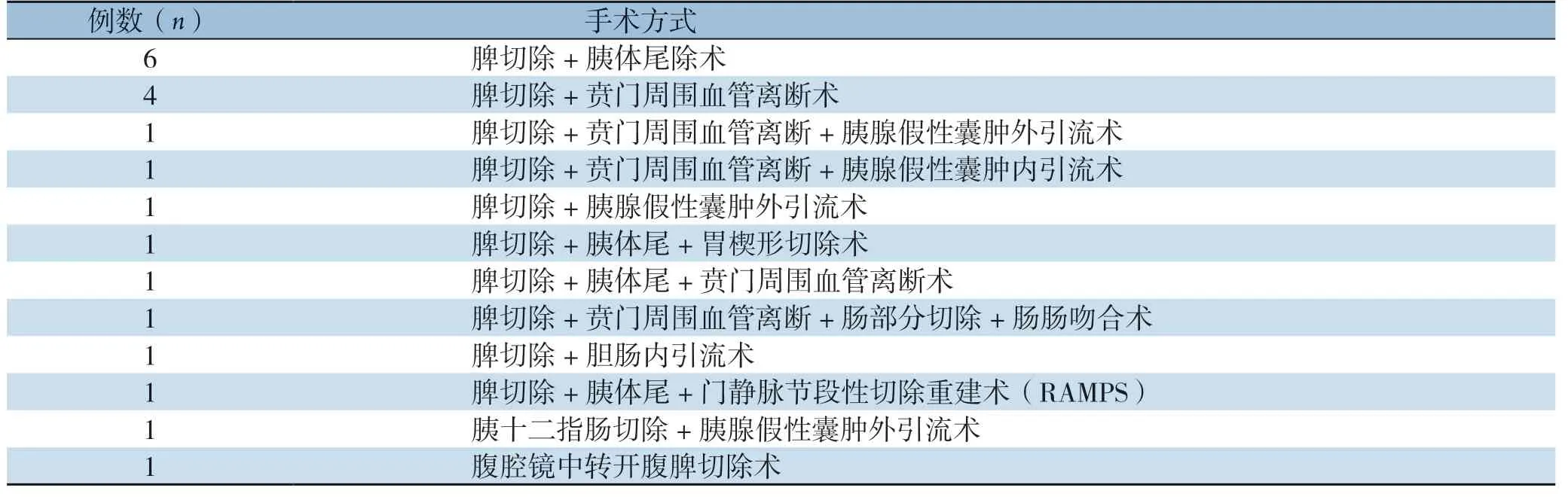
表1 20 例患者的手术方式(其中有2 例患者术前行脾动脉栓塞术)
2 结 果
2.1 手术情况
20例患者均顺利行外科手术治疗,手术时间为180~360 min,平均265 min;术中出血为100~ 5000 mL,平均625 mL;有5例患者行自体血回输,回输血量为500~2500 mL,平均850 mL。
2.2 术后情况
住院时间10.0~44.0 d,平均20.8 d,无围术期死亡。1例患者术后并发乳糜漏,3例患者术后并发胰瘘和腹腔感染,均经过保守治疗后痊愈。
2.3 随访情况
随访时间为6 个月至8年,20 例术后均无出血,16非肿瘤患者均存活至今,1例胰体尾神经内分泌癌术后至今已存活26个月,3例胰腺癌患者于术后3~18个月死亡。
3 讨 论
3.1 病因及发病机制
PPH最常见的病因主要包括急性胰腺炎、慢性胰腺炎、胰腺肿瘤[3],这些疾病均可以导致脾静脉血栓形成或受外源性压迫,导致脾静脉闭塞。胰腺炎性渗出、相对低灌注、胰蛋白酶的释放、脾静脉发生痉挛收缩、纤维化挛缩脾、血液处于高凝状态、静脉血流受阻、血管内皮细胞改变等多种因素均参与了急慢胰腺炎导致脾静脉血栓形成的过程,脾静脉容易受到胰腺肿瘤侵犯和(或)压迫(尤其是胰腺体尾部的肿瘤),从而导致脾静脉闭塞,血液回流受阻[4]。其它少见病因包括胰腺结核、胰腺脓肿、胰腺外伤、胰腺移植、胰腺神经内分泌肿瘤、胰腺囊腺瘤等。脾静脉行走于胰腺的后方,与胰腺毗邻,和肠系膜上静脉一起汇入门静脉,脾静脉一般有数支分支,其中包括胃网膜左静脉、胃短静脉以及部分胰腺的静脉血管,脾静脉除收集属支分布区域的血流外,还接受肠系膜下静脉血流的汇入[5]。这种解剖学上的接近使得脾静脉容易受到胰腺疾病的侵袭,导致脾静脉闭塞或栓塞,引起左侧门静脉高压症。当脾静脉阻塞时,往往形成孤立性胃静脉曲张,当胰腺病变在胰腺头颈部时,可导致肠系膜上静脉闭塞,引起更广范的门静脉高压症。
3.2 临床表现及诊断
PPH主要表现为脾大、脾功能亢进、上消化道出血、腹痛,肝功能一般正常。目前国际上对于PPH没有统一的诊断标准,其中大多数学者采用的诊断标准[6]:(1) 胰腺疾病的存在;(2) 胃脾区域门静脉高压症的临床或实验室证据,包括脾肿大和脾静脉全部或部分闭塞以及胃食管静脉曲张等;(3) 排除其他原因的门静脉高压症。对于有胰腺原发病史,且存在无肝硬化的胃静脉曲张患者,因考虑PPH可能。腹部增强CT可以诊断胰腺原发疾病,显示脾胃区域静脉是否曲张,有无肝硬化征象,脾静脉是否栓塞、闭塞等;胃镜是诊断食管、胃底静脉曲张的金标准,PPH的特征性表现是胃镜下孤立性胃静脉曲张;超声内镜(EUS)在诊断方面对于胃静脉曲张诊断的准确率明显高于胃镜,还可用于十二指肠静脉和结肠静脉曲张的诊断[7],但EUS对操作者的要求比较高,因技术限制,超声内镜技术未在县级医院广泛开展;其他检查,如B超、MRI、MRCP以及ERCP有利于胰腺原发疾病的诊断,CTA、MRA可显示脾胃区域静脉曲张的情况。结合病史以及实验室、影像、内镜等检查方法,在排除其他原因的门静脉高压症的基础上,确诊PPH并不难。
3.3 治疗
脾切除术是PPH合并胃静脉曲张破裂出血患者的最终治疗方法,胃静脉曲张破裂出血的患者在通过内科或介入治疗控制急性出血后,行脾切除术治疗。脾切除对消化道出血和脾功能亢进有确切的疗效[6],但对于无症状患者的治疗,目前尚无统一定论。
对于急性胰腺炎并发PPH患者,应慎行脾切除,此类患者出现上消化道出血相对比较少见,一般情况较差,腹腔感染和炎性水肿较重,行脾切除有加重感染和出血的风险,应以治疗胰腺炎为主。如出现上消化道出血,可先行药物、脾动脉栓塞术、脾静脉支架置入术、曲张静脉内镜下套扎术和组织胶硬化栓塞术等治疗,待胰腺炎好转后,再视情况予以行脾切除术。
对于慢性胰腺炎并发PPH患者的脾切除,由于炎症反复发作,胰尾与脾门处组织粘连致密,纤维增生,对术前影像学检查提示脾门、脾周或胰腺本身炎症水肿和纤维化严重者,术前可以行脾动脉栓塞术,以减少术中出血量。20例患者中有2 例在术前行脾动脉栓塞术,术中出血量均为100 m L,明显低于平均术中出血量,但是脾动脉栓塞后脾切除比较复杂,局部可能有渗出和粘连,应在脾动脉栓塞术后1 周之内行脾切除术。脾周及脾门的手术非常困难,有时仅游离脾脏就可大量出血,对于非肿瘤且血液无污染患者,术中可行自体血回输。脾切除术中应在胰腺体尾部上方,沿着正确的解剖平面仔细分离,找到脾动脉予以结扎,再分离断脾脏周围的韧带及血管,游离并横断脾蒂,如无法分离出脾动脉和脾静脉时,可以先离断脾脏周围的韧带及血管,保护好胰腺尾部,紧靠脾门,采用钳夹法逐步离断脾蒂。如果脾门解剖异常困难或者合并胰腺病变时,不必强行解剖脾门,可联合行胰体尾切除。因脾脏周围粘连致密和术中出血难以控制,通常脾切除通过开腹完成,但是行脾动脉栓塞术后的腹腔镜下脾切除术似乎是可行的。Patrono等[8]报道了1例PPH的患者成功行脾动脉栓塞术后的腹腔镜下脾切除术。
当合并胰腺病变时,可同时行各种胰腺切除和引流术。合并胰腺假性囊肿时,如囊肿体积较小或局部纤维化严重,可予以局部切除,如囊肿体积较大,与胰管有相通可能,可行假性囊肿空肠内引流术,如囊壁较薄、质脆、水肿或囊肿破裂,则假性行囊肿外引流术;合并胰管近端良性梗阻时,如胰管扩张明显,可将扩张胰管纵行切开,行胰管空肠内引流术;合并胰腺肿瘤时,应争取行根治性切除,如肿瘤侵及重要静脉,可行血管节段性切除重建术或血管置换术;合并脾脏与周围器官致密粘连时,可联合周围器官局部切除,必要时予以重建,比如肠肠吻合术等;合并胆总管下端梗阻伴肝内外胆管扩张、积气时,可附加行胆肠内引流术。关于是否行贲门周围血管离断术,目前仍存在争议,在16例有消化道出血史患者中,7例行贲门周围血管离断术,9例未行贲门周围血管离断术,术后随访均无再次出血,对于是否行贲门周围血管离断术,其预后无明显差别。理论上单纯行脾切除术即可降低左侧门静脉的压力,减轻甚至消除胃静脉曲张,术中可见曲张的胃静脉明显坍塌,术后复查胃镜提示胃静脉曲张明显改善或消失。所以笔者认为大多数情况下,单纯行脾切除术即可,不需要行贲门周围血管离断术,当合并重度食管静脉曲张时,可考虑行贲门周围血管离断术。
脾切除术中脾窝处应放置引流管,如联合胰体尾切除,则胰尾处也应放置引流管。术后应监测引流液淀粉酶,警惕胰漏,可使用抑酶药物进行预防治疗;术后也应监测血小板和凝血功能,预防血栓形成,门静脉血栓形成的预防措施包括围手术期使用抗凝、溶栓以及抗血小板治疗[9],围手术期低剂量低分子量肝素的预防性抗凝虽然不能完全避免门静脉血栓的出现,但可能会降低深静脉血栓形成的风险或肺血栓栓塞[10];术后还应警惕脾切除后凶险性感染,脾切除术后2年内感染的风险最高,但所有感染的三分之一发生在脾切除后5年以上,患者处于终生危险中。
总之,PPH症状隐匿,在临床工作中易误诊、漏诊,部分患者可发生胃静脉曲张破裂大出血,病情凶险,可能危及患者生命。脾切除为主的外科手术治疗针对原发病及左侧门脉高压症进行有效地干预,可获得满意的疗效, 改善患者的预后,提高患者的生存质量。
