以创新图示法剖析重难点的教学设计
——以“影响化学反应速率的因素”为例
2021-04-14陈曦明
陈曦明
(广东省深圳市南山区华侨城中学 518053)
图示法是化学学科思维的重要类型,是中学化学核心素养的组成要素.它是一种以图形为主要方式,揭示事物现象或本质特征,激发学生思维,使其更好地掌握知识,加快教学进程的教学策略.其实质是使科学知识形象化,抽象知识具体化,复杂问题简明化,便于学生接受、学习.
模型法是指对问题进行抽象、简化、类比、概括,抓住主要特征,以不同的表征形式来呈现现象、概念、过程等.有的借助于具体的事物来描述,有的则通过抽象的形式(如符号、文字、公式等)来描述.以达到形象、鲜明的功能及目的.
该文以创新图示法剖析教学重难点.为了达成学生对重难点的理解,激发学生核心素养的发展.归纳提炼了四步教学模型:(1)问题呈现:通过感知的实验现象,归纳并呈现问题.(2)问题分析:根据已有的知识或实验结论,通过类推、类比等提炼需要分析的问题.(3)图示模型:选择恰当简练的图示.将要分析的问题实质完全呈现.(4)解决问题:通过图示上呈现的问题实质,深入理解并得出要分析的问题.
该文教学设计充分考虑学习过程的实际.利用四步教学模型,使学生在学习意识形成、学习方法选择、学习进程评估调控等综合表现方面的核心素养得以充分发展,在理性思维方面,能逻辑清晰运用科学的思维方式认识事物、解决问题的核心素养得以充分培养.
选修四影响化学反应速率的因素是化学反应原理的重要内容.在本节内容教学中,从微观上理解其实质是教学的重难点.根据绪言部分学习,我们掌握了活化分子浓度增加,化学反应速率加快.本文通过四步教学模型,将外界条件对化学反应速率的影响,通过问题分析步骤设计,转化成外界条件改变对微观活化分子浓度的影响.再通过图示设计,将外界条件改变引起的活化分子百分数、活化分子浓度变化完全清晰的呈现出来,使学生轻松达到深刻理解、掌握的目的;使学生理性思维、意识形成、解决问题、求知欲等核心素养得以充分培养与发展.
一、教学过程
影响化学反应速率的因素:
1.内因(主要因素):化学反应速率大小主要由参加反应物本身的性质决定.
2.外因:一个反应物确定的化学反应,内因已确定了.外界条件改变成为影响化学反应速率的主要因素.
(1)浓度对化学反应速率的影响:
[实验2-2]:在温度不变的情况下,取两支试管,各加入4mL 0.01mol/L KMnO4酸性溶液,然后分别加入2mL 0.1mol/L H2C2O4、2mL 0.2mol/L H2C2O4,记录褪色所需时间.对比实验见表1.
实验中发生了如下反应:


K2SO4+2MnSO4+10CO2↑+8H2O
通过实验可知,在其它条件相同时,增大反应物浓度,反应速率越大.反之,反应速率越小.
[问题呈现]为何在其它条件相同时,增大反应物浓度,反应速率越大.反之,反应速率越小,如何从微观上理解?
学生小组讨论1分钟后.
教师引导:活化分子浓度越大,反应速率越大,那么就转化成了“在其它条件相同时,增大反应物浓度,活化分子浓度增大”.
[问题分析]为何“在其它条件相同时,增大反应物浓度,活化分子浓度增大”?
教师引导:假设将分子能量由小到大按由下向上的顺序排列.活化能为E0(设浓度由c增大到2c,体积为1L),如何通过图示模型将其示意出来.
学生小组讨论1分钟后并在纸上画出.
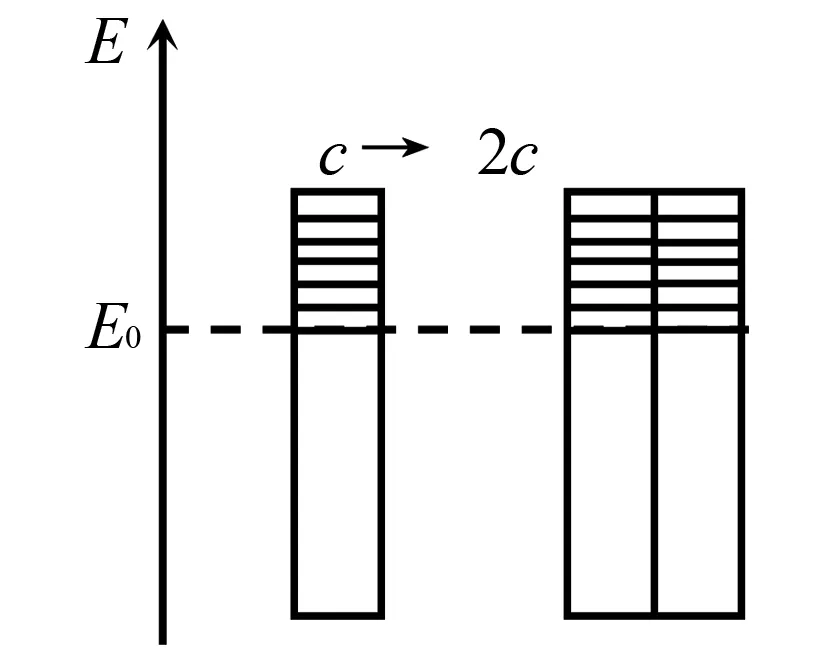
图1
[图示模型]设E0为活化能,能量大于E0的分子为活化分子.如图1所示,通过图示容易直观理解.在其它条件相同时,增大反应物浓度,反应物中活化分子的百分数是一定的;反应物浓度越大,活化分子浓度越大(单位体积内活化分子数目与单位体积内反应物的总数成正比,即与反应物浓度成正比).
[解决问题]结合“单位体积内活化分子数(活化分子浓度)增加,化学反应速率加快”.可知反应物浓度越大,化学反应速率越大.
设计意图:让学生通过图示教学设计简单、直观的理解浓度改变活化分子百分数不变;反应物浓度越大,活化分子浓度越大.通过四步模型教学设计充分培养与发展学生的核心素养.
(2)压强对化学反应速率的影响
对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成反比.所以有气体参加的反应,增大压强,体积减小,物质浓度增大,化学反应速率增大.
所以分析压强对化学反应速率影响的思想是:压强变化→体积变化→浓度变化→速率变化.所以有气体参加的反应,增大压强,反应速率增大;减小压强,反应速率增大.
[问题呈现]如何从微观上理解“在其它条件相同时,增大压强,反应速率增大;减小压强,反应速率增大”?
学生小组讨论1分钟后.
教师引导:活化分子浓度越大,反应速率越大,那么就转化成了“在其它条件相同时,增大压强,活化分子浓度增大;减小压强,活化分子浓度减小”.
[问题分析]为何“在其它条件相同时,增大压强,活化分子浓度增大;减小压强,活化分子浓度减小”?
教师引导:假设将分子能量由小到大按由下向上的顺序排列.活化能为E0(设容器体积由VL压缩至V/2L,压强由p增大到2p,则浓度由c增大到2c),如何通过图示模型将其示意出来.
学生小组讨论1分钟后并在纸上画出.

图2
[图示模型]设E0为活化能,能量大于E0的分子为活化分子.如图2所示,通过图示容易直观理解.在其它条件相同时,增大压强,反应物中活化分子的百分数是一定的;活化分子浓度增大.
[解决问题]结合“单位体积内活化分子数(活化分子浓度)增加,化学反应速率加快”.可知压强越大,化学反应速率越大.
设计意图:让学生通过图示教学设计简单、直观的理解压强改变活化分子百分数不变;压强越大,活化分子浓度越大.通过四步模型教学设计充分培养与发展学生的核心素养.
(3)温度对化学反应速率的影响
[实验2-3]:往①②2支试管各加入5ml 0.1mol/L Na2S2O3溶液;将①试管置于T1℃的冷水中,②试管置于T2℃的热水中,再往①试管中加入T1℃的5ml 0.1mol/L H2SO4溶液,往②试管中加入T2℃的5ml 0.1mol/L H2SO4溶液,并搅拌.记录出现浑浊的时间(见表2).
反应的化学方程式:


表2
通过实验可知,在其它条件不变时,升高温度化学反应速率增大,降低温度化学反应速率减小.
[问题呈现]如何理解“在其它条件不变时,升高温度化学反应速率增大,降低温度化学反应速率减小”?
学生小组讨论1分钟后.
教师引导:活化分子浓度越大,反应速率越大,那么就转化成了“在其它条件相同时,升高温度,活化分子浓度增大”.
[问题分析]为何“在其它条件相同时,升高温度,活化分子浓度增大”?
教师引导:假设将分子能量由小到大按由下向上的顺序排列.活化能为E0.
教师提示:在其它条件相同时,升高温度,使得分子均吸收能量.反应物分子的能量均相应的升高.但活化能E0不变.
如何通过图示模型将其示意出来.
学生小组讨论1分钟后并在纸上画出.

图3
[图示模型]设E0为活化能,能量大于E0的分子为活化分子.如图3所示,通过图示容易直观理解.由于温度升高,使得分子均吸收能量,使原来能量较低的分子部分变成活化分子,所以活化分子百分数增大;使得活化分子浓度增大.
[解决问题]结合“单位体积内活化分子数(活化分子浓度)增加,化学反应速率加快”.可知升高温度,化学反应速率越大.同理,降低温度,反应速率减小.
设计意图:通过图示教学设计简单、直观的理解温度升高活化分子百分数增加;温度升高,活化分子浓度越大.通过四步模型教学设计充分培养与发展学生的核心素养.
升高温度化学反应速率增大有两个原因.主要原因是温度升高使分子获得更高的能量,活化分子百分数增大,活化分子浓度增大.次要原因是分子运动加剧,使得分子间碰撞频率加大,活化分子碰撞频率也随之加大.
(4)催化剂对化学反应速率的影响
[实验2-4]:按下列实验步骤完成实验:①向锥形瓶内加入10mL 10%的H2O2;②将插有短导管和漏斗的双孔胶塞塞到锥形瓶上;③将带余烬的木条通过短导管插入锥形瓶,观察实验现象;④经漏斗向锥形瓶内加入少量MnO2后,观察实验现象.
列表并记录(见表3):

表3
通过实验可知,上述实验的反应中MnO2是催化剂,起着加快化学反应速率的作用.
[问题呈现]如何理解“在其它条件不变时,加入催化剂,化学反应速率增大”?
学生小组讨论1分钟后.
教师引导:活化分子浓度越大,反应速率越大.那么就转化成了“在其它条件相同时,加入催化剂,活化分子浓度增大”.
[问题分析]为何“在其它条件不变时,加入催化剂,活化分子浓度增大”?
教师引导:假设将分子能量由小到大,按由下向上的顺序排列.活化能为E0.

图4
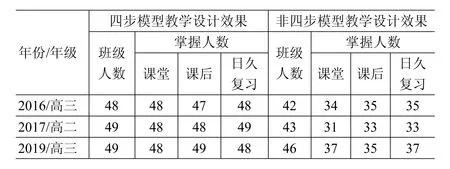
教师提示:加入催化剂,改变了反应过程,降低了反应所需的活化能.在其它条件相同时,无催化剂时活化能为E0,加入催化剂,降低了化学反应的活化能.活化能由E0降低为E0′(E0′ 学生小组讨论1分钟后并在纸上画出. [图示模型]设E0为活化能,能量大于E0的分子为活化分子;加入催化剂,活化能降低为E0′(E0′ [解决问题]结合“单位体积内活化分子数(活化分子浓度)增加,化学反应速率加快”.可知加入催化剂,化学反应速率越大. 图5 设计意图:让学生通过图示教学设计简单、直观的理解加入催化剂活化分子百分数增加;活化分子浓度越大.通过四步模型教学设计充分培养与发展学生的核心素养. 笔者以四步教学模型展开“影响化学反应速率的因素”的教学设计.充分考虑了学生已有知识储备,结合学习过程实际.归纳提炼学生学习过程中的重难点,以创新图示法加以剖析.恰当的设计使学生更深刻的理解问题呈现、问题分析、图示模型、解决问题这四步教学模型的过程及对日后学习的意义.不仅将外界条件改变引起的活化分子百分数、活化分子浓度变化完全清晰的呈现出来,使学生轻松达到深刻理解掌握的目的;还能使学生理性思维、意识形成等核心素养得以充分培养与发展.遇到理解困惑时能独立应用.并增强了学习自信心,学习欲望大大增强. 笔者经过多年实践,在同教学年同层次不同班级采用对比教学,发现采用创新图示法剖析教学重难点.通过四步教学模型的教学设计.不仅课堂进展顺利,学生理解到位且深刻,课后作业也完成的特别好,而且日久复习学生自主性更强,而且几乎不要教师讲解引导,效果甚佳.以下是笔者三教学年同层次不同班级教学效果对比表格(见表4): 表4 从表4中发现,采用四步模型教学设计的班级学生在课堂、课后及日久复习均掌握的更好,说明四步模型教学设计,使学生在问题转化、图示呈现方面理解深刻、掌握牢固;并使学生理性思维、意识形成及自主学习等核心素养得以充分培养与发展.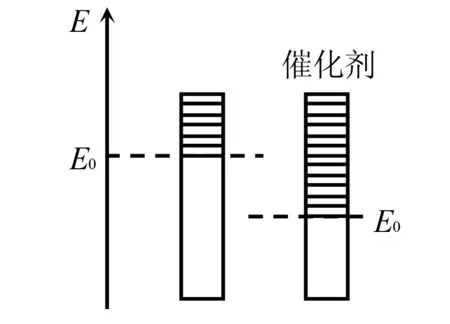
二、教学评价