学习进阶视角下培育“证据推理与模型认知”的教学实践研究
——以元素周期律应用教学为例
2021-04-14陈春发
陈春发
(福建省莆田第二中学 351100)
通过多年的学习进阶视角下培育“证据推理与模型认知”的教学实践研究表明,课堂教学以化学核心素养为准则,能够帮助学生快速构建化学学科知识体系.例如,在元素周期律应用内容的学习时,采用创设情境→提出假设→实验设计→收集证据→论证推理→得出结论(模型认知)等重要环节可以达到培养学生的“证据推理与模型认知”核心素养的目的.
从元素周期律应用的内容来看,在学生已初步认知元素周期表的结构以及元素周期律的内容的基础上进行拓展,引导学生掌握运用元素周期律知识解决实际问题,通过碱金属、卤族、第3周期元素的性质规律的类比和延伸,达成元素的“位置、结构、性质”间的证据推理与模型认知.
【课堂实录】
1.导入课题
[师]通过前面的学习,我们知道原子核外电子的周期性排布引起了元素的性质也呈现周期性变化.请同学们猜想一下第3周期元素金属性、非金属性变化规律?
[生]可能有三种情况:第一种情况是第3周期元素金属性逐渐变强、非金属性逐渐变弱;第二种情况是第3周期元素金属性逐渐变弱、非金属性逐渐变强;第三种情况是第3周期元素金属性、非金属性变化不规则.
[师]同学们,哪种猜想较为合理呢?请说明理由.
[生]应该是第二种情况.因为Na、Mg、Al是金属、P、S、Cl是非金属,故是由金属性到非金属性递变.
【创设目的】提出与元素周期律相关的问题,让学生通过猜想和推理从理论上得出第3周期元素金属性、非金属性变化规律.
2.课堂展开
[师]请同学们先设计Na、Mg、Al的金属性依次减弱的实验.
[学生活动](1)设计实验方案:
①Na、Mg、Al与水或酸的反应;②最高价氧化物对应水化物NaOH、Mg(OH)2、Al(OH)3的碱性强弱.
(2)收集实验证据:
①Na与水反应的现象是“浮在水面、熔化为小球、四处游动、嘶嘶作响”——剧烈,不需要加热;Mg在冷水中缓慢逸出气泡,加热至沸腾迅速产生气体,反应迅速;Al在水中无明显现象,加热仍然无明显现象.在Mg和Al与稀盐酸反应的实验中,Mg与盐酸反应迅速,产生大量气泡;Al与盐酸反应缓慢逸出气体.
②NaOH溶液使酚酞变红色,属强碱;Mg与热水反应生成的Mg(OH)2能使酚酞变浅红色,属中强碱;Al(OH)3不能使酚酞变红色,但Al(OH)3既可以溶于盐酸又可以溶于NaOH溶液,属两性氢氧化物.
(3)实验结论:Na、Mg、Al的金属性逐渐减弱.
[师帮助学生建立模型认知]第3周期元素的性质变化规律是:金属性逐渐变弱→同周期元素金属性依次变弱.
【创设目的】通过学生设计方案、分组实验、观察现象收集证据达成对化学规律的建模.金属性的比较的两个重要实验,一个实验是金属单质与水或酸的反应剧烈程度;另一个实验是金属元素最高价氧化物对应水化物的碱性强弱.
3.类比推理
[师]请同学们完成电子白板上的问题.
(电子白板出示)硅、磷、硫、氯的非金属性比较
①硅、磷、硫、氯与H2反应的难易:
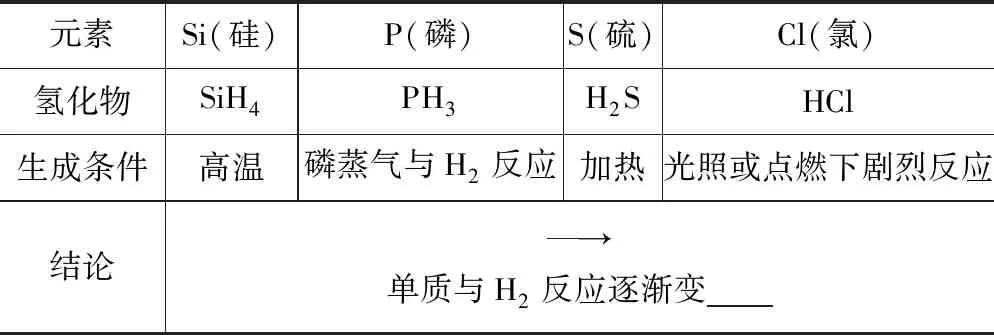
元素Si(硅)P(磷)S(硫)Cl(氯)氢化物SiH4PH3H2SHCl生成条件高温磷蒸气与H2反应加热光照或点燃下剧烈反应结论→单质与H2反应逐渐变
②硅、磷、硫、氯元素的最高价氧化物对应水化物的酸性:
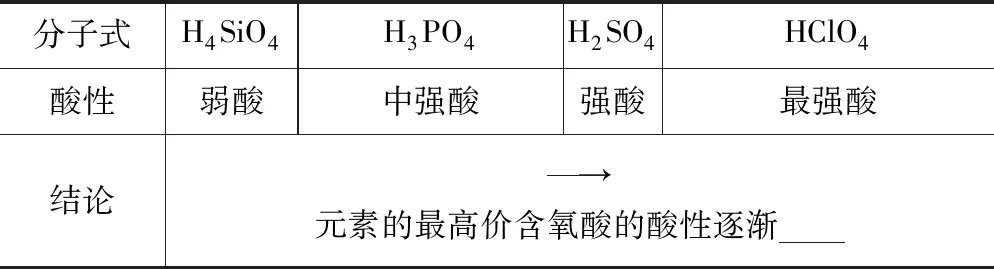
分子式H4SiO4H3PO4H2SO4HClO4酸性弱酸中强酸强酸最强酸结论→元素的最高价含氧酸的酸性逐渐
得出结论:第3周期元素的金属性和非金属性变化规律:金属性逐渐____,非金属性逐渐____
[学生活动]反思规律,填写相应的内容.
【创设目的】让学生认知元素非金属性强弱比较的实验方法,同时学会类比的方法进行推理,构建同周期元素的金属性和非金属性变化规律模型.元素非金属性强弱比较的实验方法有比较非金属单质与H2反应的难易程度;比较非金属元素的最高价氧化物对应水化物的酸性强弱.
4.课堂拓展
[师]同学们已经知道了第3周期元素的特征,若用ⅦA族的非金属元素为例,同一主族元素又有什么特征呢?
[学生活动](1)阅读课本,了解三个方面知识:①卤族元素原子的结构特征;②卤族单质的物理性质;③卤素单质与氢气反应的剧烈程度比较.
分组讨论,选取一名成员对问题进行诠释,总结得出有关结论:
①卤族元素原子的结构特征相同点是最外层都是7个电子;不同点s随核电荷数的增加,电子层数逐渐增加,原子半径逐渐增大.
②由教材相关内容得出单质的物理性质是依F2、Cl2、Br2、I2的顺序:颜色由浅到深;密度由小到大;熔、沸点由低到高.
③卤素单质依F2、Cl2、Br2、I2的顺序与氢气反应的剧烈程度依次减弱(注意提示学生记住H2与F2在暗处就会爆炸,H2与I2在加热条件下反应还是不能进行到底的).
(2)设计实验方案,探究卤素单质间的置换反应现象,收集实验证据.
[学生展示]预设的实验方案:
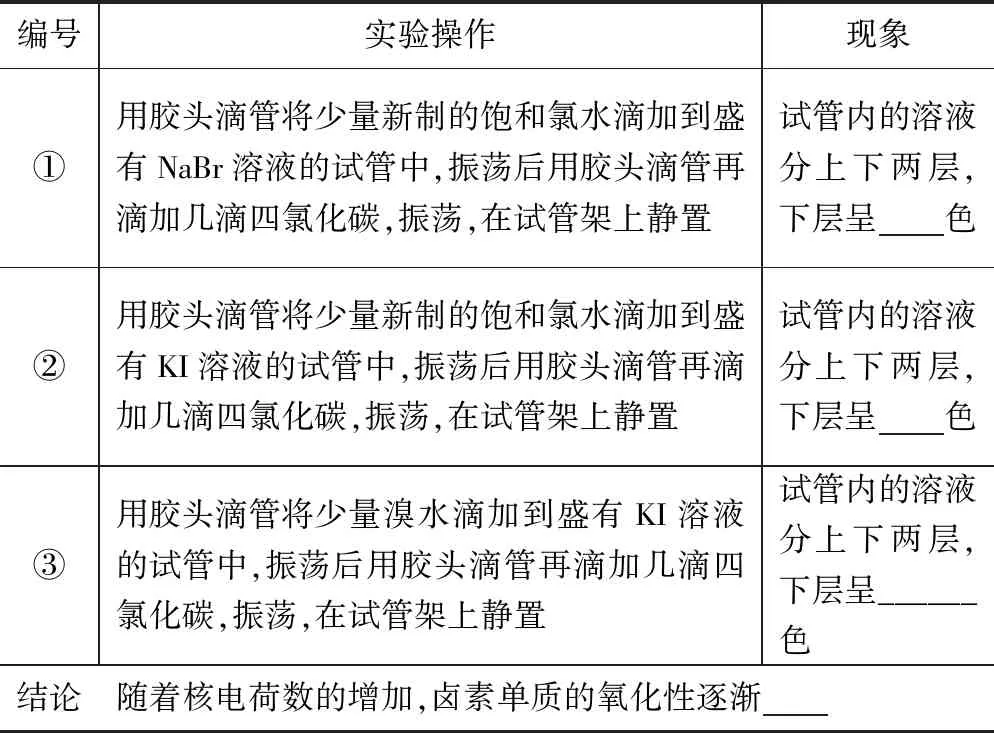
编号实验操作现象①用胶头滴管将少量新制的饱和氯水滴加到盛有NaBr溶液的试管中,振荡后用胶头滴管再滴加几滴四氯化碳,振荡,在试管架上静置试管内的溶液分上下两层,下层呈色②用胶头滴管将少量新制的饱和氯水滴加到盛有KI溶液的试管中,振荡后用胶头滴管再滴加几滴四氯化碳,振荡,在试管架上静置试管内的溶液分上下两层,下层呈色③用胶头滴管将少量溴水滴加到盛有KI溶液的试管中,振荡后用胶头滴管再滴加几滴四氯化碳,振荡,在试管架上静置试管内的溶液分上下两层,下层呈______色结论随着核电荷数的增加,卤素单质的氧化性逐渐
(3)得出实验规律,构建化学模型.
【创设目的】以化学反应原理类推的方法,在“证据推理与模型认知”引领下的实践,旨在培养学生通过第ⅦA族元素的实验探究活动获取相关的证据意识,学会通过化学反应特征的分析(如单质如氢气的反应现象、元素之间的置换反应现象)、推理等方法认识研究元素周期律的本质特征、元素周期表的构成要素及互通关系,达到建立模型认知的目的.
总之,作为“元素周期律的应用”教学,可以采用通过注重课堂教学的实践,在学生学习进阶中培养实验探究的设计方案、探究实验和收集证据的意识,建立模型认知教学,从而一改传统教学中直接给出元素周期律的结论.这样做不断丰富了课堂教学的创设,而且能够把复杂抽象的理论知识化繁为简,由表及里.因此,笔者认为,只要在课堂上通过知识推理,建构模型认知,就一定能够帮助学生理解化学概念的本质和内涵,在学习进阶中不断提升学科素养.
