Serrawettins:黏质沙雷氏菌合成的脂肽类生物表面活性剂
2021-04-14张坤成范文博刘秋元郅若宇
张坤成,戴 杰,范文博,刘秋元,郅若宇,李 霜
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 2011学院,江苏 南京 211800)
黏质沙雷氏菌(Serratiamarcescens),革兰氏阴性,具周生鞭毛,因其能够产鲜红色的灵菌红素,又被称为灵杆菌。早在20世纪60年代,Wasserman等[1-2]在研究灵菌红素分子结构时,从灵菌红素母液中发现了一种新的环状内酯天然产物,命名为serratamolide。直到20世纪80年代,日本学者Matsuyama等[3]对S.marcescens所产的具有润湿活性(wetting activity)的胞外产物进行了结构鉴定,证明其中一种功能产物就是serratamolid;此后,Matsuyama将黏质沙雷氏菌(Serratiamarcescens)和深红沙雷氏菌(Serratiarubidaea)合成的润湿活性物质分别命名为serrawettins[4]和rubiwettins[5]。近年来,国际上有关serrawettins的研究报道越来越多。
Serrawettins是一种脂肽类生物表面活性剂,具有典型的两亲性分子结构——亲水端由氨基酸或肽构成,亲油端由β-羟基脂肪酸构成。根据薄层层析(TLC)的结果差异性, serrawettins可分为serrawettin W1、serrawettin W2和serrawettin W3;又因脂肪酸链长或氨基酸残基的差异,serrawettins存在多种同系物组分(congeners)或异构体。Serrawettins不仅具有抗细菌、抗真菌、抗线虫及抗肿瘤等生物学功效,还具有乳化活性、表面活性以及润湿活性等,在医药领域和石油工业具有广泛的应用前景[6]。
本文中,笔者对沙雷氏菌属所产的生物表面活性剂进行了归纳总结,重点对serrawettins的结构、理化性质、合成机制、表征方法以及应用潜力等进行综述,为进一步开发serrawettins提供参考。
1 Serrawettins:S. marcescens 典型形态特征的物质基础
众所周知,S.marcescens的菌落形态和温度息息相关:在37 ℃培养时,S.marcescens会呈现规整的圆形淡黄色菌落;在30 ℃培养时,菌落会变成红色,且菌落形态会扩散成树突状不规则形态(图1)。这一显著的菌落形态变化与两种重要的次级代谢产物有关:在30 ℃生长时,S.marcescens会产生灵菌红素和serrawettins;而在37 ℃生长时,则不能合成serrawettins。灵菌红素使菌落变红,而serrawettins使其呈现不规则的扩散生长(spreading growth)。Matsuyama 等[6]为进一步证明serrawettins对菌落形态的影响,分别构建了serrawettins缺陷型和鞭毛缺陷型的S.marcescens突变菌株,结果发现serrawettins缺陷型的菌株失去了形成扩散型菌落形态的能力(图2)。在serrawettins的各种组分中,serrawettin W1通常与灵菌红素伴生;serrawettin W2和serrawettin W3通常与灵菌红素无关[6]。但是也有例外,Su等[7]分离获得一株S.surfactantfacienssp.nov.YD25T,可以同时合成灵菌红素和serrawettin W2。
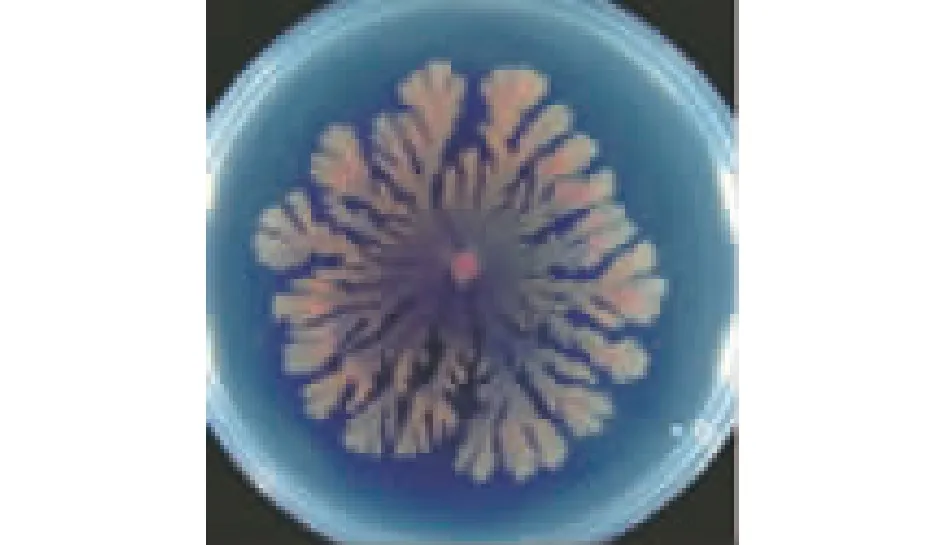
S.marcescens NS 38在硬琼脂平板上培养20 d的形貌图1 黏质沙雷氏菌的扩散型菌落形态[6]Fig.1 Expanded colony morphology of Serratia marcescens[6]
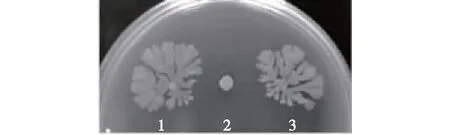
1—S.marcescens NS 38野生型菌株;2—S.marcescens NS 38 serrawettin缺陷型菌株;3—S.marcescens NS 38鞭毛缺陷型菌株图2 黏质沙雷氏菌不同菌株的菌落形态[6]Fig.2 Colony morphology of different Serratia marcescens strains[6]
2 沙雷氏菌属合成的生物表面活性剂及其结构特征
沙雷氏菌属细菌所产的生物表面活性剂可分为脂肽类和糖脂类这两大类。脂肽类包括serrawettins(W1、W2和W3)和stephensiolides(A~K)[8-9],糖脂类主要包括rubiwettins[10](R1和RG1)、鼠李糖脂[11]以及少数的蔗糖脂[12]和arabinolipid等[13](表1)。

表1 沙雷氏菌属细菌所产的生物表面活性剂
2.1 脂肽类表面活性剂
Serrawettin W1与serratamolides分子结构一致,是最早发现的与S.marcescensNS 38的菌落扩展运动特性相关的代谢产物。Serrawettin W1是由L-Ser和β-羟基脂肪酸(癸酸)通过酰胺键和酯键(内酯)连接而成的环状内酯结构(图3(a)),分子量为514.6[15]。Serrawettin W1的脂肪酸链长度通常是可变的,在C8与C14之间,以C10为主,其同系物的分子量为486.61~665.40[14,16]。
Serrawettin W2的产生菌有S.marcescens和S.surfactantfaciens,其分子结构类似于脂肽surfactin,是由β-羟基脂肪酸(癸酸)连接五肽(D-Leu/Ile-L-Ser-L-Thr-D-Phe-L-Ile/Leu)形成的环状脂肽[5](图3(b)),分子量为731.93。Serrawettin W2的结构多样性由肽环结构上第1、第2或第5位的氨基酸种类和脂肪酸链长短所决定的[7-8,17],脂肪酸链长通常为C8或C10,分子量为703.3~759.3。
Serrawettin W3是一种新型的非离子型环状脂肽,产生菌为S.marcescensNS 45,其分子结构由十二烷酸、苏氨酸、丝氨酸、缬氨酸、亮氨酸和异亮氨酸组成,分子量为683。但serrawettin W3的具体结构目前尚未被明确地解析出来,其结构的多样性可能是由氨基酸的种类(亮氨酸或异亮氨酸)决定的[6]。
Stephensiolides(A~K)是由Serratia代谢产生,最初是在史蒂芬斯氏按蚊的中肠和唾液腺中发现的,其结构与serrawettin W2类似,由脂肪酸链和五肽(Thr-Ser-Ser-Val(Ile)-Ile(Val))构成。由于脂肪酸链长短、氨基酸残基变化以及脂肪酸链中是否存在双键等情形,造成了stephensiolides结构的多样性,其分子量为599~695[9]。
2.2 糖脂类表面活性剂
深红沙雷氏菌SerratiarubidaeaATCC 27593是目前报道的唯一产糖脂表面活性剂rubiwettins的菌株[18],可以生产rubiwettin R1和rubiwettin RG1 2种结构产物。
Rubiwettin R1的分子结构尚未完全阐明,仅对分子中的疏水结构——β-羟基脂肪酸部分完成了鉴定,包括3-(3′-羟基十四烷氧基) 癸酸酯和3-(3′-羟基十六烷氧基) 癸酸酯2种(图4(a)),分子中的亲水结构——碳水化合物组分(糖基单元)还不清楚[10]。
Rubiwettin RG1的结构与鼠李糖脂结构类似,但rubiwettin RG1的糖基单元以及脂肪酸链长不同于鼠李糖脂[10],由β-D-葡萄糖和3-(3′-羟基十四烷氧基)癸酸酯两部分组成(图4(b)),分子量为576.77。

图4 Rubiwettin R1(a)脂肪酸链和rubiwettin RG1(b)结构Fig.4 Structure of rubiwettin R1 fatty acid chain (a)and rubiwettin RG1 (b)
3 Serrawettins的理化性质
生物表面活性剂因其具有两亲性,可以存在于油水界面,降低界面张力,使两种不互溶的液体乳化。近年来,各种生物表面活性剂因其独特的理化性质而被广泛研究,在日用品、制药工业、食品工业以及生物修复中具有潜在的应用价值[19]。
3.1 表面活性
一般来说,生物表面活性剂如果能将水和空气的表面张力从72 mN/m降至35 mN/m以下,将水和十六烷之间的界面张力从40 mN/m降到1 mN/m,那么就被认为是有效的表面活性剂[20]。Serrawettins是一类高效的生物表面活性剂,可以显著降低水的表面张力,且具有较低的临界胶束浓度(CMC值)。Serrawettins各种结构的CMC值、降低水的表面张力及接触角参数如表2所示[8]。阚公[21]将纯化后的serrawettin W1溶于0.9%(质量分数)的NaCl溶液中,测定其表面张力、界面张力与CMC值,结果表明serrawettin W1可将水的表面张力降至32.2 mN/m,其CMC值为32.8 mg/L。值得注意的是,当serrawettin W1的质量浓度为100 mg/L 时,可以将水与正庚烷的界面张力降低至6 mN/m,而质量浓度达到500 mg/L时,则形成超低界面张力;对照组化学表面活性剂十二烷基磺酸钠(SDS)质量浓度为500 mg/L时,界面张力降低至12.8 mN/m,而质量浓度达1 000 mg/L时,形成超低界面张力。这表明serrawettin W1的使用量比SDS要低得多。

表2 Serrawettins的表面活性特征参数[8]
Serrawettins所具有的表面活性给沙雷氏菌的大规模发酵带来工程技术难题。在通气搅拌发酵过程中,发酵体系中的表面活性剂容易引起严重的泡沫,甚至使培养基出现溢液导致杂菌污染等现象[22]。Zhang等[23]在利用黏质沙雷氏菌发酵产2,3-丁二醇时,就遭遇了生物表面活性剂serrawettin W1带来的困扰,通过敲除serrawettin W1合成的关键基因,大幅减少了发酵泡沫,并使得2,3-丁二醇的产量有小幅提升。
3.2 乳化活性
由于serrawettins的分子结构中具有疏水末端和亲水末端,因此具有两亲性。这种两亲性质会导致serrawettins在2种不互溶的液体间积累,减小两相之间的斥力[24],促进一种液体分散到另一种液体中,从而导致两相乳化[20]。乳化活性通常是筛选生物表面活性剂的方法之一,通过测量乳化层的高度,除以溶液总高度,从而确定乳化指数,根据乳化指数的大小判断乳化活性的高低。煤油和柴油是测定乳化指数最常用的烃类[25-26]。
Serrawettins具有乳化活性,可以促进疏水性物质的溶解[27]。Wei等[28]获得了一株生物表面活性剂产生菌S.marcescensSMΔR,其发酵上清液对煤油和柴油的乳化指数分别为72%和40%,经鉴定,该表面活性剂为serrawettin W1,并测定了其与煤油和柴油的临界乳化指数,结果表明煤油的最低乳化剂用量为800 mg/L,柴油的最低乳化剂用量为600 mg/L[21]。在利用疏水性碳源发酵生产灵菌红素时,往往能够观察到油脂的乳化现象,但很少有研究者就这一现象展开深入研究。因此,可以进一步探究serrawettins的乳化活性对于沙雷氏菌摄取疏水性碳源的作用。
4 Serrawettins的生物合成及调控
脂肽的生物合成是由非核糖体肽合成酶(NRPS)介导的多步骤过程。与脂肽surfactin的合成机制类似,serrawettins同样是由NRPS催化合成的,serrawettin W1和serrawettin W2的合成机制已经被报道[6-7],而serrawettin W3的合成机制还未阐明。基因swrW和swrA分别是编码serrawettin W1合成酶SwrW和serrawettin W2合成酶SwrA的功能基因[29]。
4.1 Serrawettin W1的生物合成
Serrawettin W1的生物合成主要涉及2个基因:swrW和pswP。由swrW编码的serrawettin W1合成酶(SwrW)属于NRPS家族,由1 310个氨基酸残基构成,包含4个不同的功能结构域(图5),分别为缩合结构域(C)、腺苷酰化结构域(A)、硫醇化结构域(T)和硫酯酶结构域(TE)[30]。基因pswP在serrawettin W1的合成中也是必不可少的,其功能类似surfactin合成过程中的sfp基因,编码的功能蛋白PswP(磷酸泛酰巯基转移酶,PPTase)是PCP(T域)的激活因子,负责激活PCP[31],只有激活后的PCP才能够连接丝氨酸残基。因此,基因swrW和pswP在serrawettin W1的生物合成过程中缺一不可,而关于serrawettin W1中脂肪酸链的生物合成途径至今未见报道。

图5 Serrawettin W1的生物合成示意[6]Fig.5 Schematic diagram of biosynthesis of serrawettin W1[6]
Serrawettin W1合成的具体过程见图5。①L-Ser进入SwrW的A域,由A域催化形成活化形式的腺嘌呤-L-Ser;②活化后的L-Ser转移到T域,连接到肽酰-载体蛋白PCP;③此时,由C域催化3-羟基癸酸-ACP与活化的丝氨酸残基通过酰胺键进行缩合形成L-Ser-脂酰基残基;④L-Ser-脂酰基残基由C域转移到TE域;⑤下一个L-Ser进入A域,重复前面的步骤,这时T域上的残基与TE域上的残基进行酯键的缩合;⑥最后整个残基转移到TE域,通过内酯键环化形成serrawettin W1[32]。
Zhang等[23]通过敲除swrW基因构建了serrawettin W1缺陷型菌株,从而解决了黏质沙雷氏菌产2,3-丁二醇发酵过程中的泡沫问题。Thies等[33]将S.marcescensDSM12481中的swrW基因克隆到E.coliBL21 Gold中,重组E.coli菌株成功合成了serrawettin W1。
4.2 Serrawettin W2的生物合成
Su等[7]推测serrawettin W2的脂酰基结构由聚酮合酶PKS合成,而肽环结构由NRPS SwrA共同催化合成。聚酮合酶PKS和NRPSswrA的编码基因共同存在于一个有间断序列的21 kb基因簇,2个基因的间距为9 478 bp。PKS由酰基转移酶(AT)、酮合成酶(KS)和酮还原酶(KR)这3个结构域构成,负责脂肪酸链的合成。SwrA由5个模块构成,每个模块由4个功能结构域构成,负责催化特定的氨基酸合成五肽,其具体合成过程见图6。①脂酰基的合成:PKS的3个结构域分别负责脂肪酸链的酰基转移、酮基合成和酮基还原,脂肪酸合成后以脂酰CoA的形式释放。②肽合成的起始:第1个氨基酸D-Leu进入SwrA第一个模块的A域,活化形成腺嘌呤D-Leu,然后转移到第一个模块的T域,这时由第一个模块的C域催化脂酰CoA与T域上的D-Lue残基进行缩合。③肽合成的延伸:每个模块按顺序合成相应的氨基酸残基,直到第5个L-Ile残基连接到第五个模块的T域。④内酯键的合成及释放:整个脂肽残基转移到TE域,由TE域催化L-Ile残基与脂肪酸链的β-羟基环化,形成环状脂肽serrawettin W2并释放[7]。值得关注的是,serrawettin W2的合成也需要PPTase激活swrA各个模块上的PCP功能域。Gerc等[34]在S.marcescensDb10菌株中发现,激活因子PswP对于serrawettin W2的合成也是必需的。

图6 Serrawettin W2的生物合成示意[7]Fig.6 Schematic diagram of the biosynthesis of serrawettin W2[7]
4.3 Serrawettins的合成调控
众所周知,灵菌红素和serrawettins的合成受到温度的影响。Matsuyama等[8]利用TLC分析了这一现象,后来有研究者就这一现象进行了深入研究。Tanikawa等[35]利用转座插入调控因子hexS获得了S.marcescens274的突变株S.marcescensTan1,将二者同时在30 ℃培养时,突变株中灵菌红素和serrawettin W1的出现时间与野生型相比均有所提前,而且产量较野生型菌株也有所提高;但在37 ℃培养时,突变株Tan1会形成淡红色的菌落,这可能是合成了灵菌红素和serrawettin W1。Tanikawa等[35]进一步分析发现:hexS的氨基酸序列与Erwiniacarotovora“ssp.”carotovoraLysR家族转录调控因子HexA具有高度的同源性;与HexA不同的是,hexS在灵菌红素和serrawettin的合成过程中属于负调控因子,其编码的蛋白HexS具有靶向性,HexS能够特异性地结合在pigA和swrW基因的上游,阻止了功能基因的转录表达,以致于灵菌红素合成酶和serrawettin W1合成酶都无法合成,因此无法合成灵菌红素与serrawettin W1。除此之外,hexS基因对于serrawettin W2和W3的合成以及其他几种蛋白酶、几丁质酶也具有同样的负调控作用[6]。然而hexS对于pswP并未表现出负调控作用,因此hexS基因并不影响pswP的转录表达[35]。
目前关于serrawettin W2的合成调控报道最多的是群体感应(QS)调控系统。Givskov等[36]在培养S.liquefaciens过程中,发现达到一定细胞密度时,S.liquefaciens的鞭毛会有明显增加,与此同时,细胞也具有高度的运动性,这种现象称为群体感应。QS现象的出现与信号分子AHL(N-acyl homoserine lactone) 有关。Eberl等[37]在S.l ̄i ̄q ̄u ̄e ̄f ̄a ̄c ̄i ̄e ̄n ̄sMG1的发酵上清液中检测到与AHL具有相同功能的BHL(N-butanoyl L-homoserine)和HHL(N-hexanoyl L-homoserine lactone),进而发现了BHL和HHL的合成酶基因swrI。通过插入失活swrI获得突变株S.liquefaciensMG44,观察到突变株失去了群集行为(swarming behavior),而通过外源添加BHL后,这种行为便会恢复。此后,Lindum等[38]研究发现,突变株S.liquefaciensMG44并不能合成生物表面活性剂serrawettin W2,而在外源添加BHL后则恢复了合成serrawettin W2的能力。这说明serrawettin W2的合成依赖于BHL,进一步证明了serrawettin W2的生物合成受到细胞密度的影响,与QS调控系统有关。除此之外,serrawettin W1同样也受到QS系统的调控[39-40]。
Serrawettin W3的生物合成及调控的报道至今还未见报道,需要进一步的探究以解析出来。
5 Serrawettins的提取及表征
目前还没有比较完善的serrawettins分析纯化方法,已报道的serrawettins分析表征方法仅限于TLC[8]、高效液相色谱(HPLC)[41]和高效液相色谱-质谱联用(LC-MS)[42]等分析手段。因此,寻找适合的serrawettins纯化和表征方法是推进其深入研究的重要步骤。
5.1 Serrawettins的提取
Serrawettins的分离纯化对于其应用非常重要,可以进一步探究纯化后serrawettins的理化性质及生物学功能。Serrawettins的提取大多采用萃取的方法。Shanks等[43]用乙酸乙酯萃取发酵液中的serrawettin W1,并用于后续分析,但所分离的serrawettin W1纯度不高,而且萃取过程中会引起乳化,给后续的分离纯化带来不便。闞公[21]对serrawettin W1的分离纯化进行了较为详细的研究,以甲醇、氯仿对发酵液中的serrawettin W1进行提取,并对其性质进行了研究。Su等[7]先用乙醇提取发酵液中的serrawettin W2,后用乙酸乙酯进一步萃取,再使用凝胶层析进行纯化。Lindum等[38]以等体积(含有1%甲酸)的乙酸乙酯对发酵液进行萃取,再以甲醇进行提取,分离得到358 mg的serrawettin W2粗品。
5.2 Serrawettins的表征
起初,研究者利用TLC对serrawettins进行分析。Matsuyama等[8]以氯仿、甲醇和5 mol/L氨水(体积比为80∶ 25∶ 4)作为展开剂,用 50%(体积分数)H2SO4喷洒层析板,在200 ℃加热后,可以在层析板上观察到serrawettin W1、W2和W3以及灵菌红素的显色斑点。但是TLC的局限性在于只能定性分析,而无法定量分析serrawettins。当前,研究者们通常采用LC-MS分析serrawettins的结构和分子量。Thies等[33]将swrW导入E.coliBL21 Gold中, 并利用HPLC-ESI-MS对产物进行分析,成功鉴定了发酵液中产物serrawettin W1的结构。另外,Nakagawa 等[41]将serrawettin W1水解并利用HPLC对3-羟基脂肪酸进行分析,以此得知,serrawettin W1具有不同的脂肪酸链长度。然而,目前还没有serrawettins W1常规定量分析方法的报道,这也使得serrawettin W1的高产菌株选育和发酵优化等工作效率不高。
Serrawettin W2的结构类似于surfactin,在紫外波长215 nm处具有吸收峰[7],虽然可以推测在有标准品的情况下利用HPLC对其进行定量表征,但至今还未见有利用HPLC单独对serrawettin W2进行定量分析的报道。Su等[7]同样利用 HPLC-ESI-MS成功地鉴定出发酵液中serrawettin W2的结构。目前,针对serrawettin W3的表征方法尚未见报道。
6 Serrawettins的应用前景
与化学表面活性剂相比,生物表面活性剂具有许多优势。由于它们低毒,可生物降解,生产成本低,并且可耐受极端的pH、温度和盐度。因此,由于生物表面活性剂的化学性质和结构的多样性,其广泛地应用于石油、医药、食品及生物修复等行业[43]。Serrawettins作为生物表面活性剂,同样具有抑菌、抗肿瘤、防污及乳化烃类化合物的特性,这使得serrawettins在生物医药、石油工业具有广泛的应用前景。
6.1 在生物医药领域的应用潜力
沙雷氏菌属所产的生物表面活性剂,如serrawettins、rubiwettins和stephensiolides等均具有生物学活性特征。其中,人们对serrawettins研究得相对较为深入。Serrawettins具有较强的抑菌作用,可以用于抗生素开发和生物防治。Heise等[44]从Serratiamarcescens2MH3-2菌株获得serrawettin W2粗提物,发现其具有良好的抗菌和抑制线虫的活性。Dwivedi等[45]纯化了serrawettin W1及同系物,之后测定了其对分枝杆菌的抑制作用,结果发现serrawettin W1及其同系物对分枝杆菌均具有抑制作用。Hage-Hülsmann等[46]进一步研究了S.marcescensDSM 12481所产次级代谢产物灵菌红素和serrawettin W1对谷氨酸棒状杆菌的抑菌活性,结果发现,与单一化合物相比,灵菌红素与serrawettin W1的组合抑菌效果更好,这表明,使用生物分子组合策略开发抑菌剂可能具有较好的应用前景。Su等[7]考察了S.surfactantfacienssp.nov.YD25T代谢合成serrawettin W2的抑菌活性,结果发现serrawettin W2为30 μg/mL时,对模式菌株Staphylococcusaureus、Pseudomonasaeruginosa和Shigelladysenteriae均具有抑制作用。Kadouri等[47]认为,尽管沙雷氏菌属所产的生物表面活性剂对多种菌株均表现出了抑制作用,但是serrawettin W1在抑菌的同时还具有一定的细胞毒性,因此不能作为抗生素直接使用。
Serrawettins除抑菌活性之外,还具有抗癌活性。Perez等[48]研究了serrawettin W1的抗癌活性,发现serrawettin W1可降低多种癌细胞(Jurkat、Molt-4、NSO、 HGT-1、HT-29和GLC-4S)的活性,具有诱导肿瘤细胞凋亡的作用,而对正常细胞没有影响。Su等[7]发现serrawettin W2能够抑制癌细胞(HeLa和Caco-2)生长而表现出抗肿瘤的活性,其对正常细胞生长并无抑制作用。由此可见,serrawettins具有开发成治疗白血病、淋巴癌等化疗药物的潜力。
6.2 在石油工业的应用潜力
在石油工业中,表面活性剂应用得非常广泛。与化学表面活性剂相比,生物表面活性剂具有低毒、可生物降解、对环境友好等特点,因而得到了人们的青睐[49]。
Serratia属细菌作为一类常见的石油烃降解菌而被广泛报道。Serrawettins具有良好的表面活性和乳化石油烃效果,可以应用于微生物采油(MEOR)和生物修复。Ibrahim等[50]分离获得了一株S.marcescens,此菌可产脂肽类表面活性剂,该表面活性剂具有提高石油采收率的作用,原油的采收率达76%,可作为潜在的采油剂。Arajo等[51]利用SerratiamarcescensUCP 1549 发酵生产脂肽类表面活性剂,并提取粗品进行了洗油实验,结果发现,当该表面活性剂质量浓度为1 g/L时,可去除94%的机油,而对照组的机油去除率仅为63%。吴涛等[52]从石油污染的土壤中分离获得了一株Serratiasp.,该菌在7 d内对1 g/L的原油降解率达到56.7%,且能够高效合成生物表面活性剂;土壤修复实验表明,添加该菌分泌的表面活性剂可有效提高石油烃的生物可利用性,促进石油烃污染土壤的生物修复,但是并未对该生物表面活性剂的结构和类型进行鉴定。
7 结论与展望
脂肽类生物表面活性剂serrawettins具有抑菌、抗癌等生物学活性以及乳化、表面活性等,具有较好的应用前景。Serrawettin W1和serrawettin W2的合成机制和结构都已经获得解析,serrawettin W3的合成机制和结构还未阐明,需要进一步的研究。由于serrawettins的定量分析、分离纯化及结构表征等难度较大,人们对serrawettins缺乏深刻的认识;serrawettins的分离纯化以及定量表征等研究方法亟待突破。在合成生物学方面,针对serrawettins的生物合成途径,可以通过代谢工程的手段对合成调控的关键基因进行敲除或途径强化,构建serrawettins高产菌株或定向改造serrawettins结构组分,有助于提高serrawettins产量,促进生物表面活性剂serrawettins进入应用阶段。
