儿童溶血-尿毒症综合征继发肝损害并胆管炎1例并文献复习
2021-04-14王紫成怡冰王海军林莉王檬周冰燕樊培沛宋亚萍
王紫 成怡冰 王海军 林莉 王檬 周冰燕 樊培沛 宋亚萍
患者,杨某,女,5岁4个月,主因“发热4 d、眼睑浮肿伴皮疹3 d、尿少2 d和尿血1 d”,于2018年5月3日19时40分入院。入院前4d与感冒母亲接触后发热,体温37.4℃,未见寒战、抽搐、咳嗽、咳痰及腹痛、腹泻等表现。于当地诊所就诊,口服用药(具体药物名称及剂量不详)无好转;3 d前出现眼睑浮肿、颈部皮疹表现,经当地诊所诊断为“过敏性紫癜”,并接受输液治疗1 d(具体药物名称及剂量不详)无好转。2 d前因尿少,转至驻马店市中心医院儿科重症监护病房(PICU),住院治疗2 d,1 d前因尿血症状接受2单位悬浮红细胞输注、静脉用人免疫球蛋白2.5 g×7支及激素冲击治疗(具体药物名称及剂量不详)无好转。于我院急诊怀疑“多脏器损伤”收入内科ICU住院。患儿既往健康状况及发育状况良好,发病后精神反应较差,食欲及睡眠质量差,小便异常,大便正常。
入院查体:体温:36.8℃,脉搏:135次/min,呼吸:21次/min,血压:135/84 mmHg。面色及全身皮肤苍白,神志清楚,精神欠佳,全身有散在出血点或瘀斑,且多集中于颈部,融合呈片状,压之不褪色。双侧瞳孔等大等圆,直径3.0 mm,对光反射灵敏,眼睑及双下肢水肿明显。予以鼻导管吸氧,未见口唇发绀,颈软,呼吸急促,“三凹征”阴性,双肺呼吸音粗,未闻及明显干湿性啰音。律齐,心音有力,心前区未闻及明显病理性杂音,有腹胀现象,但无压痛,肝肋下2 cm,质软,未触及包块,肠鸣音正常。四肢肌张力正常,存在膝腱反射,血块收缩时间(CRT)2 s,末梢循环良好。实验室检查(外院):血常规:血红蛋白(Hb)61 g/L,血小板计数(PLT)30.00×109/L,尿常规(2018.05.02):小便呈淡茶色,微浊,白细胞(+-),隐血(++),尿蛋白(+++),葡萄糖(++++),白细胞51.1 μL,红细胞253.1/μL,镜检白细胞9.2/HPF,红细胞45.6/HPF;尿素氮(BUN)40.7 mmol/L,肌酐219.5 μmol/L。诊疗过程:因患儿具有“发热、皮疹、尿少、血尿、蛋白尿”等症状,并伴“面色苍白、精神欠佳、眼睑浮肿、皮肤瘀斑或出血点”等,结合实验室指标初步诊断为:1.溶血-尿毒症综合征;2.呼吸功能不全;3. PLT减少症;4.重度贫血;5.肺炎。治疗过程:采取血浆置换1次,洗涤红细胞输注,2018年5月12日加用甲泼尼龙琥珀酸钠进行抗炎、抑制免疫反应治疗,辅以保肝、利尿、纠正水电解质平衡紊乱等,病情好转,肝功能正常,尿色正常,PEL正常,无明显不适症状,于2018年5月26日12时00分出院。出院后治疗:甲泼尼龙片口服,早3片/次,中、晚各2片/次;碳酸钙D3颗粒口服,3 g/次,1次/d;百令胶囊口服,0.5 g/次,3次/d;维生素AD滴剂口服,2000 IU/次,1次/d;槐杞黄颗粒口服,10 g/次,2次/d;卡托普利片口服,5 mg/次,3次/d。
2018年6月4日,再次因“腹痛2d”于就诊肾内科门诊,腹痛无明显诱因,主要发生于上腹部,呈阵发性,可自行缓解,未见发热及其他临床症状,肾内科门诊考虑为“溶血尿毒综合征、腹痛”。2018年6月4日门诊血常规+CRP检查:WBC 12.20×109/L,RBC 3.73×1012/L,Hb 129 g/L,PLT 374×109/L,中性粒细胞百分比(NEUT%)79.5 %,淋巴细胞百分比(LYM%)16.1%,单核细胞百分比(MO%)4.2 %;肺炎支原体血清学试验(-),C-反应蛋白(CRP)<0.8 mg/L。尿常规:红细胞 51 /μL, 白细胞 4 /μL, 白细胞团 0 /μL, 鳞状上皮细胞 3 /μL, 非鳞状上皮细胞 0 /μL, 透明管型 0 /LPF, 未分类管型 0 /LPF, 细菌计数 0 /μL, 未分类结晶 0 /μL, 酵母菌 0 /μL, 黏液丝 86 /LPF, 尿胆原(3.4 μmol/L)正常, 尿胆红素(1+) 17 μmol/L, 隐血(+++)≥200 cell/μL, 尿蛋白(+++)≥3.0 g/L, 亚硝酸盐(-), 白细胞 弱阳性 15 cell/μL, 尿葡萄糖(-), 尿比重≥1.030 , 酸碱度(pH)6.5 , 尿微量白蛋白>0.15 g/L, 酮体(-), 维生素C 0.0 。影像学检查:腹部彩超示肝大,胆总管内径增宽,胆囊管迂曲扩张;胆囊底部高回声团,体部至颈部非均质回声;进一步检查示双肾回声稍强、分布欠均匀,外科门诊考虑诊断为“胆管炎”。为进一步完善诊治,我科门诊以“溶血尿毒综合征,腹痛,胆管炎”,于2018年6月5日14时14分收治住院。
入院检查呼吸道病原学十项、体液免疫功能及补体(C3、C4)均未见异常。住院后检查:降钙素原(PCT) 0.096 ng/mL,红细胞沉降率(ESR)21 mm/h,细菌内毒素、EB病毒(EBV)、巨细胞病毒DNA、T淋巴细胞亚群等均未见异常。心电图检查示窦性心律;胸腹立位片示双肺纹理粗,腹部未见明显异常征象;上腹部MR平扫+磁共振胰胆管成像(MRCP)均未见明显异常。急查尿淀粉酶、凝血四项+D二聚体均未见异常。急查血生化:总胆红素(TBil)19.1 μmol/L, 结合胆红素 (CB)5.0 μmol/L, 未结合胆红素(UCB)14.1 μmol/L, 谷丙转氨酶(ALT)1131.5 U/L, 谷草转氨酶(AST)321.3 U/L, 碱性磷酸酶(ALP)304.6 U/L, γ-谷氨酰转肽酶(γ-GT) 514.1 U/L, 总蛋白(TP)60.3 g/L, 白蛋白(Alb)33.4 g/L, 球蛋白(Glb)26.9 g/L, 白球比(A/G) 1.2 , 乳酸脱氢酶(LDH)661.1 U/L, 肌酸激酶(CK)52.0 U/L, 肌酸激酶同工酶(CK-MB)5.3 U/L, 葡萄糖 5.83 mmol/L, 甘油三脂(TG) 2.28 mmol/L, 总胆固醇(TC)7.16 mmol/L, 尿素 6.6 mmol/L, 肌酐(Cr)38.5 μmol/L, 尿酸217.4 μmol/L, 淀粉酶 68.4 U/L, 钾 3.48 mmol/L, 钠 131.4 mmol/L, 氯 97.3 mmol/L, 钙 2.38 mmol/L。血常规+CRP:白细胞 9.38×109/L, 红细胞 3.81×1012/L, Hb 129 g/L, PLT 368×109/L, NEUT% 81.7 %,LYM% 16.5 %, MO% 1.5 %, CRP <0.8 mg/L。手工血常规:NEUT% 32.0 %, LYM 64.0 %, MO% 4.0 %, 网织红细胞 0.012 , 白细胞形态正常。成熟红细胞大小形态正常,色素充盈可,血小板形态描述血小板散在、聚集可见,各细胞形态未见异常。尿常规:红细胞 62 /uL, 黏液丝 115 /LPF, 隐血(1+) 25 cell/μL, 尿蛋白(+++)≥3.0 g/L,尿红细胞形态:镜检白细胞 4~6 /HP, 镜检红细胞(+), 镜检上皮细胞 1~2 /HP, 环形红细胞 4%, 穿孔红细胞 3 %, 芽胞红细胞 0 %。肾功能:N-乙酰-β-D-氨基葡萄糖苷酶 79.10 U/L, 尿微量白蛋白 532 mg/L, α1微球蛋白 94.29 mg/L, 尿转铁蛋白 18.40 mg/L, 尿β2微球蛋白 411.30 μg/L;24小时尿蛋白定量:尿量0.4 L,24 h尿蛋白定量0.453 g /24 h,合每日26 mg/kg。复查生化:ALT 310.7 U/L, TP 51.0 g/L, Alb 28.5 g/L, LDH 273.2 U/L,较前减轻。诊断:1.胆管炎,2. 溶血-尿毒症综合征,3.肝损害,4.低钾血症。治疗予以严密心电监护、血压监测,禁食、补液,予头孢他啶抗感染,予甲泼尼龙琥珀酸钠针抑制免疫,辅以补液、保肝、补钾、维持内环境稳定等综合治疗。2018年6月11日尿常规:尿蛋白(++),24h尿蛋白定量0.504 g/24 h,合29 mg/kg/d。2018年6月12日尿常规:红细胞 31 /μL, 尿蛋白(+++)≥3.0 g/L, 酸碱度(pH)7.5。血常规+CRP:白细胞 11.13×109/L, 红细胞 3.39×1012/L, Hb 112 g/L, PLT 271×109/L, NEUT% 44.0 %, LYM% 52.0 %, MO% 3.5 %,CRP<0.80 mg/L;血生化:ALT 76.7 U/L, AST 16.6 U/L, ALP 158.9 U/L, γ-GT 315.5 U/L, TP 50.0 g/L, Alb 34.3 g/L, Glb 15.7 g/L, LDH 275.0 U/L, α-羟丁酸脱氢酶(α-HBDH) 230 U/L, CK 21.0 U/L, CK-MB 8.0 U/L, 钾 2.88 mmol/L, TG 1.93 mmol/L, TC 5.85 mmol/L, HDL 2.18 mmol/L, 免疫球蛋白G(IgG) 4.29 g/L。复查肝功能正常。2018年6月12日,腹部上腹部MR平扫+MRCP未见明显异常;2018年6月14日尿常规尿蛋白(+++)≥3.0 g/L。24 h尿蛋白定量 1.141 g /24 h。钾 2.98 mmol/L。生化:总蛋白 50.4 g/L, 白蛋白 32.8 g/L, 球蛋白 17.6 g/L;凝血功能 D二聚体大致正常。2018年6月16日,复查腹部彩超提示:腹部彩超示肝稍大,胆囊内非均质团及颈部少许等回声(见图1~2),双肾实质回声增强,盆腔积液;腹部彩超复查仍可见双肾实质回声增强。诊断“溶血-尿毒症综合征、胆管炎、肝损害”。治疗主要是对症支持治疗、保肝等综合治疗。患儿无腹痛、发热、肉眼血尿、贫血、面色苍白、咳嗽等,复查感染指标降至正常,肝功能恢复正常,达出院标准,于2018年6月18日11时31分出院,2周后复查。出院后口服甲泼尼龙片减量,改为早、中、晚各2片/次。2018年12月因合并呼吸道感染再次就诊,常规对症治疗控制,复查彩超显示肝脏及胆囊超声表现正常。
出院后随访,2019年7月7日门诊复查腹部彩超:肝脏:肝脏位置、形态、大小正常;肋下0 mm,包膜完整,表面光滑,实质回声分布均匀,肝内管系显示清晰,门脉主干内径未见明显增宽。彩色多普勒(CDFI)示门脉内未见明显异常血流信号,胆总管肝门段内径未见明显增宽。胰腺:胰腺大小、形态正常,轮廓清晰,内部回声均匀,胰管未见扩张,胰腺内未见占位病变。胆囊:36.9×11.3 mm,壁光滑,内未见明显异常回声。

图1 健康儿童胆囊图像
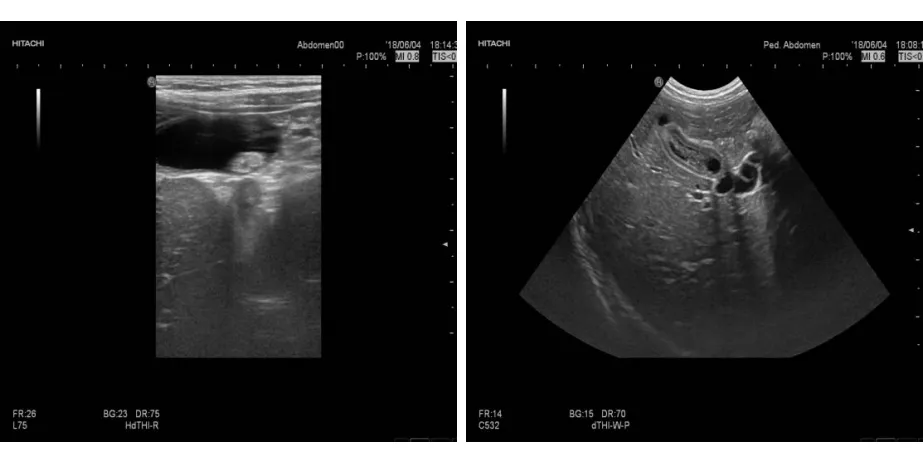
A:胆囊底部高回声团;B:胆囊体部至颈部非匀质回声团
讨论溶血尿毒症综合征(Hemolytic Uremic Syndrome,HUS)是一种较为少见的肾脏疾病,主要是以急性微血管性溶血性贫血、PLT减少及急性肾衰竭(acute renal failure,AFR)为主要特征的“三联综合征”,其中,肾脏局部微血管性溶血以及血管内凝血是其主要发病机制[1]。HUS发病多见于小儿,是引起儿童AFR的常见原因之一,发病不同阶段容易误诊为溶血性贫血、AFR等,增加临床诊断及早期治疗困难。由于本病发病急骤,病情较重,病死率较高。近年来,因诊疗技术的发展及血液净化尤其是血浆置换的应用,其死亡率有明显下降,但存活患者往往伴有肾功能损害,部分最终发展成为慢性肾衰竭(chronic renal failure,CRF)[2]。近年来,HUS发病率有逐年增多趋势,但国内尚无充分流行病学研究资料。
根据HUS的临床表现及病因,可将其分为典型HUS即腹泻相关型HUS(diarrhea-associated HUS,D+HUS)与非典型HUS即非腹泻相关型(non-diarrhea HUS,D-HUS)两类,根据是否包含“三联综合征”又可分为部分型(2项)与完全型(3项)两类[3]。文献报道显示,HUS中以D+HUS居多,约占80%~90%,且多以儿童为主,55%~70%存在ARF,但多可获得良好预后,25%的患儿可出现肾功能下降,仅3%左右儿童可发展为终末期肾病(end-stage renal disease,ESRD)[4-5]。D-HUS仅占5%~10%,以成人相对多见,且往往具有家族史或以散发为主。相比于D+HUS,D-HUS往往预后较差,复发率及病死率较高,存活者中50%左右可进展为ESRD,且多发生于发病2年内[6]。
儿童HUS的临床表现复杂且轻重悬殊差异较大,部分患儿早期缺乏典型临床症状而导致误诊,延误治疗时期,确诊时往往呈多系统损害[7]。陈敏广等[8]报道11例D-HUS患儿中,平均年龄4.45岁,均存在不同程度的贫血以及镜下血尿,81.82%存在蛋白尿,54.55%具有发热,45.45%面色苍白,18.18%表现为浮肿和少尿。吴雪等[9]报道的西南地区39例D-HUS患儿的临床特征亦显示,本病以学龄期儿童好发,多以AFR、溶血、出血为主要表现,常见肾外表现为消化系统症状及神经系统症状。本研究报道1例HUS患儿具有发热史,早期并无其他明显异常,误治2d因“尿毒症”而接受治疗,短期内出现以眼睑浮肿、颈部皮疹、尿血等症状,后以“多脏器损伤”收治ICU,入院后进一步检查才确诊为HUS,且因其无腹泻、腹痛等表现,属于D-HUS。该例患儿的发病始动因素并不明确,但鉴于其与感冒母亲接触史,推测可能与病毒感染有关,但该例患儿呼吸道病原学十项检查并未见异常。Kobbe等[10]也报道了1例病毒感染相关D-HUS。因此,在病程中需密切监测有无溶血、PLT减少等,一旦发现溶血、PLT减少等,警惕血栓性微血管病,同时及时寻找辅助诊断证据,并明确其病因分类,如出现以下情况则基本可诊断为HUS:①急性肾损伤,除外其他疾病所致如脓毒症、弥漫性血管内凝血等;②微血管病性溶血性贫血,Hb<100 g/L,经外周血涂片存在红细胞碎片,Coombs试验(-),网织红细胞异常升高,乳酸脱氢酶>460 U/L;③PLT<150×109/L,如无腹泻症状则为D-HUS。本例患儿发病过程中无腹泻等消化系统表现,除发热外以肾损害(水肿、尿少及尿检异常)为主,并伴有微血管病性溶血性贫血、PLT减少、贫血、肺炎等,符合非典型HUS即D-HUS。
HUS的临床表现差异较大,目前尚缺乏统一有效的治疗方案,主要针对其病因、病机及机体损害情况进行治疗。D-HUS的治疗主要行对症支持和尽早透析或血浆治疗,其他治疗还包括使用免疫抑制剂、激素、丙种球蛋白等[11]。陈佳慧等[12]报道66例儿童D-HUS中均接受血浆治疗,且多配合激素、免疫抑制剂治疗,溶血控制良好,肾功能基本恢复,仅7.8%的患儿遗留肾功能异常。本研究中,该例D-HUS患儿在接受血浆置换、输注洗涤红细胞、保肝等对症支持治疗的基础上,辅以甲泼尼龙琥珀酸钠抗炎抑制免疫反应后病情得以控制。
值得注意的是,HUS由于病情严重,发病过程中可能出现其他脏器系统损伤,既往多集中于呼吸系统、心血管系统的观察,该例患儿在病程中也出现了呼吸功能、肺炎、感染等肾外表现。本研究中,该例D-HUS患儿在初步控制D-HUS后又出现阵发性腹痛,复查彩超及相关指标显示伴发肝损伤、胆管炎,且病程中出现低钾血症(钾 3.48 mmol/L、2.88 mmol/L、2.98 mmol/L)。HUS并发肝损伤、胆管炎者少见,考虑为D-HUS患儿机体免疫功能受损及炎症细胞因子活化等有关。同时,药物因素也可能与肝损伤有关,如使用甲氨蝶呤等免疫抑制剂具有一定的肝脏毒性,但大部分药物所致肝损伤可获得良好疗效[13]。由此可见,D-HUS往往病情较重,容易累及多脏器,病程中可能出现肝胆损害,治疗期间除检测D-HUS相关表现外,还应注重肾外脏器血液指标及影像学观察。在完善抗感染、补液、激素、补钾、保肝等综合治疗后,肝胆功能恢复,病情得以控制,预后良好。
分析本文1例患儿的诊疗过程及转归,有以下诊治经验:(1)儿童HUS尤其是D-HUS往往病发突然,始动因素不明或无特异性,病情较重且进展迅速,多存在典型溶血性贫血及AFR表现,基层医院初期误判风险较大;(2)临床表现复杂多样且进展迅速,容易累及多脏器,急性期后可能出现肝胆损害等继发性损害,应综合分析患儿的临床症状及体征,结合各项辅助检查及早诊断和治疗,并加强随访、跟踪报告,以进一步发现和阻止病情进展。在疾病治疗方面,强调以对症支持为主的综合治疗:(1)严密监控生命体征变化,及时纠正水电解质紊乱、利尿、降压、纠正贫血等,同时应补充适当的维生素、能量及影响;(2)早期严密监测并积极控制AFR是治疗本病的关键,无尿超过1d及尿素氮急剧升高,并伴有顽固性高血压、水肿等表现者,建议及时行血液透析治疗,以保护肾功能,以维持机体内环境稳定,为后续治疗赢得宝贵时间[14];(3)血浆治疗对于改善HUS急性期症状以及相关指标异常意义重大,对于因大量血浆短缺或技术受限而致血浆置换不能实施时,可采用冰冻血浆输注,但避免短期大量输注血浆引起容量负荷加重或肺水肿[15];(4)活动性溶血,伴强烈炎症反应如WBC、CRP明显升高时可采取免疫球蛋白治疗,以提高机体免疫功能,消除潜在感染风险[16];(5)激素治疗:溶血难以控制的重症患者,早期应用甲泼尼龙有利于抑制免疫功能及炎症“瀑布反应”,控制溶血发展,从而减少肾功能进一步损害,待肾功能稳定及蛋白尿、血尿缓解后减量[17];(6)免疫抑制剂有利于抑制细胞因子生成及循环免疫复合物等的释放,减轻或减少免疫性炎症损伤加重AFR,从而保护肾功能,同时也可控制溶血并提高PLT,但具体剂量及疗程应根据患儿病情定夺[18]。杨焕丹等[19]对4例重症HUS伴大量蛋白尿患儿在激素冲击治疗、抗凝、对症治疗等基础上,后续加速环磷酰胺序贯冲击治疗,病情得以控制。因此,对HUS尤其是D-HUS患儿,在严密监测典型症状、体征变化的同时,还需密切观察肾外脏器系统变化,个体化施治,病情控制后仍应加强随访,以便及时发现病情变化并采取有效治疗。
